1 . (1)浓硫酸和四氧化三铁反应______ ;
(2)氯酸钾和三氧化二铬熔融制铬酸钾_______ ;
(3)将硒单质和氯化银加入沸腾的氢氧化钠溶液中______ ;
(4)用次氯酸钠和氢氧化钠加入氢氧化铜制取铜酸钠______ ;
(5)在浓硝酸中加入二氧化碲和高锰酸钾制备碲酸_________ 。
(2)氯酸钾和三氧化二铬熔融制铬酸钾
(3)将硒单质和氯化银加入沸腾的氢氧化钠溶液中
(4)用次氯酸钠和氢氧化钠加入氢氧化铜制取铜酸钠
(5)在浓硝酸中加入二氧化碲和高锰酸钾制备碲酸
您最近一年使用:0次
解题方法
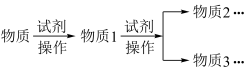
2 . 粘土帆矿(含V2O5、Fe2O3、Al2O3、SiO2等不溶性成分)制备V2O5的工艺流程如下:

已知: ①硫酸氧钒[(VO)SO4]高温易分解生成VO2和SO3
②萃取剂对相关离子的萃取能力如下表:
回答下列问题:
(1)粘土钒矿焙烧时一般选择 250℃的原因是______ ,V2O5与浓硫酸生成硫酸氧钒的化学方程式______ 。
(2)为提高浸出效率可采取的操作有______ (答两条),浸出液中存在 VO2+、VO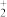 、 Fe3+、Al3+和
、 Fe3+、Al3+和 离子,萃取前加入铁粉的目的
离子,萃取前加入铁粉的目的______ 。
(3)“反萃取”用 20%硫酸目的为______ ,“氧化”的离子方程式为______ 。
(4)用反萃取法由碘的 CCl4溶液提取碘单质,画出流程图______ 。

已知: ①硫酸氧钒[(VO)SO4]高温易分解生成VO2和SO3
②萃取剂对相关离子的萃取能力如下表:
| 微粒 | VO2+ | VO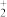 | Fe3+ | Fe2+ |
| 萃取能力 | 强(随pH增大而增强) | 弱 | 强 | 弱 |
(1)粘土钒矿焙烧时一般选择 250℃的原因是
(2)为提高浸出效率可采取的操作有
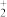 、 Fe3+、Al3+和
、 Fe3+、Al3+和 离子,萃取前加入铁粉的目的
离子,萃取前加入铁粉的目的(3)“反萃取”用 20%硫酸目的为
(4)用反萃取法由碘的 CCl4溶液提取碘单质,画出流程图

您最近一年使用:0次
2021-03-18更新
|
1684次组卷
|
3卷引用:山东省青岛市2021届高三3月统一质量检测化学试题
名校
解题方法
3 . 常温下,向1L 1.0mol/L的NaClO溶液中缓慢通入SO2气体,使其充分吸收,溶液pH与通入SO2物质的量关系如图所示(忽略溶液体积的变化和NaClO、HClO的分解)。下列说法错误的是
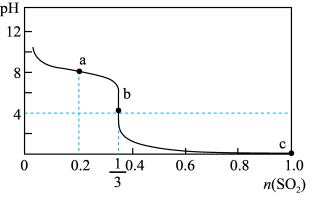

| A.常温下,HClO电离平衡常数的数量级为10﹣8 |
| B.a点溶液中存在 4c(Cl-)=c(HClO)+c(ClO-) |
C.b点溶液中存在c(Na+)>c(SO )>c(Cl-)>c(H+)>c(OH-) )>c(Cl-)>c(H+)>c(OH-) |
| D.c点溶液中c(H+)=2mol/L |
您最近一年使用:0次
2020-11-12更新
|
1729次组卷
|
5卷引用:湖北省武汉市华中师大第一附中高考化学押题试卷
名校
解题方法
4 . 已知还原性:SO >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )
 >I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )
>I-。向含a mol KI和a mol K2SO3的混合液中通入b mol Cl2充分反应(不考虑Cl2与I2之间的反应)。下列说法不正确的是 ( )A.当a=b时,发生的离子反应为SO +Cl2+H2O=SO +Cl2+H2O=SO +2H++2Cl- +2H++2Cl- |
B.当5a=4b时,发生的离子反应为4SO +2I-+5Cl2+4H2O=4SO +2I-+5Cl2+4H2O=4SO +I2+8H++10Cl- +I2+8H++10Cl- |
C.当a≤b≤ a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol a时,反应中转移电子的物质的量n(e-)为a mol≤n(e-)≤3a mol |
D.当a<b< a时,溶液中SO a时,溶液中SO 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b 、I-与Cl-的物质的量之比为a∶(3a-2b)∶2b |
您最近一年使用:0次
2020-08-18更新
|
3399次组卷
|
7卷引用:浙江省瑞安市上海新纪元高级中学2019-2020学年高一下学期期末考试化学试题(2)
浙江省瑞安市上海新纪元高级中学2019-2020学年高一下学期期末考试化学试题(2)(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练(浙江专版)(已下线)解密04 离子反应(讲义)-【高频考点解密】2021年高考化学二轮复习讲义+分层训练黑龙江省哈尔滨师范大学附属中学2020-2021学年高二下学期期末考试化学试题(已下线)课时06 与量有关的离子方程式书写-2022年高考化学一轮复习小题多维练(全国通用)辽宁省实验中学2021-2022学年高一上学期11月期中阶段测试化学试题福建省泉州市永春第一中学2022-2023学年高一上学期期末考试化学试题
2020·全国·零模
解题方法
5 . 某磷灰石主要成分有羟磷灰石[Ca5(PO4)3OH]和氟磷灰石[Ca5(PO4)3F];制备磷酸的两种工艺流程如图(部分产物和条件省略):
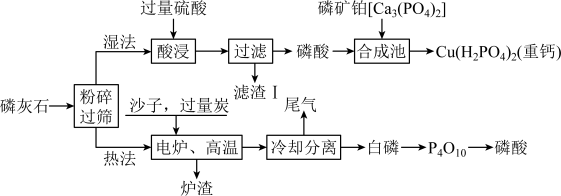
试回答下列问题:
(1)Ca5(PO4)3OH改写成“碱和盐”形式为:___ ;从组成看,Ca5(PO4)3F,类似下列盐的是___ (填字母)。
A.(NH4)2Fe(SO4)2 B.CaOCl2
C.BiOCl(Bi为+3价) D.Cu2(OH)2CO3
(2)提高“酸浸”速率的措施有___ (填一条即可)。
(3)“酸浸”中Ca5(PO4)3F和H2SO4反应的化学方程式为___ (要求:x用数字表示)。
(4)沙子、过量焦炭、氟磷灰石在电炉中反应生成CaSiO3、白磷、SiF4和另一种还原性气体,写出该反应的化学程式:___ ,在该反应中氧化产物与还原产物的物质的量之比为___ 。
(5)常温下,Ksp(CaSO4)=7.1×10-5,Ksp[Ca3(PO4)2]=2.1×10-33。H3PO4的电离常数:pK1=-lgK1=2.12,pK2=7.21,pK3=12.67,从离子积和浓度积关系角度分析Ca3(PO4)2和H2SO4反应生成CaSO4和H3PO4的主要原因是___ 。
(6)相对于湿法,热法的主要缺点有能耗高等,优点有___ (答一条即可)

试回答下列问题:
(1)Ca5(PO4)3OH改写成“碱和盐”形式为:
A.(NH4)2Fe(SO4)2 B.CaOCl2
C.BiOCl(Bi为+3价) D.Cu2(OH)2CO3
(2)提高“酸浸”速率的措施有
(3)“酸浸”中Ca5(PO4)3F和H2SO4反应的化学方程式为
(4)沙子、过量焦炭、氟磷灰石在电炉中反应生成CaSiO3、白磷、SiF4和另一种还原性气体,写出该反应的化学程式:
(5)常温下,Ksp(CaSO4)=7.1×10-5,Ksp[Ca3(PO4)2]=2.1×10-33。H3PO4的电离常数:pK1=-lgK1=2.12,pK2=7.21,pK3=12.67,从离子积和浓度积关系角度分析Ca3(PO4)2和H2SO4反应生成CaSO4和H3PO4的主要原因是
(6)相对于湿法,热法的主要缺点有能耗高等,优点有
您最近一年使用:0次
2013·上海·零模
解题方法
6 . 无机非金属材料、金属材料和有机高分子材料并称为三大材料,是发展高新技术的基石,在未来科技发展中发挥着重要的作用。新型材料α-Fe粉具有超强的磁性能,用作高密度磁记录的介质以及高效催化剂等。将5.60 g α-Fe粉与一定量水蒸气在高温下反应一定时间后冷却,其质量变为6.88 g。
(1)产生的氢气的体积为_________ mL(标准状况下)。
(2)将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量。____________
(3)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为___________ 。T的化学式为____________ 。
(4)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
①混合气体的平均摩尔质量为______________ 。
②填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
(5)有机高分子材料聚酯纤维可由二酸与二醇通过缩聚形成。如100个乙二酸分子与100个乙二醇分子发生缩聚,当形成一条聚酯链时,其(平均)式量达到最大(如图所示,其式量为11618)。
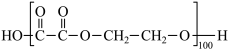
为降低聚酯链的长度与平均式量,可调整乙二酸与乙二醇的相对用量,使形成的聚酯链两端均为相同基团,从而无法再连接增长。现有100个乙二酸分子与105个乙二醇分子恰好完全反应,且聚酯链无法再增长。
①共形成_____ 条聚酯链。
②计算所得聚酯的平均式量。_______________
(1)产生的氢气的体积为
(2)将冷却后的固体物质放入足量FeCl3溶液中充分反应(已知Fe3O4不溶于FeCl3溶液),计算最多消耗FeCl3的物质的量。
(3)Nierite是一种高熔点高硬度的陶瓷材料。Nierite的摩尔质量为140 g/mol,其中硅元素的质量分数为60%。已知1 mol NH3与足量的化合物T充分反应后可得到35 g Nierite与3 mol HCl气体。Nierite的化学式为
(4)K金是常见的贵金属材料,除黄金外,还含有银、铜中的一种或两种金属。为测定某18K金样品的组成,将2.832 g样品粉碎后投入足量的浓硝酸中,充分溶解后,收集到NO2和N2O4的混合气体224 mL(折算至标准状况,下同),将该混合气体与84 mL O2混合后缓缓通入水中,恰好被完全吸收。
①混合气体的平均摩尔质量为
②填写该18K金的成分表(精确至0.01%,若不含该金属则填0)。
| 18K金成分 | Au | Ag | Cu |
| 含量(质量分数) | 75.00% |
(5)有机高分子材料聚酯纤维可由二酸与二醇通过缩聚形成。如100个乙二酸分子与100个乙二醇分子发生缩聚,当形成一条聚酯链时,其(平均)式量达到最大(如图所示,其式量为11618)。
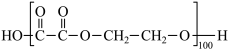
为降低聚酯链的长度与平均式量,可调整乙二酸与乙二醇的相对用量,使形成的聚酯链两端均为相同基团,从而无法再连接增长。现有100个乙二酸分子与105个乙二醇分子恰好完全反应,且聚酯链无法再增长。
①共形成
②计算所得聚酯的平均式量。
您最近一年使用:0次
2014·上海杨浦·三模
7 . 氯、磷的化合物广泛用于农药、医药、染料等领域。
(1)PCl3与氯气、水反应,得到HCl气体和一种无色透明有刺激性臭味的液体X,实验测定,1mol的H2O完全反应会生成2mol的HCl,则X的组成元素是___ ;已知X的相对分子质量为153.5,则X的化学式为___ 。
(2)X在高温与O2发生反应,形成P4O10(固态)和Cl2。将3.07gX与448mLO2(已折算至标准状况,下同)在高温下充分反应后,生成Cl2___ mol,气体的体积将变为___ mL。
(3)白磷在氯气中燃烧,一般得到PCl3和PCl5的混合物。2.480g白磷(P4),与一定量的氯气恰好完全反应,产物的总质量为14.550g,计算产物中PCl3的质量分数___ (保留4位有效数字)。
(4)PCl3和PCl5能发生如下水解反应:PCl3+3H2O→H3PO3+3HCl;PCl5+4H2O→H3PO4+5HCl
现将一定量的PCl3和PCl5混合物溶于足量水中,在加热条件下缓缓通入0.020molO2,恰好将H3PO3氧化为H3PO4。往反应后的溶液中加入15.725gCa(OH)2,充分反应后磷元素全部转化为Ca3(PO4)2沉淀,过滤后得到2.5L滤液,测得pH为12。计算:
①Ca3(PO4)2(已知式量310)沉淀的质量___ ;
②滤液中溶质的物质的量浓度___ 。
(1)PCl3与氯气、水反应,得到HCl气体和一种无色透明有刺激性臭味的液体X,实验测定,1mol的H2O完全反应会生成2mol的HCl,则X的组成元素是
(2)X在高温与O2发生反应,形成P4O10(固态)和Cl2。将3.07gX与448mLO2(已折算至标准状况,下同)在高温下充分反应后,生成Cl2
(3)白磷在氯气中燃烧,一般得到PCl3和PCl5的混合物。2.480g白磷(P4),与一定量的氯气恰好完全反应,产物的总质量为14.550g,计算产物中PCl3的质量分数
(4)PCl3和PCl5能发生如下水解反应:PCl3+3H2O→H3PO3+3HCl;PCl5+4H2O→H3PO4+5HCl
现将一定量的PCl3和PCl5混合物溶于足量水中,在加热条件下缓缓通入0.020molO2,恰好将H3PO3氧化为H3PO4。往反应后的溶液中加入15.725gCa(OH)2,充分反应后磷元素全部转化为Ca3(PO4)2沉淀,过滤后得到2.5L滤液,测得pH为12。计算:
①Ca3(PO4)2(已知式量310)沉淀的质量
②滤液中溶质的物质的量浓度
您最近一年使用:0次
名校
解题方法
8 . 某溶液中有S2-、SO32-、Br-、I-四种阴离子各0.1mol。现通入Cl2,则通入Cl2的体积(标准状况)和溶液中相关离子的物质的量的关系图正确的是
A. | B.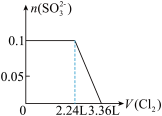 |
C.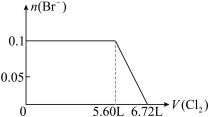 | D.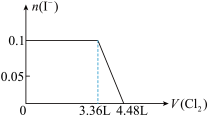 |
您最近一年使用:0次
2020-03-21更新
|
2528次组卷
|
5卷引用:上海市普陀区2016届高三下学期质量调研化学试题
上海市普陀区2016届高三下学期质量调研化学试题(已下线)小题必刷05 离子检验与推断——2021年高考化学一轮复习小题必刷(通用版)重庆市第二十九中学2021届高三上学期10月月考化学试题(已下线)练习6 常见物质的检验-2020-2021学年【补习教材·寒假作业】高一化学(苏教版)河北省昌黎第一中学2023届高三上学期第二次调研考试化学试题
解题方法
9 . 向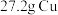 和
和 的混合物中加入某浓度的稀硝酸
的混合物中加入某浓度的稀硝酸 ,固体物质完全反应,得到标准状况下
,固体物质完全反应,得到标准状况下 和
和 的混合气体及
的混合气体及 。在所得溶液中加入
。在所得溶液中加入 的NaOH溶液
的NaOH溶液 ,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为
,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为 。下列有关说法正确的是
。下列有关说法正确的是
①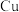 与
与 的物质的量之比为
的物质的量之比为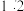
②硝酸的物质的量浓度为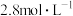
③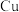 、
、 与硝酸反应后剩余
与硝酸反应后剩余 为
为
④产生的 的体积为
的体积为
⑤原混合物中Cu的质量分数为
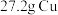 和
和 的混合物中加入某浓度的稀硝酸
的混合物中加入某浓度的稀硝酸 ,固体物质完全反应,得到标准状况下
,固体物质完全反应,得到标准状况下 和
和 的混合气体及
的混合气体及 。在所得溶液中加入
。在所得溶液中加入 的NaOH溶液
的NaOH溶液 ,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为
,此时溶液呈中性,金属离子已完全沉淀,沉淀质量为 。下列有关说法正确的是
。下列有关说法正确的是①
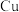 与
与 的物质的量之比为
的物质的量之比为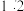
②硝酸的物质的量浓度为
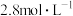
③
 、
、 与硝酸反应后剩余
与硝酸反应后剩余 为
为
④产生的
 的体积为
的体积为
⑤原混合物中Cu的质量分数为

| A.①⑤ | B.②④ | C.①④ | D.②③ |
您最近一年使用:0次
2020-01-26更新
|
3148次组卷
|
2卷引用:2020届高三化学二轮冲刺新题专练——硝酸的性质及应用(强化练)
解题方法
10 . 已知草酸为二元中强酸,具有较强还原性,且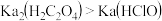 ,下列说法正确的是
,下列说法正确的是
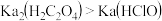 ,下列说法正确的是
,下列说法正确的是
A.草酸与氢氧化钠溶液混合呈中性时,溶液中存在: |
B.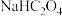 与NaClO溶液混合,反应的离子方程式为: 与NaClO溶液混合,反应的离子方程式为: |
C.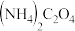 溶液中: 溶液中:  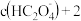  |
D.草酸使酸性 溶液褪色,离子方程式为: 溶液褪色,离子方程式为: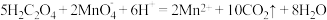 |
您最近一年使用:0次



