名校
解题方法
1 .  可消除NO的污染,反应方程式为:
可消除NO的污染,反应方程式为: 。现有NO与
。现有NO与 的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
 可消除NO的污染,反应方程式为:
可消除NO的污染,反应方程式为: 。现有NO与
。现有NO与 的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是
的混合物共1 mol充分反应,若氧化产物与还原产物质量相差1.4g,则下列判断中正确的是| A.氧化产物与还原产物物质的量之比为3:2 |
B.反应中有4.48 L  被氧化 被氧化 |
C.转移电子数为1.2 |
D.原混合气体中NO、 物质的量之比为3:7或4:1 物质的量之比为3:7或4:1 |
您最近一年使用:0次
2022-12-07更新
|
1500次组卷
|
4卷引用:四川省成都市第七中学2022-2023学年高一上学期12月月考化学试题
名校
解题方法
2 . 白磷(P4)有毒,实验时若皮肤接触到白磷,应立即用稀CuSO4溶液清洗,发生两个反应:
反应①为P4和CuSO4反应的主要生成物为Cu、H3PO4和H2SO4;
反应②为11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4。
下列说法正确的是
反应①为P4和CuSO4反应的主要生成物为Cu、H3PO4和H2SO4;
反应②为11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4。
下列说法正确的是
| A.在反应①和②中,P4只作还原剂 |
| B.反应①中氧化产物与还原产物的个数之比为5∶2 |
| C.皮肤接触到白磷,用稀CuSO4溶液清洗后,应再使用NaOH溶液清洗 |
| D.若P4反应完全且转化为H3PO4的转化率是80%,理论上反应①和②消耗P4的个数之比为14∶11 |
您最近一年使用:0次
2022-11-09更新
|
1326次组卷
|
4卷引用:重庆实验外国语学校2022-2023学年高一上学期期中检测化学试题
名校
解题方法
3 . 已知:将Cl2通入适量NaOH溶液中,反应会放热,当温度升高后会发生如下反应:3Cl2+6NaOH=5NaCl+NaClO3+3H2O。则Cl2通入NaOH溶液的产物中可能有NaCl、NaClO、NaClO3中的两种或三种,且 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
 的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是
的值与温度高低有关。当参与反应的n(NaOH)= a mol时,下列说法错误的是| A.与碱的反应中,Cl2既是氧化剂又是还原剂 |
| B.参加反应的Cl2物质的量为0.5a mol |
C.若某温度下,反应后 =6,则溶液中 =6,则溶液中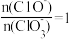 |
D.改变温度,反应中转移电子的物质的量可能为 mol mol |
您最近一年使用:0次
2022-10-24更新
|
2099次组卷
|
12卷引用:江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题
江苏省无锡市锡山高级中学2021-2022学年高一上学期期中考试化学试题山东省实验中学2022-2023学年高一上学期11月期中考试化学试题甘肃省酒泉市玉门油田第一中学2022-2023学年高一上学期期中考试化学(A卷)试题北京市第八中学2022-2023学年高一上学期12月月考化学试题陕西省榆林中学2022-2023学年高一上学期期末考试化学试题浙江省宁波市北仑中学2022-2023学年高一下学期期初返校考试(选考)化学试题江苏省苏州中学2022-2023学年高一下学期开学考试化学试题陕西省安康市2022-2023学年高一下学期开学摸底考试化学试题辽宁省沈阳市五校协作体2022-2023学年高一上学期期末考试化学试题 山东省淄博市部分学校联考2022-2023学年高一下学期4月期中考试化学试题新疆塔城地区第一高级中学2022-2023学年高一下学期开学考试化学试题(已下线)专题03 氧化还原反应-【好题汇编】备战2023-2024学年高一化学上学期期末真题分类汇编(人教版2019必修第一册)
名校
解题方法
4 . 向mg由铁粉和铜粉组成的混合物中,加入某浓度的稀硝酸,充分反应后测得生成NO的体积[V(NO)](已换算成标准状况下)、m(固体剩余质量)随加入的稀硝酸的体积的变化如图所示(设硝酸的还原产物只有NO)。下列说法中正确的是
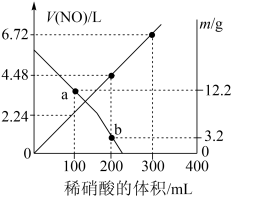

| A.稀硝酸的浓度为0.4mol·L-1 |
| B.a点时,100mL稀硝酸中溶解了Fe和Cu共8.4g |
| C.b点对应的溶液中可能含有的金属阳离子为Fe2+、Fe3+、Cu2+ |
| D.加入稀硝酸至400mL时,收集到的V(NO)约为6.91L |
您最近一年使用:0次
2022-05-03更新
|
3612次组卷
|
14卷引用:湖北省黄冈市部分重点中学2021-2022学年高一下学期4月期中联考化学试题
湖北省黄冈市部分重点中学2021-2022学年高一下学期4月期中联考化学试题辽宁省县级重点高中协作体2021-2022学年高一下学期期中考试化学试题江西省重点2021-2022学年高一下学期5月联考化学试题湖南省衡阳市部分校2021-2022学年高一下学期期末考试化学试题山西省长治市2021-2022学年高一下学期期末联合考化学试题(已下线)微专题23 金属与硝酸反应的规律与计算-备战2023年高考化学一轮复习考点微专题(已下线)第13练 氮及其化合物-2023年高考化学一轮复习小题多维练(全国通用)辽宁省沈阳实验中学2022-2023学年高二上学期开学考试化学试题湖北省华中师范大学第一附属中学2022-2023学年高一上学期竞赛生10月测试化学试题黑龙江省哈尔滨市第三中学校2022-2023学年高一下学期第一次验收考试化学试题江西省上饶市民校考试联盟2022—2023学年高一下学期阶段测试(四)化学试题新疆维吾尔自治区和田地区策勒县2022-2023学年高三上学期11月期中考试化学试题山东新高考2022-2023学年高一上学期质量测评模拟演练化学试题 四川省泸州市泸县第一中学2023-2024学年高一上学期1月期末化学试题
5 . 绿色化学在推动社会可持续发展中发挥着重要作用。某科研团队设计了一种熔盐液相氧化法制备高价铬盐的新工艺,该工艺不消耗除铬铁矿、氢氧化钠和空气以外的其他原料,不产生废弃物,实现了Cr—Fe—Al—Mg的深度利用和 内循环。工艺流程如图:
内循环。工艺流程如图:
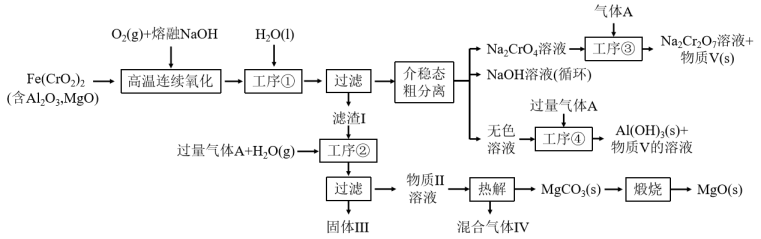
回答下列问题:
(1) 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为_______ 。
(2)工序③操作名称为_______ 。
(3)滤渣I的主要成分是_______ (填化学式)。气体A的化学式为_______ 。
(4)工序④中发生反应的离子方程式为_______ 。
(5)热解工序产生的混合气体最适宜返回工序_______ (填“①”或“②”或“③”或“④”)参与内循环。
(6)工序④溶液中的铝元素恰好完全转化为沉淀的pH为_______ 。(通常认为溶液中离子浓度小于 为沉淀完全;
为沉淀完全;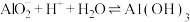 :
: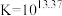 )
)
 内循环。工艺流程如图:
内循环。工艺流程如图:
回答下列问题:
(1)
 中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为
中Cr元素的化合价为+3价,写出高温连续氧化工序中该物质发生反应的化学方程式为(2)工序③操作名称为
(3)滤渣I的主要成分是
(4)工序④中发生反应的离子方程式为
(5)热解工序产生的混合气体最适宜返回工序
(6)工序④溶液中的铝元素恰好完全转化为沉淀的pH为
 为沉淀完全;
为沉淀完全;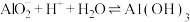 :
: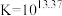 )
)
您最近一年使用:0次
名校
解题方法
6 . 从矿物学资料查得,一定条件下自然界中存在反应 。(其中
。(其中 中Fe为+2价S为-1价)下列说法正确的是
中Fe为+2价S为-1价)下列说法正确的是
 。(其中
。(其中 中Fe为+2价S为-1价)下列说法正确的是
中Fe为+2价S为-1价)下列说法正确的是A. 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
B.参与反应的 与转移电子数之比为1∶2 与转移电子数之比为1∶2 |
C. 只作还原剂 只作还原剂 |
D.产物中的 有一部分是氧化产物 有一部分是氧化产物 |
您最近一年使用:0次
2022-01-13更新
|
2081次组卷
|
4卷引用:江西省奉新县部分学校2021-2022学年高一上学期第二次月考化学试题
名校
解题方法
7 . X、Y、Z、M为短周期元素,原子序数依次增大。A~J均由该四种元素构成的单质或化合物,其转化关系如图所示,部分生成物省略。
已知:①A、B、C、G都是由两种元素构成的化合物,其中A、G分子所含的电子数为10e-,B、C分子所含的电子数为18e-;D为空气的主要成分之一、
②另取16.8gJ在真空条件下,控制温度350~400oC加热至完全分解,得到F和8.96L(已折算成标准状况)A两种物质。

请回答下列问题:
(1)写出C的化学式是___________ ;D的电子式是___________ 。
(2)请写出金属单质E在生产生活中的一种作用___________ 。
(3)写出次氯酸钠与过量气体A反应生成B的化学方程式是___________ ;B在制备过程中,气体A需要过量的理由是___________ 。
(4)写出F和G反应生成H和A的化学方程式是___________ 。
(5)B在加热条件下与CuO反应可生成气体D和金属单质,请设计实验方案,验证B与CuO反应后固体的成分(不考虑其他反应)___________ 。
(6)写出J在已知②条件下受热分解的化学方程式是___________ 。
已知:①A、B、C、G都是由两种元素构成的化合物,其中A、G分子所含的电子数为10e-,B、C分子所含的电子数为18e-;D为空气的主要成分之一、
②另取16.8gJ在真空条件下,控制温度350~400oC加热至完全分解,得到F和8.96L(已折算成标准状况)A两种物质。

请回答下列问题:
(1)写出C的化学式是
(2)请写出金属单质E在生产生活中的一种作用
(3)写出次氯酸钠与过量气体A反应生成B的化学方程式是
(4)写出F和G反应生成H和A的化学方程式是
(5)B在加热条件下与CuO反应可生成气体D和金属单质,请设计实验方案,验证B与CuO反应后固体的成分(不考虑其他反应)
(6)写出J在已知②条件下受热分解的化学方程式是
您最近一年使用:0次
2021-11-05更新
|
1090次组卷
|
2卷引用:浙江省诸暨市2018-2019学年高二下学期期末考试化学试题
解题方法
8 . 卡尔-费休(Karl-Fischer) 法是测定有机溶剂中的微量水含量的经典方法。所用试剂由碘、二氧化硫、吡啶(C5H5N,有机碱,与H+反应生成C5H5NH+)和无水甲醇按一定比例配制而成。该试剂与待测溶剂中的水反应后,产物的含量用库仑滴定法来测定。
(1)该方法的基本原理是利用碘与二氧化硫反应,反应方程式为___________ 。
(2)上述反应在测量条件下,是可逆反应,加入吡啶的作用是___________ 。
(3)加入甲醇可以进一步稳定产物,生成C5H5NHSO4CH3,请写出总反应。的化学方程式:___________ 。。
(4)测定20.0 mL有机溶剂含水量____ 。库仑滴定时,以24.8 mA恒定电流通电302s时达到反应终点(电极反应: 2I-- 2e = I2)。求该有机溶剂的含水量(mg·L-1) ____ 。已知: 1 mol电子的电量为9.65× 104C,电量计算公式Q=It
(1)该方法的基本原理是利用碘与二氧化硫反应,反应方程式为
(2)上述反应在测量条件下,是可逆反应,加入吡啶的作用是
(3)加入甲醇可以进一步稳定产物,生成C5H5NHSO4CH3,请写出总反应。的化学方程式:
(4)测定20.0 mL有机溶剂含水量
您最近一年使用:0次
20-21高二下·浙江·阶段练习
9 . 某兴趣小组对化合物X开展实验探究。
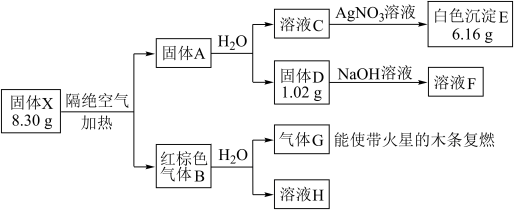
其中:X是易溶于水的强酸盐,由4种元素组成;D、E、G均为纯净物,B为混合物;溶液C、F、H均为单一溶质溶液,溶液H中含溶质0.06 mol,溶液C的焰色反应通过蓝色钴玻璃观察为紫色。
(1)组成X的4种元素是_______________ (填元素符号),E的化学式是______________ 。
(2)固体X隔绝空气加热分解的化学方程式____________________________ 。
(3)写出溶液F与少量溶液H反应的离子方程式____________________________ 。
(4)标况下,将红棕色气体B收集在一个大试管中,再倒插在水槽中,得到溶液的浓度为_______ mol/L (设溶质不扩散,)。
(5)写出红棕色气体B中的化合物气体(在答案中写出化学式)与溴蒸气的鉴别方法:______________ 。

其中:X是易溶于水的强酸盐,由4种元素组成;D、E、G均为纯净物,B为混合物;溶液C、F、H均为单一溶质溶液,溶液H中含溶质0.06 mol,溶液C的焰色反应通过蓝色钴玻璃观察为紫色。
(1)组成X的4种元素是
(2)固体X隔绝空气加热分解的化学方程式
(3)写出溶液F与少量溶液H反应的离子方程式
(4)标况下,将红棕色气体B收集在一个大试管中,再倒插在水槽中,得到溶液的浓度为
(5)写出红棕色气体B中的化合物气体(在答案中写出化学式)与溴蒸气的鉴别方法:
您最近一年使用:0次
10 . (1)浓硫酸和四氧化三铁反应______ ;
(2)氯酸钾和三氧化二铬熔融制铬酸钾_______ ;
(3)将硒单质和氯化银加入沸腾的氢氧化钠溶液中______ ;
(4)用次氯酸钠和氢氧化钠加入氢氧化铜制取铜酸钠______ ;
(5)在浓硝酸中加入二氧化碲和高锰酸钾制备碲酸_________ 。
(2)氯酸钾和三氧化二铬熔融制铬酸钾
(3)将硒单质和氯化银加入沸腾的氢氧化钠溶液中
(4)用次氯酸钠和氢氧化钠加入氢氧化铜制取铜酸钠
(5)在浓硝酸中加入二氧化碲和高锰酸钾制备碲酸
您最近一年使用:0次



