名校
1 . 草酸( )是生物体的一种代谢产物,在工业中有重要作用,下列说法不正确的是
)是生物体的一种代谢产物,在工业中有重要作用,下列说法不正确的是
 )是生物体的一种代谢产物,在工业中有重要作用,下列说法不正确的是
)是生物体的一种代谢产物,在工业中有重要作用,下列说法不正确的是| A.草酸具有还原性,能使酸性高锰酸钾溶液褪色 |
| B.草酸中两个羟基所处环境相同,两步电离的程度也相同 |
C.草酸中C原子的杂化方式为 |
| D.草酸可使澄清的石灰水变浑浊 |
您最近一年使用:0次
2024-09-05更新
|
77次组卷
|
2卷引用:浙江省强基联盟2024-2025学年高三上学期8月联考化学试题
名校
解题方法
2 . 化学是最具有应用价值的学科,为人类生存与繁衍担当了巨大的“社会责任”。
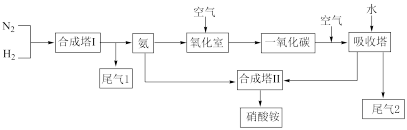
Ⅰ.硝酸铵是一种常用的化肥,也是重要的化工原料,常见工业制备方法如下图所示:
(2)氧化室中反应的化学方程式:_______ 。
(3)为实现制硝酸的绿色化改进,技术人员将分离液态空气的工艺整合在上述流程中。请说明该工艺的产物如何应用于硝酸生产流程:_______ 。
Ⅱ.消除氮氧化物尾气和水中硝酸盐造成的氮污染已成为环境修复研究的热点
(4)氧化吸收法
酸性条件下,加入NaClO溶液可以氧化N2O、NO和NO2等生成Cl-和 。其他条件一定,N2O转化为
。其他条件一定,N2O转化为 的转化率随水体溶液初始pH的变化如图所示。
的转化率随水体溶液初始pH的变化如图所示。_______ 。
②水体溶液初始pH越小(H+浓度越大),N2O转化率越高。其原因是_______ 。
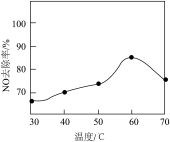
③NaClO/H2O2酸性复合吸收剂可有效去除NO。复合吸收剂组成一定时,温度对NO去除率的影响如图。温度高于60℃后,NO去除率下降的主要原因是_______ 。
①Fe2+催化H2O2分解产生HO·,HO·将NO氧化为 的机理如图所示,Y的化学式为
的机理如图所示,Y的化学式为_______ 。_______ 。
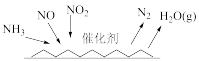
(6)NH3催化还原法
NH3催化还原氮氧化物技术(SCR)是目前应用最广泛的氮氧化物脱除技术,反应原理如下图所示:_______ 。
(7)碱液吸收法
用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。现有VL某NaOH溶液能完全吸收含mmolNO和nmol NO2的大气污染物,则NaOH溶液的物质的量浓度至少为_______ mol/L。若所得溶液c( ):c(
):c( )=1:9,则原混合气体中NO和NO2物质的量之比m:n=
)=1:9,则原混合气体中NO和NO2物质的量之比m:n=_______ 。
Ⅰ.硝酸铵是一种常用的化肥,也是重要的化工原料,常见工业制备方法如下图所示:
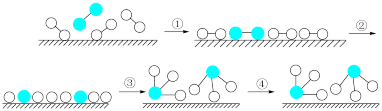
| A.常温下该反应难以进行,是因为常温下生成物的化学键难以形成 |
| B.该过程表明,在化学反应中存在化学键的断裂与形成 |
| C.在催化剂的作用下,反应物的化学键变得容易断裂 |
| D.过程②需吸收能量,过程③则放出能量 |
(2)氧化室中反应的化学方程式:
(3)为实现制硝酸的绿色化改进,技术人员将分离液态空气的工艺整合在上述流程中。请说明该工艺的产物如何应用于硝酸生产流程:
Ⅱ.消除氮氧化物尾气和水中硝酸盐造成的氮污染已成为环境修复研究的热点
(4)氧化吸收法
酸性条件下,加入NaClO溶液可以氧化N2O、NO和NO2等生成Cl-和
 。其他条件一定,N2O转化为
。其他条件一定,N2O转化为 的转化率随水体溶液初始pH的变化如图所示。
的转化率随水体溶液初始pH的变化如图所示。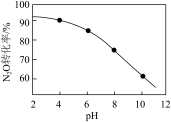
②水体溶液初始pH越小(H+浓度越大),N2O转化率越高。其原因是
③NaClO/H2O2酸性复合吸收剂可有效去除NO。复合吸收剂组成一定时,温度对NO去除率的影响如图。温度高于60℃后,NO去除率下降的主要原因是
①Fe2+催化H2O2分解产生HO·,HO·将NO氧化为
 的机理如图所示,Y的化学式为
的机理如图所示,Y的化学式为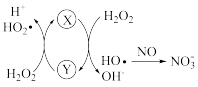
(6)NH3催化还原法
NH3催化还原氮氧化物技术(SCR)是目前应用最广泛的氮氧化物脱除技术,反应原理如下图所示:
(7)碱液吸收法
用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。现有VL某NaOH溶液能完全吸收含mmolNO和nmol NO2的大气污染物,则NaOH溶液的物质的量浓度至少为
 ):c(
):c( )=1:9,则原混合气体中NO和NO2物质的量之比m:n=
)=1:9,则原混合气体中NO和NO2物质的量之比m:n=
您最近一年使用:0次
3 .  、
、 、
、 、
、 等都是重要的氧化剂,其中
等都是重要的氧化剂,其中 、
、 、
、 还是常见的水处理剂,这些物质之间存在如图所示的转化关系。
还是常见的水处理剂,这些物质之间存在如图所示的转化关系。
(1)反应①的离子方程式为_______ 。已知电解质在水溶液中或熔融状态时通电会发生氧化还原反应,其中阳极发生失电子反应,阴极发生得电子反应,则反应②中单质 在
在_______ (填“阴”或“阳”)极产生。
(2)反应⑤在碱性条件下进行, 的还原产物为
的还原产物为 ,写出该反应的离子方程式,并用单线桥法标明电子转移的方向和数目:
,写出该反应的离子方程式,并用单线桥法标明电子转移的方向和数目:_______ 。
(3)反应⑥的化学方程式为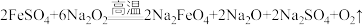 ,该反应的氧化剂为
,该反应的氧化剂为_______ (填化学式,下同),氧化产物为_______ 。
(4)反应⑦是在饱和 溶液中加入
溶液中加入 ,可得
,可得 沉淀,该反应的反应类型是
沉淀,该反应的反应类型是_______ (填四大基本反应类型),该反应能发生的主要原因是_______ 。
 、
、 、
、 、
、 等都是重要的氧化剂,其中
等都是重要的氧化剂,其中 、
、 、
、 还是常见的水处理剂,这些物质之间存在如图所示的转化关系。
还是常见的水处理剂,这些物质之间存在如图所示的转化关系。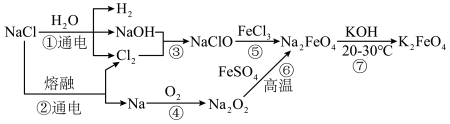
(1)反应①的离子方程式为
 在
在(2)反应⑤在碱性条件下进行,
 的还原产物为
的还原产物为 ,写出该反应的离子方程式,并用单线桥法标明电子转移的方向和数目:
,写出该反应的离子方程式,并用单线桥法标明电子转移的方向和数目:(3)反应⑥的化学方程式为
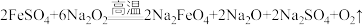 ,该反应的氧化剂为
,该反应的氧化剂为(4)反应⑦是在饱和
 溶液中加入
溶液中加入 ,可得
,可得 沉淀,该反应的反应类型是
沉淀,该反应的反应类型是
您最近一年使用:0次
名校
解题方法
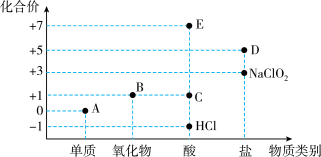
4 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。_____ 。
(2)纯净的 在A中燃烧的现象为
在A中燃烧的现象为_____ ,体现了 的
的_____ (填“氧化性”或“还原性”)。
(3)B为酸性氧化物,则B与氢氧化钠溶液反应的化学方程式为_____ 。
(4)某同学利用①FeO、② 、③NaOH探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与
、③NaOH探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与_____ (填序号)发生反应;从化合价角度看,盐酸中 具有
具有_____ 性,可能与_____ (填序号)发生反应。
(5)已知A与氢氧化钠溶液反应生成NaCl、NaClO和 的混合物,若
的混合物,若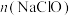 与
与 之比为2∶3,则氧化剂与还原剂的物质的量之比为
之比为2∶3,则氧化剂与还原剂的物质的量之比为_____ 。
(6)将 通入冷的石灰乳【
通入冷的石灰乳【 】中制得漂白粉,该反应的化学方程式为
】中制得漂白粉,该反应的化学方程式为_____ 。
(2)纯净的
 在A中燃烧的现象为
在A中燃烧的现象为 的
的(3)B为酸性氧化物,则B与氢氧化钠溶液反应的化学方程式为
(4)某同学利用①FeO、②
 、③NaOH探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与
、③NaOH探究盐酸的性质,进行了如下预测:从物质类别上看,盐酸属于酸,可能与 具有
具有(5)已知A与氢氧化钠溶液反应生成NaCl、NaClO和
 的混合物,若
的混合物,若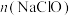 与
与 之比为2∶3,则氧化剂与还原剂的物质的量之比为
之比为2∶3,则氧化剂与还原剂的物质的量之比为(6)将
 通入冷的石灰乳【
通入冷的石灰乳【 】中制得漂白粉,该反应的化学方程式为
】中制得漂白粉,该反应的化学方程式为
您最近一年使用:0次
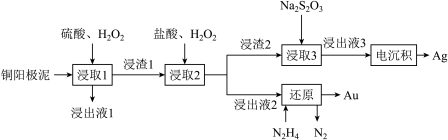
5 . 1000多年前我国就利用“细菌氧化”法将铜矿石中的硫化物转化为硫酸盐,并用形成的天然“胆水”来冶炼铜。现代采用电解精炼铜会产生阳极泥,其中含有铜、金、银等金属单质。某科研小组设计提纯金和银的工艺流程如下: 反应生成
反应生成 。
。
(1)“胆水”的主要溶质是___________ ;浸出液1含有的金属离子主要是___________ 。
(2)下列说法正确的是___________。
(3)浸取1中相关反应的化学方程式是___________ 。
(4)“细菌氧化”时, 发生反应的离子方程式是
发生反应的离子方程式是___________ ,设计实验检验反应产物中的离子:___________ 。
 反应生成
反应生成 。
。(1)“胆水”的主要溶质是
(2)下列说法正确的是___________。
| A.浸渣1的主要成分是金和银,浸渣2的主要成分是银 |
B.电沉积阴极反应式是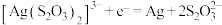 |
C.浸取2中盐酸有利于Au转化为 ,Ag转化为AgCl,实现有效分离 ,Ag转化为AgCl,实现有效分离 |
D.还原步骤中, 与Au的物质的量之比为4∶3 与Au的物质的量之比为4∶3 |
(3)浸取1中相关反应的化学方程式是
(4)“细菌氧化”时,
 发生反应的离子方程式是
发生反应的离子方程式是
您最近一年使用:0次
名校
解题方法
6 . 按照要求回答下列问题:
(1)下列物质:①铁片 ②液态的HCl ③蔗糖 ④酒精 ⑤稀盐酸 ⑥H2SO4 ⑦KOH ⑧熔融状态的KNO3 ⑨O2 ⑩BaSO4固体。
(a)以上物质中能导电的是_______ 。(填序号,下同)
(b)以上物质中属于电解质的是_______ 。
(c)以上物质中属于非电解质的是_______ 。
(2)取少量Fe2O3粉末(红棕色)加入适量盐酸,得到黄色溶液,用此溶液进行以下实验:
(a)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中加入制取的黄色溶液2mL,继续煮沸至液体呈_______ 色,停止加热,用激光笔照射烧杯中的液体,可以观察到液体中_______ 。
(b)氢氧化铁胶体制备的化学方程式为_______ 。
(c)向烧杯中逐滴加入过量的盐酸,会出现一系列变化:现象为_______ ,原因是(用离子方程式表示)_______ 。
(d)氢氧化铁胶体稳定存在的主要原因是_______ 。
(3)某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO﹣与ClO 的个数比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素个数之比为
的个数比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素个数之比为_______ 。
(4)铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿→…→铜”的转化。
铜 铜绿
铜绿 A
A Cu(OH)2
Cu(OH)2 B
B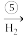 Cu
Cu
(a)从三种不同分类标准回答,“铜绿”属于哪类物质?_______ 。
(b)写出B的化学式_______ 。
(c)上述转化过程中属于置换反应的是_______ (填序号)。
(d)写出②反应的化学方程式:_______ 。
(5)下列方程式中G、Q、X、Y、Z均为含氯元素的物质,它们之间存在如下反应:
(a)Y+NaOH→G+Q+H2O;(b)G→Q+NaCl;(c)Q+H2O→X+H2;(d)Z+NaOH→Q+X+H2O。
试推断五种物质中氯元素的化合价由低到高的顺序为_______ 。
(1)下列物质:①铁片 ②液态的HCl ③蔗糖 ④酒精 ⑤稀盐酸 ⑥H2SO4 ⑦KOH ⑧熔融状态的KNO3 ⑨O2 ⑩BaSO4固体。
(a)以上物质中能导电的是
(b)以上物质中属于电解质的是
(c)以上物质中属于非电解质的是
(2)取少量Fe2O3粉末(红棕色)加入适量盐酸,得到黄色溶液,用此溶液进行以下实验:
(a)在小烧杯中加入20mL蒸馏水,加热至沸腾后,向沸水中加入制取的黄色溶液2mL,继续煮沸至液体呈
(b)氢氧化铁胶体制备的化学方程式为
(c)向烧杯中逐滴加入过量的盐酸,会出现一系列变化:现象为
(d)氢氧化铁胶体稳定存在的主要原因是
(3)某温度下将Cl2通入KOH溶液里,反应后得到KCl、KClO、KClO3的混合溶液,经测定ClO﹣与ClO
 的个数比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素个数之比为
的个数比为11:1,则Cl2与KOH反应时,被还原的氯元素和被氧化的氯元素个数之比为(4)铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿→…→铜”的转化。
铜
 铜绿
铜绿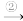 A
A Cu(OH)2
Cu(OH)2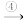 B
B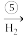 Cu
Cu(a)从三种不同分类标准回答,“铜绿”属于哪类物质?
(b)写出B的化学式
(c)上述转化过程中属于置换反应的是
(d)写出②反应的化学方程式:
(5)下列方程式中G、Q、X、Y、Z均为含氯元素的物质,它们之间存在如下反应:
(a)Y+NaOH→G+Q+H2O;(b)G→Q+NaCl;(c)Q+H2O→X+H2;(d)Z+NaOH→Q+X+H2O。
试推断五种物质中氯元素的化合价由低到高的顺序为
您最近一年使用:0次
2024-09-03更新
|
432次组卷
|
2卷引用:江苏省南京外国语学校2023-2024学年高一上学期第一阶段测试化学试卷
7 . 含氮化合物(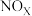 、
、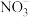 等)是大气主要污染物之一,消除含氮化合物的污染备受关注。
等)是大气主要污染物之一,消除含氮化合物的污染备受关注。
(1)“纳米零价铁— ”体系可将烟气(氮氧化物和
”体系可将烟气(氮氧化物和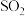 )中难溶的
)中难溶的 氧化为可溶的
氧化为可溶的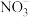 。在一定温度下,将
。在一定温度下,将 溶液和
溶液和 溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的
溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的 氧化。
氧化。
①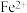 催化
催化 分解产生
分解产生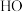 、
、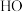 将
将 氧化为
氧化为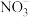 的反应机理如图所示,Y的化学式为
的反应机理如图所示,Y的化学式为___________ 。 与
与 反应生成
反应生成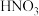 的化学方程式为
的化学方程式为___________ 。
③纳米零价铁的作用是___________ 。
④烟气中的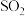 也会与
也会与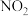 反应。
反应。 一定条件下,将
一定条件下,将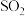 与
与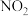 以体积比2:1置于密闭容器中发生上述反应。
以体积比2:1置于密闭容器中发生上述反应。
下列能说明反应达到平衡状态的是___________ (填正确答案标号)。
A.体系压强保持不变 B.混合气体的颜色保持不变
C.每消耗
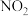 同时生成
同时生成
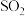 D.
D.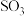 和
和 的体积比保持不变
的体积比保持不变
(2) 也可以利用电化学手段将其转化为
也可以利用电化学手段将其转化为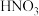 脱除,装置如图所示,电极为多孔惰性材料。则负极的电极反应式是
脱除,装置如图所示,电极为多孔惰性材料。则负极的电极反应式是___________ 。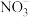 。
。
①将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中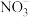 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除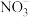 效率更高,其主要原因是
效率更高,其主要原因是___________ 。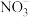 ,测得溶液中含氮物质(
,测得溶液中含氮物质(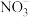 、
、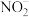 ,
, )浓度随时间变化如图所示。与初始溶液中
)浓度随时间变化如图所示。与初始溶液中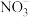 浓度相比,反应后溶液中所有含氮物质(
浓度相比,反应后溶液中所有含氮物质(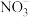 、
、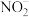 ,
, )总浓度减小,原因是
)总浓度减小,原因是___________ 。
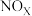 、
、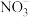 等)是大气主要污染物之一,消除含氮化合物的污染备受关注。
等)是大气主要污染物之一,消除含氮化合物的污染备受关注。(1)“纳米零价铁—
 ”体系可将烟气(氮氧化物和
”体系可将烟气(氮氧化物和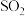 )中难溶的
)中难溶的 氧化为可溶的
氧化为可溶的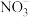 。在一定温度下,将
。在一定温度下,将 溶液和
溶液和 溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的
溶液雾化后与烟气按一定比例混合,以一定流速通过装有纳米零价铁的反应装置,可将烟气中的 氧化。
氧化。①
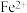 催化
催化 分解产生
分解产生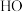 、
、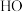 将
将 氧化为
氧化为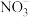 的反应机理如图所示,Y的化学式为
的反应机理如图所示,Y的化学式为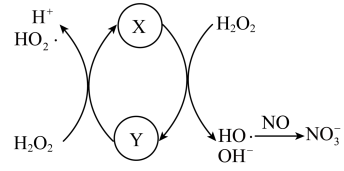
 与
与 反应生成
反应生成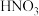 的化学方程式为
的化学方程式为③纳米零价铁的作用是
④烟气中的
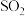 也会与
也会与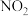 反应。
反应。 一定条件下,将
一定条件下,将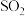 与
与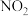 以体积比2:1置于密闭容器中发生上述反应。
以体积比2:1置于密闭容器中发生上述反应。下列能说明反应达到平衡状态的是
A.体系压强保持不变 B.混合气体的颜色保持不变
C.每消耗

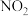 同时生成
同时生成
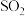 D.
D.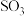 和
和 的体积比保持不变
的体积比保持不变(2)
 也可以利用电化学手段将其转化为
也可以利用电化学手段将其转化为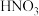 脱除,装置如图所示,电极为多孔惰性材料。则负极的电极反应式是
脱除,装置如图所示,电极为多孔惰性材料。则负极的电极反应式是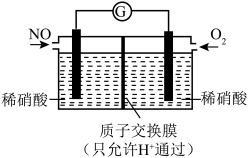
 。
。①将一定量纳米零价铁和少量铜粉附着在生物炭上,可用于去除水体中
 ,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除
,其部分反应原理如图所示。与不添加铜粉相比,添加少量铜粉时去除 效率更高,其主要原因是
效率更高,其主要原因是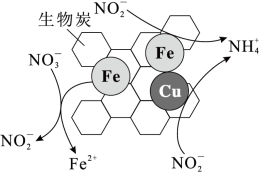
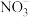 ,测得溶液中含氮物质(
,测得溶液中含氮物质(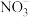 、
、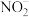 ,
, )浓度随时间变化如图所示。与初始溶液中
)浓度随时间变化如图所示。与初始溶液中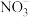 浓度相比,反应后溶液中所有含氮物质(
浓度相比,反应后溶液中所有含氮物质(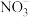 、
、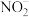 ,
, )总浓度减小,原因是
)总浓度减小,原因是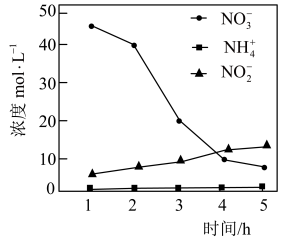
您最近一年使用:0次
2024-09-02更新
|
51次组卷
|
2卷引用:江苏省徐州市树人中学2023-2024学年高一下学期5月学情调研化学试题
名校
解题方法
8 . 将含+4价硫的化合物X通入(加入)到84消毒液中,可能发生反应NaClO+H2O+X→Na2SO4+Y+HCl,下列有关说法错误的是
| A.X发生氧化反应 |
| B.Y与HCl的化学计量数之比为1:1 |
| C.X为少量Na2SO3 |
| D.含Y的溶液应保存在棕色试剂瓶中 |
您最近一年使用:0次
2024-09-02更新
|
165次组卷
|
2卷引用:安徽省多校联考2025届高三上学期8月第一次联考化学试题
名校
解题方法
9 . 以硫铁矿烧渣(主要成分为 、
、 、少量
、少量 、
、 、
、 )为原料,生产安全高效的水处理剂高铁酸钾(
)为原料,生产安全高效的水处理剂高铁酸钾( )的工艺流程如下:
)的工艺流程如下: 具有下列性质:①可溶于水、微溶于浓
具有下列性质:①可溶于水、微溶于浓 溶液;②在0~5℃强碱性溶液中比较稳定。
溶液;②在0~5℃强碱性溶液中比较稳定。
(1)氧化。氧化时发生反应的离子方程式为___________ 。
(2)制备 。制备
。制备 溶液的离子方程式为
溶液的离子方程式为___________ 。
(3)过滤。滤渣2的主要成分是___________ (填化学式)。
(4) 可将水中的
可将水中的 氧化为硫酸盐,同时
氧化为硫酸盐,同时 被还原为
被还原为 ,则反应时
,则反应时 与
与 的物质的量之比为
的物质的量之比为___________ 。
(5)氢气是一种清洁能源,氢气的制取和储存是氢能源利用领域的研究热点。 热分解制氢并回收硫的原理:
热分解制氢并回收硫的原理: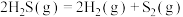
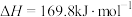 。分解时常向反应器中通入一定比例的空气,使部分
。分解时常向反应器中通入一定比例的空气,使部分 燃烧,其目的是
燃烧,其目的是___________ ;燃烧生成的 与
与 进一步反应,硫元素转化为
进一步反应,硫元素转化为 写出反应的化学方程式:
写出反应的化学方程式:___________ 。
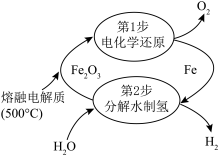
(6)一种电热化学循环制氢的方法如图所示。熔融电解质成分为 、
、 、
、 与
与 。
。 能与熔融电解质中各成分发生反应,如
能与熔融电解质中各成分发生反应,如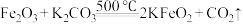 ,
, 与
与 反应的化学方程式为
反应的化学方程式为___________ 。
②“电化学还原”步骤中,阴极的电极反应式为___________ 。
 、
、 、少量
、少量 、
、 、
、 )为原料,生产安全高效的水处理剂高铁酸钾(
)为原料,生产安全高效的水处理剂高铁酸钾( )的工艺流程如下:
)的工艺流程如下: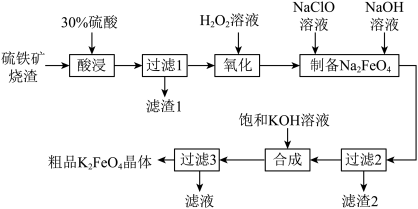
 具有下列性质:①可溶于水、微溶于浓
具有下列性质:①可溶于水、微溶于浓 溶液;②在0~5℃强碱性溶液中比较稳定。
溶液;②在0~5℃强碱性溶液中比较稳定。(1)氧化。氧化时发生反应的离子方程式为
(2)制备
 。制备
。制备 溶液的离子方程式为
溶液的离子方程式为(3)过滤。滤渣2的主要成分是
(4)
 可将水中的
可将水中的 氧化为硫酸盐,同时
氧化为硫酸盐,同时 被还原为
被还原为 ,则反应时
,则反应时 与
与 的物质的量之比为
的物质的量之比为(5)氢气是一种清洁能源,氢气的制取和储存是氢能源利用领域的研究热点。
 热分解制氢并回收硫的原理:
热分解制氢并回收硫的原理: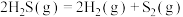
 。分解时常向反应器中通入一定比例的空气,使部分
。分解时常向反应器中通入一定比例的空气,使部分 燃烧,其目的是
燃烧,其目的是 与
与 进一步反应,硫元素转化为
进一步反应,硫元素转化为 写出反应的化学方程式:
写出反应的化学方程式:(6)一种电热化学循环制氢的方法如图所示。熔融电解质成分为
 、
、 、
、 与
与 。
。
 能与熔融电解质中各成分发生反应,如
能与熔融电解质中各成分发生反应,如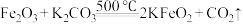 ,
, 与
与 反应的化学方程式为
反应的化学方程式为②“电化学还原”步骤中,阴极的电极反应式为
您最近一年使用:0次
名校
解题方法
10 . 回答下列问题。
(1)已知 具有氧化性,与氨气加热反应的产物中含有两种单质。写出在加热条件下
具有氧化性,与氨气加热反应的产物中含有两种单质。写出在加热条件下 和
和 反应的化学方程式:
反应的化学方程式:_______ 。
(2)在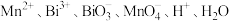 组成的一个氧化还原反应体系中,发生
组成的一个氧化还原反应体系中,发生 的反应过程。将以上物质组成一个正确的离子方程式,并用单线桥标出其电子转移的方向和数目:
的反应过程。将以上物质组成一个正确的离子方程式,并用单线桥标出其电子转移的方向和数目:_______ 。
(3) 与
与 和
和 的混合溶液作用,是一种制备理想的绿色水处理剂
的混合溶液作用,是一种制备理想的绿色水处理剂 的方法,写出该反应的化学方程式:
的方法,写出该反应的化学方程式:_______ 。
(4) 可用于实验室制
可用于实验室制 ,若不加催化剂,
,若不加催化剂,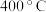 时
时 分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为
分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ 。
(5)某地污水中有机污染物的主要成分是三氯乙烯 ,向该污水中加入
,向该污水中加入 (还原产物为
(还原产物为 )溶液可将其中的三氯乙烯除去,氧化产物只有
)溶液可将其中的三氯乙烯除去,氧化产物只有 ,写出该反应的化学方程式:
,写出该反应的化学方程式:_______ 。
(6)我国稀土资源丰富,氟化镨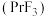 常用于电弧碳棒添加剂。工业上采用方镨矿(主要成分
常用于电弧碳棒添加剂。工业上采用方镨矿(主要成分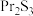 ,难溶于水)制备氟化镨的工艺流程如图所示:
,难溶于水)制备氟化镨的工艺流程如图所示: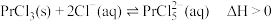 。
。
①步骤I为“溶浸除硫”,反应后镨元素以 形式存在,则反应的离子方程式为
形式存在,则反应的离子方程式为_______ 。
②写出步骤Ⅲ“转化”过程的化学方程式:_______ 。
(1)已知
 具有氧化性,与氨气加热反应的产物中含有两种单质。写出在加热条件下
具有氧化性,与氨气加热反应的产物中含有两种单质。写出在加热条件下 和
和 反应的化学方程式:
反应的化学方程式:(2)在
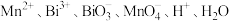 组成的一个氧化还原反应体系中,发生
组成的一个氧化还原反应体系中,发生 的反应过程。将以上物质组成一个正确的离子方程式,并用单线桥标出其电子转移的方向和数目:
的反应过程。将以上物质组成一个正确的离子方程式,并用单线桥标出其电子转移的方向和数目:(3)
 与
与 和
和 的混合溶液作用,是一种制备理想的绿色水处理剂
的混合溶液作用,是一种制备理想的绿色水处理剂 的方法,写出该反应的化学方程式:
的方法,写出该反应的化学方程式:(4)
 可用于实验室制
可用于实验室制 ,若不加催化剂,
,若不加催化剂,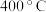 时
时 分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为
分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(5)某地污水中有机污染物的主要成分是三氯乙烯
 ,向该污水中加入
,向该污水中加入 (还原产物为
(还原产物为 )溶液可将其中的三氯乙烯除去,氧化产物只有
)溶液可将其中的三氯乙烯除去,氧化产物只有 ,写出该反应的化学方程式:
,写出该反应的化学方程式:(6)我国稀土资源丰富,氟化镨
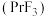 常用于电弧碳棒添加剂。工业上采用方镨矿(主要成分
常用于电弧碳棒添加剂。工业上采用方镨矿(主要成分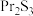 ,难溶于水)制备氟化镨的工艺流程如图所示:
,难溶于水)制备氟化镨的工艺流程如图所示: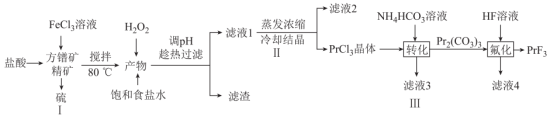
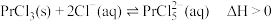 。
。①步骤I为“溶浸除硫”,反应后镨元素以
 形式存在,则反应的离子方程式为
形式存在,则反应的离子方程式为②写出步骤Ⅲ“转化”过程的化学方程式:
您最近一年使用:0次
2024-08-31更新
|
132次组卷
|
2卷引用:2025届广东省部分学校高三上学期一调考试化学试题



