解题方法
1 .  的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除
的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除 并获得硫黄的装置如下(夹持装置略)。已知:
并获得硫黄的装置如下(夹持装置略)。已知: (黑色),
(黑色),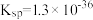
(1)装置A中发生的化学反应方程式是_______ 。
(2)加入药品前,检验装置气密性,方法是_______ 。
(3)装置B的作用是_______ 。
(4)实验Ⅲ中生成黑色沉淀的离子方程式是_______ 。
(5)对于实验Ⅱ的沉淀比实验Ⅰ少的现象,某同学通过分析并得出结论如下:
① 气体持续通入
气体持续通入 溶液中,发生
溶液中,发生 及电离
及电离_______ 。
②完善下列离子方程式:_______ 。
_______ _______
_______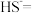 _______
_______ _______
_______ _______。
_______。
结论:实验Ⅱ的pH比实验Ⅰ的小, 增大,不利于
增大,不利于 的溶解和电离,产生沉淀较实验Ⅰ少。
的溶解和电离,产生沉淀较实验Ⅰ少。
(6)对比实验Ⅳ和Ⅰ,实验Ⅳ沉淀比实验Ⅰ多的原因是_______ 。
(7)实验Ⅰ充分反应后,测 浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为
浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为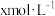 的
的 标准溶液滴定到终点。滴定时发生的离子反应:
标准溶液滴定到终点。滴定时发生的离子反应: ,计算滤液中
,计算滤液中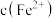 还需要的实验数据:
还需要的实验数据:___ 。
 的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除
的转化是资源利用和环境保护的重要研究课题。某实验小组在实验室模拟脱除 并获得硫黄的装置如下(夹持装置略)。已知:
并获得硫黄的装置如下(夹持装置略)。已知: (黑色),
(黑色),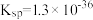
| 序号 | 溶液N | C中实验现象 |
| Ⅰ | 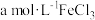 溶液( 溶液( ) ) | 溶液颜色变浅,有乳白色沉淀生成 |
| Ⅱ | 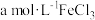 溶液(含少量稀 溶液(含少量稀 , ,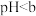 ) ) | 溶液颜色变浅,有乳白色沉淀生成,沉淀比实验Ⅰ少 |
| Ⅲ | 一定浓度的 溶液 溶液 | 溶液颜色变浅,有黑色沉淀生成 |
| Ⅳ | 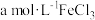 (含有一定浓度的 (含有一定浓度的 溶液, 溶液,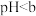 ) ) | 溶液颜色变浅,先有黑色沉淀生成,一段时间后转化为乳白色,沉淀比实验Ⅰ多 |
(1)装置A中发生的化学反应方程式是
(2)加入药品前,检验装置气密性,方法是
(3)装置B的作用是
(4)实验Ⅲ中生成黑色沉淀的离子方程式是
(5)对于实验Ⅱ的沉淀比实验Ⅰ少的现象,某同学通过分析并得出结论如下:
①
 气体持续通入
气体持续通入 溶液中,发生
溶液中,发生 及电离
及电离②完善下列离子方程式:
_______
 _______
_______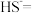 _______
_______ _______
_______ _______。
_______。结论:实验Ⅱ的pH比实验Ⅰ的小,
 增大,不利于
增大,不利于 的溶解和电离,产生沉淀较实验Ⅰ少。
的溶解和电离,产生沉淀较实验Ⅰ少。(6)对比实验Ⅳ和Ⅰ,实验Ⅳ沉淀比实验Ⅰ多的原因是
(7)实验Ⅰ充分反应后,测
 浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为
浓度:滤出沉淀,取滤液,除去杂质,加入适量稀硫酸,用浓度为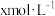 的
的 标准溶液滴定到终点。滴定时发生的离子反应:
标准溶液滴定到终点。滴定时发生的离子反应: ,计算滤液中
,计算滤液中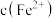 还需要的实验数据:
还需要的实验数据:
您最近一年使用:0次
2 . Ⅰ.汽车让人们的生活越来越便捷。请回答以下问题:
(1)汽车尾气主要含有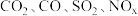 等物质,是造成城市空气污染的主要因素之一;
等物质,是造成城市空气污染的主要因素之一;  和
和 反应生成
反应生成 的能量变化如下图所示,则该反应的热化学方程式为
的能量变化如下图所示,则该反应的热化学方程式为_______________ 。 可作氧化剂,用于氧化火箭推进器中的强还原剂肼
可作氧化剂,用于氧化火箭推进器中的强还原剂肼 ,释放大量的能量,其热化学方程式为:
,释放大量的能量,其热化学方程式为:
①若进行上述反应,放出热量为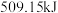 ,则转移电子数目为
,则转移电子数目为_______________  。
。
②已知: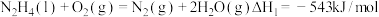

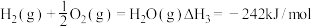
若用氟气代替二氧化氮作氧化剂,则反应释放能量更多,请写出液态肼和氟气反应的热化学方程式:_______________ 。
(3)汽车受到猛烈碰撞时,安全气囊内的 固体迅速分解,产生氮气和金属钠,该过程中的能量变化如图所示,下列说法错误的是___________。
固体迅速分解,产生氮气和金属钠,该过程中的能量变化如图所示,下列说法错误的是___________。
Ⅱ.污染性气体的处理:
(4)以 溶液作为吸收剂,控制溶液的
溶液作为吸收剂,控制溶液的 ,将二氧化硫和一氧化氮转化为
,将二氧化硫和一氧化氮转化为 和
和 去除。
去除。
①在酸性 溶液中,
溶液中, 氧化
氧化 的离子方程式为
的离子方程式为_______________ 。
② 的去除率高于
的去除率高于 的可能原因是
的可能原因是_______________ 。(任写一条)
(5)将 的混合气体共
的混合气体共 (已换算为标准状况,下同)通入水中,气体体积减小
(已换算为标准状况,下同)通入水中,气体体积减小 ,若将该混合气体与一定量
,若将该混合气体与一定量 混合通入水中,所有气体能被完全吸收得到硝酸溶液,下列说法错误的是
混合通入水中,所有气体能被完全吸收得到硝酸溶液,下列说法错误的是_______________ (填序号)。
①混合气体中 的体积分数为
的体积分数为
②所得硝酸溶液物质的量浓度为
③用足量 溶液可将该混合气体完全吸收
溶液可将该混合气体完全吸收
④消耗的 在标准状况下的体积为
在标准状况下的体积为
(1)汽车尾气主要含有
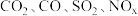 等物质,是造成城市空气污染的主要因素之一;
等物质,是造成城市空气污染的主要因素之一;  和
和 反应生成
反应生成 的能量变化如下图所示,则该反应的热化学方程式为
的能量变化如下图所示,则该反应的热化学方程式为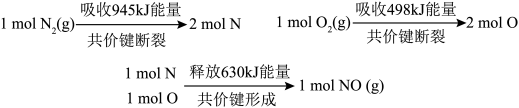
 可作氧化剂,用于氧化火箭推进器中的强还原剂肼
可作氧化剂,用于氧化火箭推进器中的强还原剂肼 ,释放大量的能量,其热化学方程式为:
,释放大量的能量,其热化学方程式为:
①若进行上述反应,放出热量为
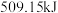 ,则转移电子数目为
,则转移电子数目为 。
。②已知:
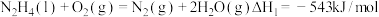

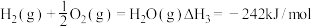
若用氟气代替二氧化氮作氧化剂,则反应释放能量更多,请写出液态肼和氟气反应的热化学方程式:
(3)汽车受到猛烈碰撞时,安全气囊内的
 固体迅速分解,产生氮气和金属钠,该过程中的能量变化如图所示,下列说法错误的是___________。
固体迅速分解,产生氮气和金属钠,该过程中的能量变化如图所示,下列说法错误的是___________。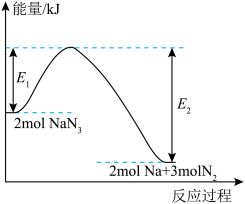
A. 属于离子化合物 属于离子化合物 |
B. 的分解反应属于吸热反应 的分解反应属于吸热反应 |
C. 表示 表示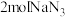 固体具有的能量 固体具有的能量 |
D. 作为安全气囊的气体发生剂,具有产气快、产气量大等优点 作为安全气囊的气体发生剂,具有产气快、产气量大等优点 |
Ⅱ.污染性气体的处理:
(4)以
 溶液作为吸收剂,控制溶液的
溶液作为吸收剂,控制溶液的 ,将二氧化硫和一氧化氮转化为
,将二氧化硫和一氧化氮转化为 和
和 去除。
去除。①在酸性
 溶液中,
溶液中, 氧化
氧化 的离子方程式为
的离子方程式为②
 的去除率高于
的去除率高于 的可能原因是
的可能原因是(5)将
 的混合气体共
的混合气体共 (已换算为标准状况,下同)通入水中,气体体积减小
(已换算为标准状况,下同)通入水中,气体体积减小 ,若将该混合气体与一定量
,若将该混合气体与一定量 混合通入水中,所有气体能被完全吸收得到硝酸溶液,下列说法错误的是
混合通入水中,所有气体能被完全吸收得到硝酸溶液,下列说法错误的是①混合气体中
 的体积分数为
的体积分数为
②所得硝酸溶液物质的量浓度为

③用足量
 溶液可将该混合气体完全吸收
溶液可将该混合气体完全吸收④消耗的
 在标准状况下的体积为
在标准状况下的体积为
您最近一年使用:0次
解题方法
3 . 我国在新能源汽车领域世界领先,新能源汽车动力电池的制备和回收利用技术至关重要。回答下列问题:
I.磷酸铁锂电池放电时电池反应为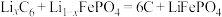 。
。
(1)磷酸铁锂电池正极的电极反应式为_____ 。
(2)将 、磷酸铁与足量炭黑混合高温灼烧可制备
、磷酸铁与足量炭黑混合高温灼烧可制备 ,同时生成一种有毒的气体。写出该反应的化学方程式:
,同时生成一种有毒的气体。写出该反应的化学方程式:_____ 。
Ⅱ.回收含的废旧电池制备 的流程如图所示(已知
的流程如图所示(已知 加热时可溶于盐酸):
加热时可溶于盐酸):_____ ,若要提高 的浸出速率和浸出率,可采取的措施是
的浸出速率和浸出率,可采取的措施是_____ (任写两点)。
(4)写出 与
与 在盐酸中发生反应的离子方程式:
在盐酸中发生反应的离子方程式:_____ 。
(5)欲证明 已沉淀完全,应采用的实验操作是
已沉淀完全,应采用的实验操作是_____ 。
(6)“操作a”所需玻璃仪器有_____ 。
I.磷酸铁锂电池放电时电池反应为
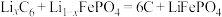 。
。(1)磷酸铁锂电池正极的电极反应式为
(2)将
 、磷酸铁与足量炭黑混合高温灼烧可制备
、磷酸铁与足量炭黑混合高温灼烧可制备 ,同时生成一种有毒的气体。写出该反应的化学方程式:
,同时生成一种有毒的气体。写出该反应的化学方程式:Ⅱ.回收含的废旧电池制备
 的流程如图所示(已知
的流程如图所示(已知 加热时可溶于盐酸):
加热时可溶于盐酸):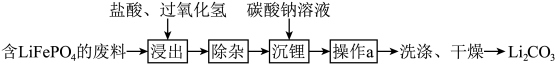
 的浸出速率和浸出率,可采取的措施是
的浸出速率和浸出率,可采取的措施是(4)写出
 与
与 在盐酸中发生反应的离子方程式:
在盐酸中发生反应的离子方程式:(5)欲证明
 已沉淀完全,应采用的实验操作是
已沉淀完全,应采用的实验操作是(6)“操作a”所需玻璃仪器有
您最近一年使用:0次
名校
解题方法
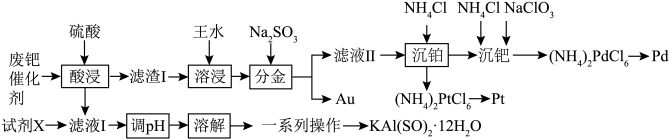
4 . 用(B)的性质与铂(Pt)相似,一种从废钯催化剂(主要成分约Pd、Pt、Au和As4O3,还含少量Fe2O3、Al2O3等)中回收海绵钯、海绵铂和制备KAl(SO4)2·12H2O的工艺流程如图所示:
②(NH4)2PdCl6和(NH4)2PtCl6难溶于水,但(NH4)2PdCl4溶于水易溶于盐酸。
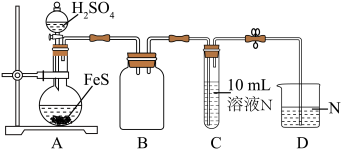
③当溶液中某离子浓度c(Mn+)≤1×10-5mol⋅L-1时,可认为该离子沉淀完全;常温下,几种沉淀的Ksp如下表所示:
回答下列问题:
(1)“酸浸”时,需要将废钯催化剂粉碎后再加入硫酸,同时在溶液底部鼓入N2,则鼓入N2的目的是___________ 。
(2)“溶浸”操作完成后需要加入一种酸加热赶硝后再进行过滤等操作,这种酸是___________ ,“分金”时,被还原的元素有___________ ,得到Au单质的离子方程式为___________ 。
(3)“沉钯”操作中,加入NaClO3不能过量太多的原因是___________ ,问(NH4)2PtCl6和(NH4)2PdCl6中分别通入N2H4,在焙烧条件下可制得海绵铂和海绵钯,N2H4被氧化成N2,再将海绵铂和海绵钯混合合成Pt4Pd3的合金,若最终得到1mol Pt4Pd3的合金,理论上消耗的N2H4最小质量为___________ g。
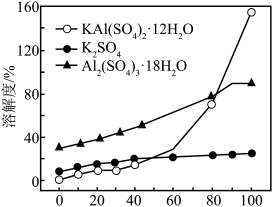
(4)“滤液I”中加入的“试剂X”是___________ ,“溶解”时,向所得沉淀中分批加入硫酸,同时不断搅拌,当沉淀完全溶解后,结合溶解度图像,则获得KAl(SO4)2·12H2O的最佳实验操作为___________ 。
②(NH4)2PdCl6和(NH4)2PtCl6难溶于水,但(NH4)2PdCl4溶于水易溶于盐酸。
③当溶液中某离子浓度c(Mn+)≤1×10-5mol⋅L-1时,可认为该离子沉淀完全;常温下,几种沉淀的Ksp如下表所示:
| Fe(OH)3 | Al(OH)3 | Cu(OH)2 | Fe(OH)2 | |
| Ksp | 1×10-38 | 1×10-33 | 2×10-20 | 5×10-17 |
(1)“酸浸”时,需要将废钯催化剂粉碎后再加入硫酸,同时在溶液底部鼓入N2,则鼓入N2的目的是
(2)“溶浸”操作完成后需要加入一种酸加热赶硝后再进行过滤等操作,这种酸是
(3)“沉钯”操作中,加入NaClO3不能过量太多的原因是
(4)“滤液I”中加入的“试剂X”是
您最近一年使用:0次
5 . 重晶石( )与焦炭在一定条件下发生反应:
)与焦炭在一定条件下发生反应: 。下列说法不正确的是
。下列说法不正确的是
 )与焦炭在一定条件下发生反应:
)与焦炭在一定条件下发生反应: 。下列说法不正确的是
。下列说法不正确的是A. 发生还原反应 发生还原反应 |
| B.C把电子转移给了CO |
C.还原剂为C,氧化剂为 |
| D.C的还原性比BaS的还原性强 |
您最近一年使用:0次
解题方法
6 . 多功能净水剂高铁酸钠( )主要用于饮用水处理,
)主要用于饮用水处理, 进入水中能杀灭水中细菌,同时会生成
进入水中能杀灭水中细菌,同时会生成 胶体,
胶体, 胶体通过吸附水中悬浮物达到净水的功能。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可表示为:
胶体通过吸附水中悬浮物达到净水的功能。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可表示为:
 。回答下列问题:
。回答下列问题:
(1) 中Fe元素的化合价
中Fe元素的化合价___________
(2)由上述化学原理可知 的氧化性比NaClO的氧化性
的氧化性比NaClO的氧化性___________ (填“强”或“弱”);
(3)将上述化学反应方程式改写为离子反应方程式___________ ;
(4) 沉淀没有净水作用,而
沉淀没有净水作用,而 胶体则可以净水,形成这样差异的本质原因是
胶体则可以净水,形成这样差异的本质原因是___________ ;
(5) 具有杀菌消毒是利用其
具有杀菌消毒是利用其___________ 的性质;
(6)请用单线桥法标出上述反应的电子转移方向和数目___________ ;
(7)制备8.3g 需要消耗
需要消耗___________ gNaOH。
 )主要用于饮用水处理,
)主要用于饮用水处理, 进入水中能杀灭水中细菌,同时会生成
进入水中能杀灭水中细菌,同时会生成 胶体,
胶体, 胶体通过吸附水中悬浮物达到净水的功能。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可表示为:
胶体通过吸附水中悬浮物达到净水的功能。工业上制备高铁酸钠有多种方法,其中一种方法的化学原理可表示为:
 。回答下列问题:
。回答下列问题:(1)
 中Fe元素的化合价
中Fe元素的化合价(2)由上述化学原理可知
 的氧化性比NaClO的氧化性
的氧化性比NaClO的氧化性(3)将上述化学反应方程式改写为离子反应方程式
(4)
 沉淀没有净水作用,而
沉淀没有净水作用,而 胶体则可以净水,形成这样差异的本质原因是
胶体则可以净水,形成这样差异的本质原因是(5)
 具有杀菌消毒是利用其
具有杀菌消毒是利用其(6)请用单线桥法标出上述反应的电子转移方向和数目
(7)制备8.3g
 需要消耗
需要消耗
您最近一年使用:0次
名校
解题方法
7 . 羟基氧化铁(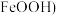 在工业中可用于脱硫工序,脱除效果较好,且成本较低廉。一种采用硫铁矿烧渣(主要成分为
在工业中可用于脱硫工序,脱除效果较好,且成本较低廉。一种采用硫铁矿烧渣(主要成分为 、
、 、
、 、
、 ,不考虑其他杂质)制备
,不考虑其他杂质)制备 的工艺流程如图所示:
的工艺流程如图所示: 能将
能将 中的硫元素氧化为+6价。
中的硫元素氧化为+6价。
回答下列问题:
(1)浸取液中含 ,基态
,基态 的价电子排布图为
的价电子排布图为___________ 。
(2)“滤渣I”的主要成分是___________ (填化学式)。
(3)“还原”过程中涉及的离子方程式为___________ 。
(4)制备 :向一定浓度的
:向一定浓度的 溶液中滴加
溶液中滴加 溶液至
溶液至 为6.0时,产生
为6.0时,产生 沉淀,停止滴加
沉淀,停止滴加 溶液,开始通入氧气,得到
溶液,开始通入氧气,得到 。写出制备
。写出制备 的化学方程式:
的化学方程式:___________ 。
(5)制得的 中通常混有
中通常混有 ,可用分光光度法测定
,可用分光光度法测定 的含量。已知
的含量。已知 的吸光度
的吸光度 (对特定波长光的吸收程度)与
(对特定波长光的吸收程度)与 标准溶液浓度的关系如图所示:
标准溶液浓度的关系如图所示: 样品,用稀硫酸溶解并加蒸馏水定容至
样品,用稀硫酸溶解并加蒸馏水定容至 ,移取该溶液
,移取该溶液 ,加入足量
,加入足量 溶液,用蒸馏水定容至
溶液,用蒸馏水定容至 ,测得稀释后的溶液吸光度
,测得稀释后的溶液吸光度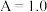 。则样品中
。则样品中 的质量分数为
的质量分数为___________ %(保留一位小数)。
(6) 晶体的晶胞如图所示。晶胞中
晶体的晶胞如图所示。晶胞中 位于
位于 所形成的正八面体的体心,晶胞边长为anm,则该正八面体的边长为
所形成的正八面体的体心,晶胞边长为anm,则该正八面体的边长为___________ nm。已知该晶体的密度为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 的摩尔质量M=
的摩尔质量M=___________  (用含a、
(用含a、 、
、 的代数式表示)。
的代数式表示)。
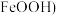 在工业中可用于脱硫工序,脱除效果较好,且成本较低廉。一种采用硫铁矿烧渣(主要成分为
在工业中可用于脱硫工序,脱除效果较好,且成本较低廉。一种采用硫铁矿烧渣(主要成分为 、
、 、
、 、
、 ,不考虑其他杂质)制备
,不考虑其他杂质)制备 的工艺流程如图所示:
的工艺流程如图所示: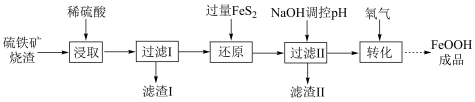
 能将
能将 中的硫元素氧化为+6价。
中的硫元素氧化为+6价。回答下列问题:
(1)浸取液中含
 ,基态
,基态 的价电子排布图为
的价电子排布图为(2)“滤渣I”的主要成分是
(3)“还原”过程中涉及的离子方程式为
(4)制备
 :向一定浓度的
:向一定浓度的 溶液中滴加
溶液中滴加 溶液至
溶液至 为6.0时,产生
为6.0时,产生 沉淀,停止滴加
沉淀,停止滴加 溶液,开始通入氧气,得到
溶液,开始通入氧气,得到 。写出制备
。写出制备 的化学方程式:
的化学方程式:(5)制得的
 中通常混有
中通常混有 ,可用分光光度法测定
,可用分光光度法测定 的含量。已知
的含量。已知 的吸光度
的吸光度 (对特定波长光的吸收程度)与
(对特定波长光的吸收程度)与 标准溶液浓度的关系如图所示:
标准溶液浓度的关系如图所示: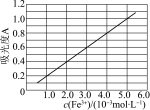
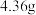 样品,用稀硫酸溶解并加蒸馏水定容至
样品,用稀硫酸溶解并加蒸馏水定容至 ,移取该溶液
,移取该溶液 ,加入足量
,加入足量 溶液,用蒸馏水定容至
溶液,用蒸馏水定容至 ,测得稀释后的溶液吸光度
,测得稀释后的溶液吸光度 。则样品中
。则样品中 的质量分数为
的质量分数为(6)
 晶体的晶胞如图所示。晶胞中
晶体的晶胞如图所示。晶胞中 位于
位于 所形成的正八面体的体心,晶胞边长为anm,则该正八面体的边长为
所形成的正八面体的体心,晶胞边长为anm,则该正八面体的边长为 ,阿伏加德罗常数的值为
,阿伏加德罗常数的值为 ,则
,则 的摩尔质量M=
的摩尔质量M= (用含a、
(用含a、 、
、 的代数式表示)。
的代数式表示)。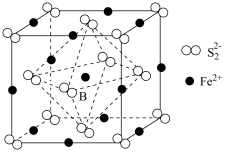
您最近一年使用:0次
2024-06-10更新
|
41次组卷
|
2卷引用:云南省昆明市云南师范大学附属中学2023-2024学年高三下学期适应性考试(十)理综试题-高中化学
8 . Au溶于食盐和硝酸混合液发生反应: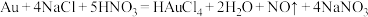 ,(已知:
,(已知: ),下列说法
),下列说法不正确 的是
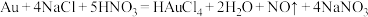 ,(已知:
,(已知: ),下列说法
),下列说法| A.Au是还原剂,HNO3是氧化剂 |
| B. HAuCl4是氧化产物,NO是还原产物 |
| C.Au消耗0.5mol得到1.5mol电子 |
| D.Au也能溶于王水(浓硝酸和浓盐酸体积比1∶3) |
您最近一年使用:0次
解题方法
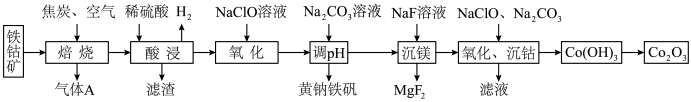
9 . 以主要成分为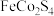 的铁钴矿(杂质为
的铁钴矿(杂质为 、
、 )为原料制取
)为原料制取 和黄钠铁矾
和黄钠铁矾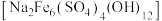 的工艺流程如下图所示(已知还原性:
的工艺流程如下图所示(已知还原性: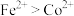 ):
): 、
、 元素完全转化为单质。
元素完全转化为单质。
回答下列问题:
(1)黄钠铁矾中铁元素的化合价为_______ 价,检验气体 中是否含有
中是否含有 的方法可以为
的方法可以为_______ 。
(2)第一次“氧化”中消耗的氧化剂与还原剂物质的量之比为_______ ,“调 ”时反应的离子方程式为
”时反应的离子方程式为_______ 。
(3)“氧化、沉钴”过程中加入的 和
和 物质的量之比为
物质的量之比为 ,相应总反应的离子方程式为
,相应总反应的离子方程式为_______ , 转化为
转化为 的基本方法是
的基本方法是_______ 。
(4)基态 的价层电子的轨道表示式为
的价层电子的轨道表示式为_______ ,铁可形成多种氧化物,其中一种铁的氧化物的晶胞结构及该晶胞中的Ⅰ、Ⅱ两种结构如下图所示: 的是
的是_______ (填“ ”或“
”或“ ”),若晶体密度为
”),若晶体密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
_______  (用含
(用含 、
、 的式子表示)。
的式子表示)。
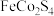 的铁钴矿(杂质为
的铁钴矿(杂质为 、
、 )为原料制取
)为原料制取 和黄钠铁矾
和黄钠铁矾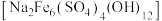 的工艺流程如下图所示(已知还原性:
的工艺流程如下图所示(已知还原性: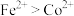 ):
):
 、
、 元素完全转化为单质。
元素完全转化为单质。回答下列问题:
(1)黄钠铁矾中铁元素的化合价为
 中是否含有
中是否含有 的方法可以为
的方法可以为(2)第一次“氧化”中消耗的氧化剂与还原剂物质的量之比为
 ”时反应的离子方程式为
”时反应的离子方程式为(3)“氧化、沉钴”过程中加入的
 和
和 物质的量之比为
物质的量之比为 ,相应总反应的离子方程式为
,相应总反应的离子方程式为 转化为
转化为 的基本方法是
的基本方法是(4)基态
 的价层电子的轨道表示式为
的价层电子的轨道表示式为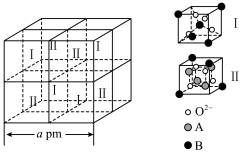
 的是
的是 ”或“
”或“ ”),若晶体密度为
”),若晶体密度为 ,则阿伏加德罗常数
,则阿伏加德罗常数
 (用含
(用含 、
、 的式子表示)。
的式子表示)。
您最近一年使用:0次
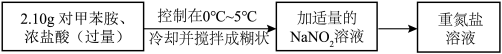
10 . 对氯甲苯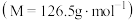 常作为染料、医药、有机合成的中间体,也可用作溶剂。其制取原理是:先用芳胺在一定条件下制成芳香重氮盐,然后在CuCl催化下,芳香重氮盐中的重氮基被氯原子取代生成芳香族氯化物。其原理如下:
常作为染料、医药、有机合成的中间体,也可用作溶剂。其制取原理是:先用芳胺在一定条件下制成芳香重氮盐,然后在CuCl催化下,芳香重氮盐中的重氮基被氯原子取代生成芳香族氯化物。其原理如下:
I.CuCl沉淀的制备
(1)将 、NaCl、
、NaCl、 、NaOH在水溶液中加热一段时间后,即可得到CuCl沉淀。
、NaOH在水溶液中加热一段时间后,即可得到CuCl沉淀。 俗称
俗称________ ,请写出该反应的离子方程式________ 。
Ⅱ.重氮盐溶液的制备 溶液过量可能带来的弊端是
溶液过量可能带来的弊端是________ ;可用尿素 将其除去,生成的气体无污染,请写出该反应的离子方程式
将其除去,生成的气体无污染,请写出该反应的离子方程式________ 。
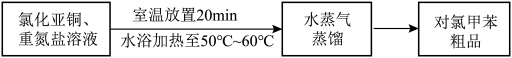
Ⅲ.对氯甲苯的制备________ ;________ (填序号)。
①熄灭酒精灯 ②打开旋塞 ③停止通冷凝水
(4)CuCl催化机理分两步进行,请补充完整:________ 。
(5)对氯甲苯粗品经过精制后,得到1.50g产品,本实验的产率最接近于________(填标号)。
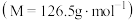 常作为染料、医药、有机合成的中间体,也可用作溶剂。其制取原理是:先用芳胺在一定条件下制成芳香重氮盐,然后在CuCl催化下,芳香重氮盐中的重氮基被氯原子取代生成芳香族氯化物。其原理如下:
常作为染料、医药、有机合成的中间体,也可用作溶剂。其制取原理是:先用芳胺在一定条件下制成芳香重氮盐,然后在CuCl催化下,芳香重氮盐中的重氮基被氯原子取代生成芳香族氯化物。其原理如下: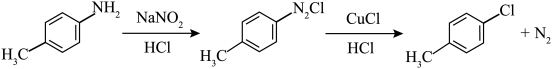
I.CuCl沉淀的制备
(1)将
 、NaCl、
、NaCl、 、NaOH在水溶液中加热一段时间后,即可得到CuCl沉淀。
、NaOH在水溶液中加热一段时间后,即可得到CuCl沉淀。 俗称
俗称Ⅱ.重氮盐溶液的制备
 溶液过量可能带来的弊端是
溶液过量可能带来的弊端是 将其除去,生成的气体无污染,请写出该反应的离子方程式
将其除去,生成的气体无污染,请写出该反应的离子方程式Ⅲ.对氯甲苯的制备
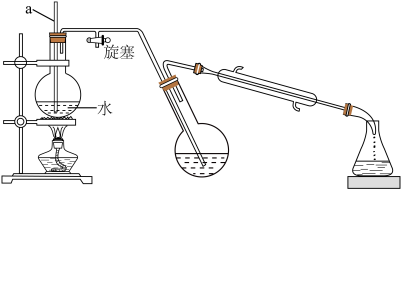
①熄灭酒精灯 ②打开旋塞 ③停止通冷凝水
(4)CuCl催化机理分两步进行,请补充完整:
①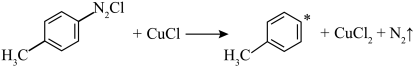
(5)对氯甲苯粗品经过精制后,得到1.50g产品,本实验的产率最接近于________(填标号)。
| A.55% | B.60% | C.65% | D.70% |
您最近一年使用:0次



