名校
解题方法
1 . 碱式氧化镍(NiOOH)可用作镍氢电池的正极材料。某实验室以含镍( )废液为原料生产NiOOH的一种工艺流程如图所示:
)废液为原料生产NiOOH的一种工艺流程如图所示:
(1)生产中将含 废渣粉碎的目的是
废渣粉碎的目的是_______ ,实验室除去 固体中少量的
固体中少量的 的方法是
的方法是_______ (填操作名称)。
(2)加入 溶液时,确认
溶液时,确认 已经完全沉淀的实验方法是
已经完全沉淀的实验方法是_______ 。
(3) 不宜加入过多,其原因是
不宜加入过多,其原因是_______ 。
(4)“加热”时发生反应的化学方程式为_______ 。
(5)若加热不充分,制得的NiOOH中会混有 。现称取9.18gNiOOH产品溶于稀硫酸,加入100mL1.000
。现称取9.18gNiOOH产品溶于稀硫酸,加入100mL1.000
 标准溶液,搅拌至溶液清亮,定容至200mL(
标准溶液,搅拌至溶液清亮,定容至200mL(
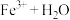 未配平)。取出20.00mL上述溶液,用0.010
未配平)。取出20.00mL上述溶液,用0.010
 标准溶液滴定,用去
标准溶液滴定,用去 标准溶液20.00mL(
标准溶液20.00mL( 不与
不与 反应)。
反应)。
①用 粉末和蒸馏水配制0.010
粉末和蒸馏水配制0.010 的
的 溶液,下列仪器不需要的是
溶液,下列仪器不需要的是_______ (填名称),定容时仰视容量瓶的刻度线,所配溶液浓度_______ (填“偏低”“无影响”或“偏高”)。_______ %(写出计算过程,结果保留一位小数)。
 )废液为原料生产NiOOH的一种工艺流程如图所示:
)废液为原料生产NiOOH的一种工艺流程如图所示: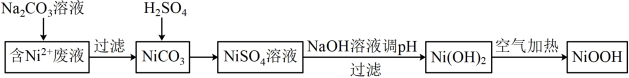
(1)生产中将含
 废渣粉碎的目的是
废渣粉碎的目的是 固体中少量的
固体中少量的 的方法是
的方法是(2)加入
 溶液时,确认
溶液时,确认 已经完全沉淀的实验方法是
已经完全沉淀的实验方法是(3)
 不宜加入过多,其原因是
不宜加入过多,其原因是(4)“加热”时发生反应的化学方程式为
(5)若加热不充分,制得的NiOOH中会混有
 。现称取9.18gNiOOH产品溶于稀硫酸,加入100mL1.000
。现称取9.18gNiOOH产品溶于稀硫酸,加入100mL1.000
 标准溶液,搅拌至溶液清亮,定容至200mL(
标准溶液,搅拌至溶液清亮,定容至200mL(
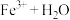 未配平)。取出20.00mL上述溶液,用0.010
未配平)。取出20.00mL上述溶液,用0.010
 标准溶液滴定,用去
标准溶液滴定,用去 标准溶液20.00mL(
标准溶液20.00mL( 不与
不与 反应)。
反应)。①用
 粉末和蒸馏水配制0.010
粉末和蒸馏水配制0.010 的
的 溶液,下列仪器不需要的是
溶液,下列仪器不需要的是
您最近一年使用:0次
2024-09-18更新
|
97次组卷
|
2卷引用:安徽省淮北市国泰中学2024-2025学年高三上学期9月月考化学试题
名校
2 . 在黄铁矿( )表面去除重金属机理如图所示,相关反应中,氧元素既体现氧化性又体现还原性的反应为
)表面去除重金属机理如图所示,相关反应中,氧元素既体现氧化性又体现还原性的反应为
 )表面去除重金属机理如图所示,相关反应中,氧元素既体现氧化性又体现还原性的反应为
)表面去除重金属机理如图所示,相关反应中,氧元素既体现氧化性又体现还原性的反应为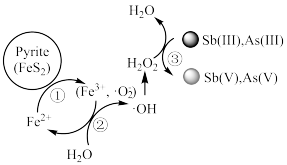
| A.② | B.③ | C.①② | D.①③ |
您最近一年使用:0次
2024-09-18更新
|
88次组卷
|
2卷引用:安徽省淮北市国泰中学2024-2025学年高三上学期9月月考化学试题
名校
3 . 无机化合物在生产、生活中有着广泛应用。下列过程中未涉及氧化还原反应的是
A. 用于制备 用于制备 |
B. 用于除去自来水中的余氯( 用于除去自来水中的余氯( ) ) |
C. 热溶液用于清洗餐具上残留的油污 热溶液用于清洗餐具上残留的油污 |
D. 用于去除水体中的 用于去除水体中的 及 及 等 等 |
您最近一年使用:0次
2024-09-18更新
|
74次组卷
|
2卷引用:安徽省淮北市国泰中学2024-2025学年高三上学期9月月考化学试题
4 .  和
和 的热化学循环可以利用太阳能,其转化关系如图所示。
的热化学循环可以利用太阳能,其转化关系如图所示。 可用来检验
可用来检验 。下列叙述错误的是
。下列叙述错误的是
 和
和 的热化学循环可以利用太阳能,其转化关系如图所示。
的热化学循环可以利用太阳能,其转化关系如图所示。
 可用来检验
可用来检验 。下列叙述错误的是
。下列叙述错误的是A.分析过程I和Ⅱ, 是该循环过程中的催化剂 是该循环过程中的催化剂 |
B.过程Ⅱ的化学方程式为 |
C.用盐酸、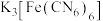 溶液检验 溶液检验 和 和 混合物中的 混合物中的 |
D.该循环过程利用了太阳能,而且降低了环境中 的含量 的含量 |
您最近一年使用:0次
2024-09-18更新
|
326次组卷
|
3卷引用:贵州省六盘水市六枝特区六校2024-2025学年高三上学期9月第一次联考 化学试题
解题方法
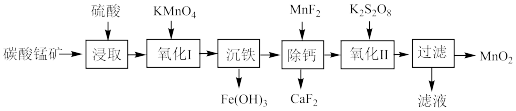
5 . 以碳酸锰矿(含 和少量FeO、
和少量FeO、 、CaO)为原料制取
、CaO)为原料制取 的工业流程如图所示。已知:
的工业流程如图所示。已知: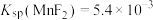 ,
,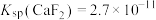 ,
, 氧化性强于
氧化性强于 ,其还原产物为
,其还原产物为 。
。
(1)Mn在元素周期表中的位置___________ 。
(2)为提高碳酸锰矿浸取速率,在用硫酸“浸取”时可采取的措施有:①___________ ;②搅拌;③适当升高温度等。
(3)“氧化I”的离子方程式为___________ 。
(4)“沉铁”过程加入的含钙元素的沉铁剂可能为___________ (写出一种即可)。
(5)若“除钙”后溶液中 ,则此时溶液中
,则此时溶液中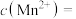
___________ mol/L。
(6)“氧化II”需加入 且过量,其原因是
且过量,其原因是___________ 。
(7)“过滤”后的滤液的溶质主要是___________ (填化学式)和过量的 。
。
 和少量FeO、
和少量FeO、 、CaO)为原料制取
、CaO)为原料制取 的工业流程如图所示。已知:
的工业流程如图所示。已知: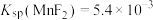 ,
,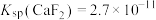 ,
, 氧化性强于
氧化性强于 ,其还原产物为
,其还原产物为 。
。
(1)Mn在元素周期表中的位置
(2)为提高碳酸锰矿浸取速率,在用硫酸“浸取”时可采取的措施有:①
(3)“氧化I”的离子方程式为
(4)“沉铁”过程加入的含钙元素的沉铁剂可能为
(5)若“除钙”后溶液中
 ,则此时溶液中
,则此时溶液中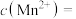
(6)“氧化II”需加入
 且过量,其原因是
且过量,其原因是(7)“过滤”后的滤液的溶质主要是
 。
。
您最近一年使用:0次
2024-09-17更新
|
85次组卷
|
2卷引用:山西省阳泉市城区瑞源教育培训学校2024-2025学年高三上学期8月月考化学试卷
名校
6 . 自由能大小可以反映物质氧化能力的相对强弱。锰元素的自由能-氧化态图如图所示,下列说法不正确 的是

A.碱性条件下 易被还原为 易被还原为 |
B.碱性条件下 ;的氧化能力明显降低 ;的氧化能力明显降低 |
C. 中Mn为+7价 中Mn为+7价 |
D.酸性条件下1mol ,被充分还原,则转移5mol电子 ,被充分还原,则转移5mol电子 |
您最近一年使用:0次
2024-09-16更新
|
328次组卷
|
2卷引用:江西省上饶市第二中学2024-2025学年高三上学期9月化学测试卷
名校
解题方法
7 . 碳还原法制备高纯硫酸锶的原理及工艺流程如图所示。天青石精矿的主要有效成分为 。SrS易溶于水且易水解。经过多次浸取除杂得到纯净的
。SrS易溶于水且易水解。经过多次浸取除杂得到纯净的 ,
, 与硫酸溶液反应生成硫酸锶。已知在元素周期表中,锶与钙同族。下列说法错误的是
与硫酸溶液反应生成硫酸锶。已知在元素周期表中,锶与钙同族。下列说法错误的是
 。SrS易溶于水且易水解。经过多次浸取除杂得到纯净的
。SrS易溶于水且易水解。经过多次浸取除杂得到纯净的 ,
, 与硫酸溶液反应生成硫酸锶。已知在元素周期表中,锶与钙同族。下列说法错误的是
与硫酸溶液反应生成硫酸锶。已知在元素周期表中,锶与钙同族。下列说法错误的是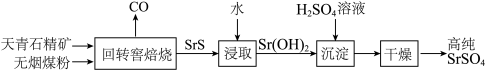
A.回转窑中发生反应的化学方程式为 |
| B.浸取时,升高温度,浸出速率加快,浸出率增大,同时还有气体生成 |
| C.该工艺流程中发生了氧化还原反应、水解反应和中和反应 |
D. 、 、 均不溶于水 均不溶于水 |
您最近一年使用:0次
2024-09-16更新
|
128次组卷
|
3卷引用:河南省八市重点高中2025届高三上学期第一次调研考试 化学试题
8 . 高氯酸氟( 或
或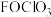 )易分解,会与有机物发生剧烈反应,会自发爆炸,自身有刺鼻的气味。制取
)易分解,会与有机物发生剧烈反应,会自发爆炸,自身有刺鼻的气味。制取 可采用特制的耐氟容器,使氟气(
可采用特制的耐氟容器,使氟气( )缓缓地与10%的
)缓缓地与10%的 溶液反应,实验装置如图。
溶液反应,实验装置如图。 、HF、
、HF、 的沸点依次为−188℃、19.54℃、−183.9℃;
的沸点依次为−188℃、19.54℃、−183.9℃; 的熔点为−167℃,沸点为−15.9℃。
的熔点为−167℃,沸点为−15.9℃。
Ⅱ.核磁共振碳谱中不同化学环境的碳出现不同的吸收峰。
回答下列问题:
(1) 中F元素的价态是
中F元素的价态是___________ 价,实验中生成 反应的化学方程式是
反应的化学方程式是___________ 。
(2)A中的环状填充物的作用是___________ ;实验中选用液氧分离 ,试分析原因:
,试分析原因:___________ 。
(3) 自身会分解生成
自身会分解生成 、
、 和一种氯的氧化物X,产物中
和一种氯的氧化物X,产物中 与X的化学计量数之比为1∶1,则
与X的化学计量数之比为1∶1,则 自身分解的化学方程式为
自身分解的化学方程式为___________ 。
(4) 可与六氟代丙烯发生加成反应形成C—F键,为探究它们反应的产物,提出以下假设:
可与六氟代丙烯发生加成反应形成C—F键,为探究它们反应的产物,提出以下假设:
假设1:产物只有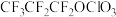 ;
;
假设2:产物只有___________ (填结构简式);
假设3:产物为两者的混合物。
为验证假设1是否成立,可采用的方法是___________ 。若假设1成立,现象是___________ 。
 或
或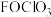 )易分解,会与有机物发生剧烈反应,会自发爆炸,自身有刺鼻的气味。制取
)易分解,会与有机物发生剧烈反应,会自发爆炸,自身有刺鼻的气味。制取 可采用特制的耐氟容器,使氟气(
可采用特制的耐氟容器,使氟气( )缓缓地与10%的
)缓缓地与10%的 溶液反应,实验装置如图。
溶液反应,实验装置如图。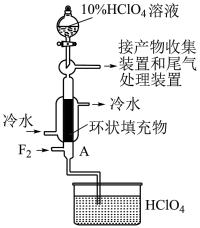
 、HF、
、HF、 的沸点依次为−188℃、19.54℃、−183.9℃;
的沸点依次为−188℃、19.54℃、−183.9℃; 的熔点为−167℃,沸点为−15.9℃。
的熔点为−167℃,沸点为−15.9℃。Ⅱ.核磁共振碳谱中不同化学环境的碳出现不同的吸收峰。
回答下列问题:
(1)
 中F元素的价态是
中F元素的价态是 反应的化学方程式是
反应的化学方程式是(2)A中的环状填充物的作用是
 ,试分析原因:
,试分析原因:(3)
 自身会分解生成
自身会分解生成 、
、 和一种氯的氧化物X,产物中
和一种氯的氧化物X,产物中 与X的化学计量数之比为1∶1,则
与X的化学计量数之比为1∶1,则 自身分解的化学方程式为
自身分解的化学方程式为(4)
 可与六氟代丙烯发生加成反应形成C—F键,为探究它们反应的产物,提出以下假设:
可与六氟代丙烯发生加成反应形成C—F键,为探究它们反应的产物,提出以下假设:假设1:产物只有
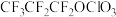 ;
;假设2:产物只有
假设3:产物为两者的混合物。
为验证假设1是否成立,可采用的方法是
您最近一年使用:0次
2024-09-15更新
|
48次组卷
|
3卷引用:广西部分示范性高中2024-2025学年高三上学期摸底考试化学试题
名校
9 . 由钛铁矿(主要成分是钛酸亚铁: ,还含有少量
,还含有少量 、
、 等杂质),制备海绵钛的一种工艺流程示意如下:
等杂质),制备海绵钛的一种工艺流程示意如下: ;
; 易水解,只能存于强酸性溶液中。
易水解,只能存于强酸性溶液中。
回答下列问题:
(1)浸渣为______ 。
(2)试剂X为______ (填化学式),X的作用是______ 。
(3)“操作Ⅱ”为______ 。
(4)“氯化”过程在高温条件下进行,发生反应的化学方程式为______ 。
(5)制备海绵钛中Ar的作用是______ 。
(6) 有三种类型晶体结构,其中一种晶胞结构如图所示。
有三种类型晶体结构,其中一种晶胞结构如图所示。______ 。
②晶胞中白球代表______ (填“钛”或“氧”),该晶体的密度为______  (用含a、b、
(用含a、b、 的代数式表示,
的代数式表示, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
 ,还含有少量
,还含有少量 、
、 等杂质),制备海绵钛的一种工艺流程示意如下:
等杂质),制备海绵钛的一种工艺流程示意如下: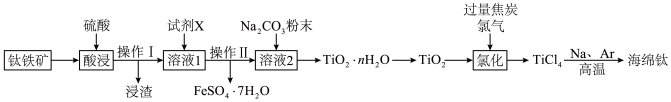
 ;
; 易水解,只能存于强酸性溶液中。
易水解,只能存于强酸性溶液中。回答下列问题:
(1)浸渣为
(2)试剂X为
(3)“操作Ⅱ”为
(4)“氯化”过程在高温条件下进行,发生反应的化学方程式为
(5)制备海绵钛中Ar的作用是
(6)
 有三种类型晶体结构,其中一种晶胞结构如图所示。
有三种类型晶体结构,其中一种晶胞结构如图所示。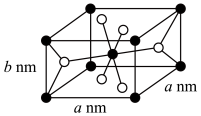
②晶胞中白球代表
 (用含a、b、
(用含a、b、 的代数式表示,
的代数式表示, 为阿伏加德罗常数的值)。
为阿伏加德罗常数的值)。
您最近一年使用:0次
2024-09-15更新
|
127次组卷
|
2卷引用:黑龙江省哈尔滨市第三中学校2024-2025学年高三上学期8月月考化学试卷
名校
10 .  分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。(700℃左右有两个吸热峰。)
分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。(700℃左右有两个吸热峰。)
 分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。(700℃左右有两个吸热峰。)
分解的TG曲线(热重)及DSC曲线(反映体系热量变化情况,数值已省略)如下图所示。(700℃左右有两个吸热峰。)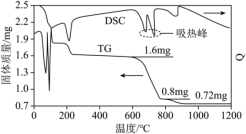
| A.0~400℃范围内,发生了化学变化 | B.600~800℃范围内,没有氧化还原反应发生 |
C.1000℃时,剩余固体的成分为 | D. 分解生成的气体可以用于制硫酸 分解生成的气体可以用于制硫酸 |
您最近一年使用:0次
2024-09-15更新
|
126次组卷
|
2卷引用:黑龙江省哈尔滨市第三中学校2024-2025学年高三上学期8月月考化学试卷



