解题方法
1 . 铬是最坚硬的金属,金刚石是自然界中最硬的物质。一种由铬铁矿(含 、MgO、
、MgO、 ,
, 等)为原料制备铬单质的流程如图所示。
等)为原料制备铬单质的流程如图所示。 ,
, 等。
等。
②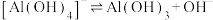
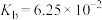 。
。
③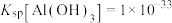
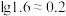 。
。
回答以下问题:
(1)焙烧时将矿料和NaOH进行研磨,目的是__________________ 。
(2)焙烧时生成 的化学方程式是
的化学方程式是__________________ 。
(3)已知0.1 mol/L 溶液中,铝形态的浓度(以
溶液中,铝形态的浓度(以 或
或 计)的对数(
计)的对数(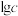 )随溶液pH变化的关系如图。
)随溶液pH变化的关系如图。______ 。(已知: 恰好在a~b的pH范围内完全沉淀)
恰好在a~b的pH范围内完全沉淀)
(4)工业上冶炼Cr的方法是______ 。基态Cr原子的价层电子排布图为____________ 。从原子结构及性质的角度分析金属Cr硬度很大的原因:________________________ 。
(5)晶体硅具有与金刚石相似的晶体结构(如图),已知Si原子半径为r pm,阿伏加德罗常数的值为 ,则晶体硅的密度为
,则晶体硅的密度为______ g/cm (列出计算表达式)。
(列出计算表达式)。____________ 。
 、MgO、
、MgO、 ,
, 等)为原料制备铬单质的流程如图所示。
等)为原料制备铬单质的流程如图所示。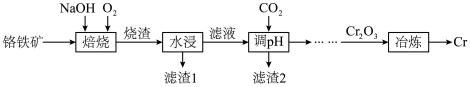
 ,
, 等。
等。②
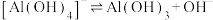
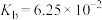 。
。③
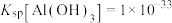
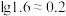 。
。回答以下问题:
(1)焙烧时将矿料和NaOH进行研磨,目的是
(2)焙烧时生成
 的化学方程式是
的化学方程式是(3)已知0.1 mol/L
 溶液中,铝形态的浓度(以
溶液中,铝形态的浓度(以 或
或 计)的对数(
计)的对数(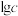 )随溶液pH变化的关系如图。
)随溶液pH变化的关系如图。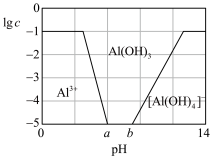
 恰好在a~b的pH范围内完全沉淀)
恰好在a~b的pH范围内完全沉淀)(4)工业上冶炼Cr的方法是
(5)晶体硅具有与金刚石相似的晶体结构(如图),已知Si原子半径为r pm,阿伏加德罗常数的值为
 ,则晶体硅的密度为
,则晶体硅的密度为 (列出计算表达式)。
(列出计算表达式)。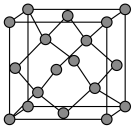
您最近一年使用:0次
2024-06-07更新
|
51次组卷
|
2卷引用:2024届新高考教学教研联盟高三下学期第一次联考化学试卷
2 . 喹啉 广泛用于医药、染料、农药和化学助剂等领域。在无水体系中利用Skraup反应制备喹啉的反应原理如下:
广泛用于医药、染料、农药和化学助剂等领域。在无水体系中利用Skraup反应制备喹啉的反应原理如下:
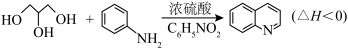
| 物质 | 分子式 | 相对分子质量 | 熔点(℃) | 沸点(℃° |
| 甘油 |  | 92 | 17.8 | 290 |
| 苯胺 | 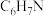 | 93 | -6.2 | 184 |
| 硝基苯 | 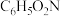 | 123 | 6 | 210 |
| 喹啉 | 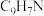 | 129 | -15.6 | 238.1 |
ⅱ.硫酸亚铁作反应的缓和剂。
实验步骤:
①预热:在250 mL三颈烧瓶中,加入2.0 g
 晶体和19 g无水甘油,控制温度在180℃左右,加热5 min。
晶体和19 g无水甘油,控制温度在180℃左右,加热5 min。②加料:待自然降温至100℃左右,依次加入4.65 g苯胺,4 g硝基苯和9 mL浓硫酸。
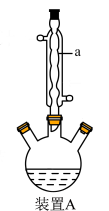
③制备:先用小火加热装置A,当反应液微沸时先立即移去加热装置,保持微沸继续反应,后小火回流2 h。
⑤蒸出:将溶液转移至圆底烧瓶,滴加40%NaOH溶液至强碱性,再用水蒸气蒸出。
⑥提纯:将粗品经分离、提纯、干燥后得到产品4.3g。
请回答下列问题:
(1)仪器a的名称是
(2)步骤③中,移去加热装置后若反应液继续沸腾,可采取的方法是
(3)用离子方程式表示步骤④中淀粉-KI试纸变蓝的原因:
(4)已知
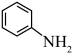 与
与 在酸性条件下反应生成重氮盐,加热煮沸时水解产生
在酸性条件下反应生成重氮盐,加热煮沸时水解产生 和苯酚。
和苯酚。步骤⑤中加入40%NaOH溶液的作用有:①
(5)检验步骤⑤中苯酚是否除尽的实验操作是
(6)计算该实验中喹啉的产率:
您最近一年使用:0次
2024-06-07更新
|
73次组卷
|
2卷引用:2024届新高考教学教研联盟高三下学期第一次联考化学试卷
3 . 某科研小组模拟在实验室条件下,用硫铁矿制备硫酸并测定其浓度,其实验过程如图所示。
(1)硫铁矿主要成分为_____ (写化学式);“操作1”和“操作2”_____ (填“相同”或“不同”)。
(2)“浸取”过程中,主要发生的反应的离子方程式为_____ 。
(3)“氧化”过程所需的氯气,可用漂白液和浓盐酸反应制取,该制取氯气的反应中氧化剂和还原剂的物质的量之比为_____ 。
(4)量取上述制备的硫酸溶液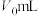 ,煮沸一段时间,冷却后,加水稀释到250mL,量取25mL配制的硫酸溶液于锥形瓶,滴几滴
,煮沸一段时间,冷却后,加水稀释到250mL,量取25mL配制的硫酸溶液于锥形瓶,滴几滴_____ 溶液,用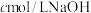 溶液滴定到终点,消耗
溶液滴定到终点,消耗 溶液
溶液 。该硫酸溶液的浓度为
。该硫酸溶液的浓度为_____  ,经过3次平行实验,发现测得的结果高于实际浓度,其原因可能是
,经过3次平行实验,发现测得的结果高于实际浓度,其原因可能是_____ (操作都正确)。

(1)硫铁矿主要成分为
(2)“浸取”过程中,主要发生的反应的离子方程式为
(3)“氧化”过程所需的氯气,可用漂白液和浓盐酸反应制取,该制取氯气的反应中氧化剂和还原剂的物质的量之比为
(4)量取上述制备的硫酸溶液
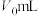 ,煮沸一段时间,冷却后,加水稀释到250mL,量取25mL配制的硫酸溶液于锥形瓶,滴几滴
,煮沸一段时间,冷却后,加水稀释到250mL,量取25mL配制的硫酸溶液于锥形瓶,滴几滴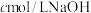 溶液滴定到终点,消耗
溶液滴定到终点,消耗 溶液
溶液 。该硫酸溶液的浓度为
。该硫酸溶液的浓度为 ,经过3次平行实验,发现测得的结果高于实际浓度,其原因可能是
,经过3次平行实验,发现测得的结果高于实际浓度,其原因可能是
您最近一年使用:0次
2024-06-06更新
|
27次组卷
|
2卷引用:2024届安徽省名校教研联盟高三下学期3月月考化学试卷
名校
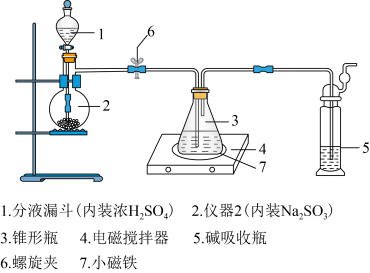
4 . 硫代硫酸钠被广泛用于纺织、造纸、化学合成等工业领域。制备硫代硫酸钠的装置如下图所示。
1.将浓硫酸缓缓注入仪器2中,适当调节螺旋夹6,使反应产生的气体均匀地进入锥形瓶中(硫化钠—碳酸钠溶液),并采用电磁搅拌器进行搅拌和加热。
2.持续通入气体,直至溶液的pH=7(注意不要小于7),停止通入气体。
3.将锥形瓶中的液体转移至烧杯中,________,过滤,得到 晶体样品。
晶体样品。
4.精确称取0.5000g步骤3的样品,用少量水溶解,再注入10mL醋酸-醋酸钠的缓冲溶液。以淀粉为指示剂,用0.1000mol/L的碘标准溶液滴定至终点,消耗标准溶液的体积为VmL。
已知:
请回答下列问题:
(1)仪器2的名称是________ 。
(2)写出生成硫代硫酸钠总反应的化学方程式________ 。
(3)补齐步骤3的实验操作________ 。
(4)用必要的文字说明为什么溶液的pH不能小于7________ 。
(5)①滴定时,应使用________ (填“酸式”或“碱式”)滴定管。
②滴定达到终点的标志是________ 。
③ 晶体的质量分数为
晶体的质量分数为________ (用含有V的代数式表示)。
④下列说法错误的是________ 。
a.滴定读数时,应单手持滴定管上端并保持其自然垂直
b.滴定实验中用到的玻璃仪器是烧杯、锥形瓶、滴定管
c.滴定前滴定管尖嘴处有气泡,导致实验结果偏低
d.用标准液润洗滴定管后,应将润洗液从滴定管上口倒出
1.将浓硫酸缓缓注入仪器2中,适当调节螺旋夹6,使反应产生的气体均匀地进入锥形瓶中(硫化钠—碳酸钠溶液),并采用电磁搅拌器进行搅拌和加热。
2.持续通入气体,直至溶液的pH=7(注意不要小于7),停止通入气体。
3.将锥形瓶中的液体转移至烧杯中,________,过滤,得到
 晶体样品。
晶体样品。4.精确称取0.5000g步骤3的样品,用少量水溶解,再注入10mL醋酸-醋酸钠的缓冲溶液。以淀粉为指示剂,用0.1000mol/L的碘标准溶液滴定至终点,消耗标准溶液的体积为VmL。
已知:

请回答下列问题:
(1)仪器2的名称是
(2)写出生成硫代硫酸钠总反应的化学方程式
(3)补齐步骤3的实验操作
(4)用必要的文字说明为什么溶液的pH不能小于7
(5)①滴定时,应使用
②滴定达到终点的标志是
③
 晶体的质量分数为
晶体的质量分数为④下列说法错误的是
a.滴定读数时,应单手持滴定管上端并保持其自然垂直
b.滴定实验中用到的玻璃仪器是烧杯、锥形瓶、滴定管
c.滴定前滴定管尖嘴处有气泡,导致实验结果偏低
d.用标准液润洗滴定管后,应将润洗液从滴定管上口倒出
您最近一年使用:0次
2024-06-06更新
|
138次组卷
|
2卷引用:辽宁省实验中学2023-2024学年高三下学期考前练习化学试卷
解题方法
5 . 氯化锰常用于医药合成、染料制造等工业,熔点为650℃,沸点为1190℃,易溶于水,能溶于乙醇,能发生水解,易潮解。实验室中,先用锌粒(含有ZnS等)制得的氢气还原二氧化锰制得白色金属锰,再用金属锰与氯气反应制备 ,装置如图所示(加热和夹持装置略)。回答下列问题:
,装置如图所示(加热和夹持装置略)。回答下列问题:_________ ,硫酸铜溶液的作用为(用离子方程式表示)__________ 。
(2)检查装置气密性后加入药品。先通 ,一段时间后,打开
,一段时间后,打开 ,使稀硫酸滴入三颈烧瓶中,产生的
,使稀硫酸滴入三颈烧瓶中,产生的 与硬质玻璃管中
与硬质玻璃管中 反应。证明
反应。证明 已被完全还原的现象是
已被完全还原的现象是___________ 。
(3) 完全还原后,再进行的操作为:①冷却D后,关闭
完全还原后,再进行的操作为:①冷却D后,关闭 ;②打开
;②打开 ,通
,通 一段时间;③先……,后……;④观察现象。操作②通
一段时间;③先……,后……;④观察现象。操作②通 的目的是
的目的是___________ ;操作③先___________ ,后___________ 。
(4)装置中存在的一处缺陷是___________ 。
(5)分离提纯 的操作:取粗产品
的操作:取粗产品 ,将其溶于乙醇,过滤,加热蒸发溶液。说明不用水溶解而用乙醇溶解
,将其溶于乙醇,过滤,加热蒸发溶液。说明不用水溶解而用乙醇溶解 的理由:
的理由:___________ 。
(6)设计实验证明 中
中 的还原性的操作:①取少量
的还原性的操作:①取少量 溶于水;②滴加足量
溶于水;②滴加足量 溶液,过滤;③滤液中加入
溶液,过滤;③滤液中加入 溶液,反应后溶液显紫色。③中反应的离子方程式是
溶液,反应后溶液显紫色。③中反应的离子方程式是___________ 。
 ,装置如图所示(加热和夹持装置略)。回答下列问题:
,装置如图所示(加热和夹持装置略)。回答下列问题:
(2)检查装置气密性后加入药品。先通
 ,一段时间后,打开
,一段时间后,打开 ,使稀硫酸滴入三颈烧瓶中,产生的
,使稀硫酸滴入三颈烧瓶中,产生的 与硬质玻璃管中
与硬质玻璃管中 反应。证明
反应。证明 已被完全还原的现象是
已被完全还原的现象是(3)
 完全还原后,再进行的操作为:①冷却D后,关闭
完全还原后,再进行的操作为:①冷却D后,关闭 ;②打开
;②打开 ,通
,通 一段时间;③先……,后……;④观察现象。操作②通
一段时间;③先……,后……;④观察现象。操作②通 的目的是
的目的是(4)装置中存在的一处缺陷是
(5)分离提纯
 的操作:取粗产品
的操作:取粗产品 ,将其溶于乙醇,过滤,加热蒸发溶液。说明不用水溶解而用乙醇溶解
,将其溶于乙醇,过滤,加热蒸发溶液。说明不用水溶解而用乙醇溶解 的理由:
的理由:(6)设计实验证明
 中
中 的还原性的操作:①取少量
的还原性的操作:①取少量 溶于水;②滴加足量
溶于水;②滴加足量 溶液,过滤;③滤液中加入
溶液,过滤;③滤液中加入 溶液,反应后溶液显紫色。③中反应的离子方程式是
溶液,反应后溶液显紫色。③中反应的离子方程式是
您最近一年使用:0次
6 . 锂和铍是重要的稀有金属,被国内外视为战略性资源。一种从尾矿(主要含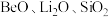 及
及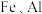 元素)中回收锂、铍、铝的工艺流程如图:
元素)中回收锂、铍、铝的工艺流程如图:
(1)“浸渣”中主要成分的晶体类型为_____ 。
(2)“沉铁”中生成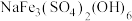 沉淀,其中
沉淀,其中 元素的化合价为
元素的化合价为_____ ,该反应的离子方程式为_____ 。
(3)“萃取”时,以 为萃取剂、
为萃取剂、 为协萃剂,溶液中的
为协萃剂,溶液中的 可与
可与 结合成
结合成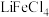 而被
而被 萃取。“反萃取”时,加入浓盐酸,发生
萃取。“反萃取”时,加入浓盐酸,发生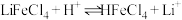 。
。
①“萃取”时还需要加入 ,其作用是
,其作用是_____ 。
②取 尾矿(其中
尾矿(其中 的质量分数为
的质量分数为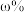 ),“反萃取”后所得
),“反萃取”后所得 水相中
水相中 ,则该过程
,则该过程 的回收率为
的回收率为_____ (用含相关物理量字母的代数式表示)。
(4)实验室提纯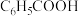 的方法是
的方法是_____ 。
(5)为了得到较高的空间利用率,离子晶体中的阴离子(通常半径较大)会尽可能紧密堆积,阳离子(通常半径较小)填入阴离子形成的空隙中,这种模型称为离子晶体的“堆积-填隙模型”。
已知常见的 型离子晶体的离子半径比和配位数的关系如下表:
型离子晶体的离子半径比和配位数的关系如下表:
表中离子半径比的临界值是由“堆积—填隙模型”中阴阳离子的几何关系确定的,例如配位数为8时,阳离子进入阴离子形成的正方体空隙,正方体8个顶点处的阴离了相切,空隙处(正方体体心)的阳离子与8个阴离子也相切,此时可由相关几何关系求得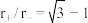 。
。
①
_____ 。
② 晶胞为立方
晶胞为立方 型,而
型,而 等的晶胞为
等的晶胞为 型。请结合上表,解释出现此结果的原因:
型。请结合上表,解释出现此结果的原因:_____ 。
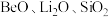 及
及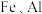 元素)中回收锂、铍、铝的工艺流程如图:
元素)中回收锂、铍、铝的工艺流程如图: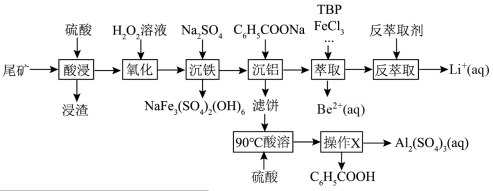
(1)“浸渣”中主要成分的晶体类型为
(2)“沉铁”中生成
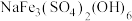 沉淀,其中
沉淀,其中 元素的化合价为
元素的化合价为(3)“萃取”时,以
 为萃取剂、
为萃取剂、 为协萃剂,溶液中的
为协萃剂,溶液中的 可与
可与 结合成
结合成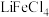 而被
而被 萃取。“反萃取”时,加入浓盐酸,发生
萃取。“反萃取”时,加入浓盐酸,发生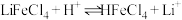 。
。①“萃取”时还需要加入
 ,其作用是
,其作用是②取
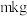 尾矿(其中
尾矿(其中 的质量分数为
的质量分数为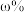 ),“反萃取”后所得
),“反萃取”后所得 水相中
水相中 ,则该过程
,则该过程 的回收率为
的回收率为(4)实验室提纯
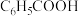 的方法是
的方法是(5)为了得到较高的空间利用率,离子晶体中的阴离子(通常半径较大)会尽可能紧密堆积,阳离子(通常半径较小)填入阴离子形成的空隙中,这种模型称为离子晶体的“堆积-填隙模型”。
已知常见的
 型离子晶体的离子半径比和配位数的关系如下表:
型离子晶体的离子半径比和配位数的关系如下表: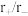 | 配位数 | 晶胞类型 |
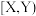 | 4 | 立方 |
 | 6 |  |
 | 8 |  |
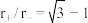 。
。①

②
 晶胞为立方
晶胞为立方 型,而
型,而 等的晶胞为
等的晶胞为 型。请结合上表,解释出现此结果的原因:
型。请结合上表,解释出现此结果的原因:
您最近一年使用:0次
2024-06-05更新
|
112次组卷
|
2卷引用:重庆市第八中学校2024届高三下学期高考适应性月考(七)化学试题
名校
解题方法
7 . 常温下,在封闭仪器中装有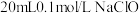 溶液,现向其中缓慢注入
溶液,现向其中缓慢注入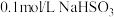 溶液,随着
溶液,随着 溶液注入体积增加,溶液的
溶液注入体积增加,溶液的 变化如下图所示(
变化如下图所示( 的电离平衡常数为
的电离平衡常数为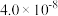 ),关于上述实验,下列分析错误的是
),关于上述实验,下列分析错误的是
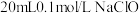 溶液,现向其中缓慢注入
溶液,现向其中缓慢注入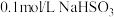 溶液,随着
溶液,随着 溶液注入体积增加,溶液的
溶液注入体积增加,溶液的 变化如下图所示(
变化如下图所示( 的电离平衡常数为
的电离平衡常数为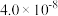 ),关于上述实验,下列分析错误的是
),关于上述实验,下列分析错误的是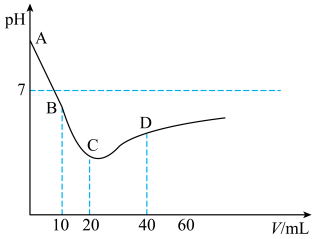
A.AB段主要发生的反应为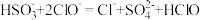 |
B.BC段 值降低主要是因为生成强酸 值降低主要是因为生成强酸 |
C.水电离程度 |
D. 时,溶液中离子浓度大小顺序为 时,溶液中离子浓度大小顺序为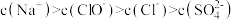 |
您最近一年使用:0次
2024-06-04更新
|
155次组卷
|
2卷引用:重庆市第一中学校2024届高三下学期5月测试化学试题
名校
解题方法
8 . 实验室以废旧磷酸铁锂 电极粉末为原料回收
电极粉末为原料回收 ,其实验过程可表示为
,其实验过程可表示为 磷酸铁锂加入三烧瓶中(装置见下图),滴液漏斗
磷酸铁锂加入三烧瓶中(装置见下图),滴液漏斗 装有
装有 盐酸、
盐酸、 中装有
中装有
 溶液。控制
溶液。控制 ,依次将两种溶液加入三颈烧瓶,充分反应
,依次将两种溶液加入三颈烧瓶,充分反应 后,过滤。
后,过滤。

①实验时应先打开滴液漏斗_______ (填“ ”或“
”或“ ”)。
”)。
②浸出后过滤所得滤渣主要成分为 写出
写出 转化为
转化为 的离子方程式:
的离子方程式:_______ 。
③控制原料 锂的浸出率为
锂的浸出率为 若提高盐酸用量,可使锂浸出率达
若提高盐酸用量,可使锂浸出率达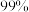 以上,但同时可能存在的缺陷有
以上,但同时可能存在的缺陷有_______ 。
(2)用碳酸钠作沉淀剂从浸出液中回收碳酸锂。有同学建议用“侯氏制碱法”的原理制备 查阅资料发现文献对常温下的
查阅资料发现文献对常温下的 有不同的描述:
有不同的描述:
i.白色固体。ii.尚未从溶液中分离出来。
为探究 的性质,将饱和
的性质,将饱和 溶液与饱和
溶液与饱和 溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。
溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。
①上述现象说明,在该实验条件下
_______ (填“稳定”或“不稳定”)。
②实验中发生反应的离子方程式为_______ 。
(3)盐湖提盐后的浓缩卤水(含 和少量
和少量 )也常用作制备
)也常用作制备 的重要原料。已知:常温时
的重要原料。已知:常温时 的溶解度为:
的溶解度为:
 的溶解度曲线如下图所示。
的溶解度曲线如下图所示。 请补充完整实验方案:向浓缩卤水中边搅拌边缓慢添加石灰乳,
请补充完整实验方案:向浓缩卤水中边搅拌边缓慢添加石灰乳,_______ ,洗涤,低温烘干。 完全沉淀
完全沉淀 可选用的试剂:饱和
可选用的试剂:饱和 溶液、饱和
溶液、饱和 溶液、
溶液、 固体、蒸馏水]。
固体、蒸馏水]。
 电极粉末为原料回收
电极粉末为原料回收 ,其实验过程可表示为
,其实验过程可表示为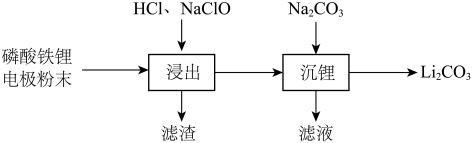
 磷酸铁锂加入三烧瓶中(装置见下图),滴液漏斗
磷酸铁锂加入三烧瓶中(装置见下图),滴液漏斗 装有
装有 盐酸、
盐酸、 中装有
中装有
 溶液。控制
溶液。控制 ,依次将两种溶液加入三颈烧瓶,充分反应
,依次将两种溶液加入三颈烧瓶,充分反应 后,过滤。
后,过滤。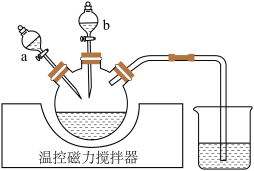


①实验时应先打开滴液漏斗
 ”或“
”或“ ”)。
”)。②浸出后过滤所得滤渣主要成分为
 写出
写出 转化为
转化为 的离子方程式:
的离子方程式:③控制原料
 锂的浸出率为
锂的浸出率为 若提高盐酸用量,可使锂浸出率达
若提高盐酸用量,可使锂浸出率达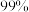 以上,但同时可能存在的缺陷有
以上,但同时可能存在的缺陷有(2)用碳酸钠作沉淀剂从浸出液中回收碳酸锂。有同学建议用“侯氏制碱法”的原理制备
 查阅资料发现文献对常温下的
查阅资料发现文献对常温下的 有不同的描述:
有不同的描述:i.白色固体。ii.尚未从溶液中分离出来。
为探究
 的性质,将饱和
的性质,将饱和 溶液与饱和
溶液与饱和 溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。
溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。①上述现象说明,在该实验条件下

②实验中发生反应的离子方程式为
(3)盐湖提盐后的浓缩卤水(含
 和少量
和少量 )也常用作制备
)也常用作制备 的重要原料。已知:常温时
的重要原料。已知:常温时 的溶解度为:
的溶解度为:
 的溶解度曲线如下图所示。
的溶解度曲线如下图所示。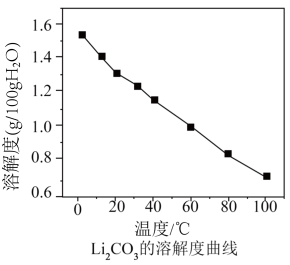
 请补充完整实验方案:向浓缩卤水中边搅拌边缓慢添加石灰乳,
请补充完整实验方案:向浓缩卤水中边搅拌边缓慢添加石灰乳, 完全沉淀
完全沉淀 可选用的试剂:饱和
可选用的试剂:饱和 溶液、饱和
溶液、饱和 溶液、
溶液、 固体、蒸馏水]。
固体、蒸馏水]。
您最近一年使用:0次
解题方法
9 . 利用 酸性溶液与
酸性溶液与 的反应,可以进行趣味的“碘钟实验”。以淀粉为指示剂,不停振荡锥形瓶,反应原理如下:①
的反应,可以进行趣味的“碘钟实验”。以淀粉为指示剂,不停振荡锥形瓶,反应原理如下:①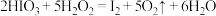 ,②
,②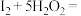
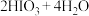 ,下列说法
,下列说法不正确 的是
 酸性溶液与
酸性溶液与 的反应,可以进行趣味的“碘钟实验”。以淀粉为指示剂,不停振荡锥形瓶,反应原理如下:①
的反应,可以进行趣味的“碘钟实验”。以淀粉为指示剂,不停振荡锥形瓶,反应原理如下:①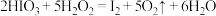 ,②
,②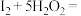
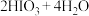 ,下列说法
,下列说法| A.实验现象:蓝色—无色—蓝色—无色重复出现 |
| B.①②两个反应的净反应相当于双氧水的歧化分解 |
C.反应①的氧化剂是 ,还原剂是 ,还原剂是 |
D.反应②每生成 ,反应转移 ,反应转移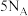 电子 电子 |
您最近一年使用:0次
10 . 以金红石(主要成分为 )为原料制备
)为原料制备 的主要过程如下:
的主要过程如下: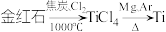 。下列叙述错误的是
。下列叙述错误的是
 )为原料制备
)为原料制备 的主要过程如下:
的主要过程如下: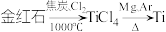 。下列叙述错误的是
。下列叙述错误的是A.利用碳氯化工艺制备 的化学方程式为 的化学方程式为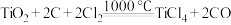 |
B.粗 提纯过程中,具体操作步骤有用水溶解、结晶、过滤等 提纯过程中,具体操作步骤有用水溶解、结晶、过滤等 |
C.制备Ti的主要过程中的 用 用 代替,会影响 代替,会影响 的产率和纯度 的产率和纯度 |
| D.将金红石和焦炭充分混合研磨后,再通入氯气可以提高反应速率 |
您最近一年使用:0次



