1 . 铵明矾晶体的化学式为 ,以铵明矾为原料可实现如图转化。
,以铵明矾为原料可实现如图转化。 与题中阳离子不形成配合物,固体A为纯净物。
与题中阳离子不形成配合物,固体A为纯净物。
(1)铵明矾晶体“隔绝空气加热”分解产物中含硫化合物有___________ 。
(2)步骤III中生成白色沉淀C反应的化学方程式为___________ 。
(3)合成铵明矾过程中常使用过量的硫酸铵,一个作用是抑制硫酸铝水解,另一个重要作用是___________ 。
(4)设计实验验证固体A含有的金属元素:___________ 。
(5)步骤I中,铵明矾晶体在各温度段内受热“失重计算值”如表所示。(失重计算值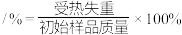 )
)
通过上述数据可判断,在温度区间___________ ℃,铵明矾基本上失去了结晶水。
 ,以铵明矾为原料可实现如图转化。
,以铵明矾为原料可实现如图转化。
 与题中阳离子不形成配合物,固体A为纯净物。
与题中阳离子不形成配合物,固体A为纯净物。(1)铵明矾晶体“隔绝空气加热”分解产物中含硫化合物有
(2)步骤III中生成白色沉淀C反应的化学方程式为
(3)合成铵明矾过程中常使用过量的硫酸铵,一个作用是抑制硫酸铝水解,另一个重要作用是
(4)设计实验验证固体A含有的金属元素:
(5)步骤I中,铵明矾晶体在各温度段内受热“失重计算值”如表所示。(失重计算值
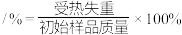 )
)| 温度区间/℃ | 18→190 | 190→430 | 430→505 | 505→900 |
| 失重计算值/% | 39.20 | 7.80 | 13.00 | 26.00 |
您最近一年使用:0次
名校
2 . 二氧化铈( )是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含
)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含 、
、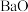 、
、 等)为原料制备
等)为原料制备 ,其工艺流程如图所示:
,其工艺流程如图所示:
(1)“焙烧”时,通入空气的主要目的是_________________ 。
(2)滤渣的主要成分是___________________ (填化学式)。
(3)“还原、脱氟”时,先加入硫脲(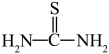 ),目的是将溶液中的
),目的是将溶液中的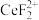 还原为
还原为 ,写出该反应的离子方程式:
,写出该反应的离子方程式:_________________ [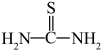 被氧化为
被氧化为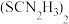 ,生成物还有HF和
,生成物还有HF和 ]。
]。
(4)“沉铈”时反应的离子方程式为__________________ 。若用 溶液代替
溶液代替 溶液,产生的后果是
溶液,产生的后果是________________ 。
(5)若常温下,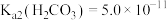 ,
,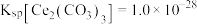 ,
, 恰好沉淀完全
恰好沉淀完全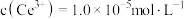 ,此时测得溶液的
,此时测得溶液的 ,则溶液中
,则溶液中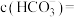
_____________  。
。
(6)二氧化铈作为一种SCR脱硝催化剂,能在 和
和 之间改变氧化状态,将
之间改变氧化状态,将 氧化为
氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物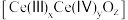 。铈氧化物发生的可能变化如图所示。当
。铈氧化物发生的可能变化如图所示。当
 氧化标准状况下
氧化标准状况下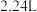 NO后,生成新的铈氧化物中x、y、z的最简整数比为
NO后,生成新的铈氧化物中x、y、z的最简整数比为____________ 。
 )是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含
)是一种应用非常广泛的稀土氧化物。现以氟碳铈矿(含 、
、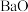 、
、 等)为原料制备
等)为原料制备 ,其工艺流程如图所示:
,其工艺流程如图所示: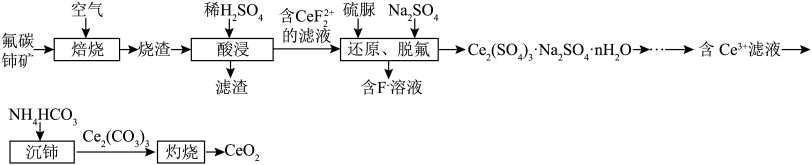
(1)“焙烧”时,通入空气的主要目的是
(2)滤渣的主要成分是
(3)“还原、脱氟”时,先加入硫脲(
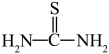 ),目的是将溶液中的
),目的是将溶液中的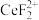 还原为
还原为 ,写出该反应的离子方程式:
,写出该反应的离子方程式: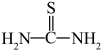 被氧化为
被氧化为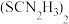 ,生成物还有HF和
,生成物还有HF和 ]。
]。(4)“沉铈”时反应的离子方程式为
 溶液代替
溶液代替 溶液,产生的后果是
溶液,产生的后果是(5)若常温下,
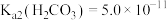 ,
,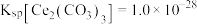 ,
, 恰好沉淀完全
恰好沉淀完全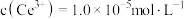 ,此时测得溶液的
,此时测得溶液的 ,则溶液中
,则溶液中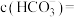
 。
。(6)二氧化铈作为一种SCR脱硝催化剂,能在
 和
和 之间改变氧化状态,将
之间改变氧化状态,将 氧化为
氧化为 ,并引起氧空位的形成,得到新的铈氧化物
,并引起氧空位的形成,得到新的铈氧化物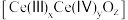 。铈氧化物发生的可能变化如图所示。当
。铈氧化物发生的可能变化如图所示。当
 氧化标准状况下
氧化标准状况下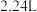 NO后,生成新的铈氧化物中x、y、z的最简整数比为
NO后,生成新的铈氧化物中x、y、z的最简整数比为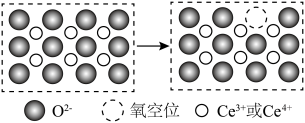
您最近一年使用:0次
2024-05-27更新
|
128次组卷
|
3卷引用:广西桂林市第十八中学2023-2024学年高三下学期5月月考化学试卷
3 . 碘酸钙[ ]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备
]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备 实验步骤如下:
实验步骤如下:
Ⅰ.将一定质量的 、
、 和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
Ⅱ.步骤Ⅰ反应完毕后,将烧瓶内的混合液倒入烧杯中,滴入KOH溶液调节pH=10,然后用滴管逐滴加入1 的
的 溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
Ⅲ.碘酸钙粗品纯度:准确称取a g碘酸钙粗品于烧杯中,加入10mL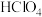 将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL
将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL 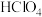 、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用
、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用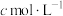 的
的 溶液滴定,平行三次,平均消耗
溶液滴定,平行三次,平均消耗 溶液的体积为V mL(
溶液的体积为V mL( )
)
(1)仪器a的名称为___________ ,b中应盛放的最佳传热介质是___________ 。
(2)步骤Ⅰ中反应生成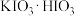 、
、 等,写出反应的化学方程式:
等,写出反应的化学方程式:___________ 。反应过程中,在烧瓶瓶颈或仪器a下口处可能会看到___________ (填物质名称)析出,其原因是___________ 。
(3)步骤Ⅱ“一系列操作”包括静置、___________ 、洗涤、干燥,其中洗涤所用较佳试剂为___________ (填“水”或“乙醇”)。
(4)碘酸钙粗晶纯度为___________ %(用含a、c、V的代数式表示),下列情况导致产品纯度测定结果偏低的是___________ (填字母)。
A.所配待测溶液中含有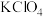 少量沉淀 B.定容时俯视读数
少量沉淀 B.定容时俯视读数
C.盛放 溶液的滴定管未润洗 D.滴定后俯视读数
溶液的滴定管未润洗 D.滴定后俯视读数
 ]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备
]为白色结晶性粉末,微溶于水,不溶于乙醇,主要用作防臭剂、药物和食品添加剂。某同学在实验室制备 实验步骤如下:
实验步骤如下:Ⅰ.将一定质量的
 、
、 和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;
和45mL水加入圆底烧瓶中,再加入几滴盐酸,使溶液的pH≈1,控制温度在85℃回流大约1h;Ⅱ.步骤Ⅰ反应完毕后,将烧瓶内的混合液倒入烧杯中,滴入KOH溶液调节pH=10,然后用滴管逐滴加入1
 的
的 溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;
溶液,至沉淀完全。经一系列操作,得到碘酸钙粗品;Ⅲ.碘酸钙粗品纯度:准确称取a g碘酸钙粗品于烧杯中,加入10mL
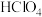 将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL
将其溶解,转移至250mL容量瓶中定容,移取25.00 mL溶液于锥形瓶中,再加入1mL 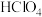 、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用
、20mL KI溶液,在避光处放置3min,加入50mL水,用淀粉作指示剂,用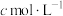 的
的 溶液滴定,平行三次,平均消耗
溶液滴定,平行三次,平均消耗 溶液的体积为V mL(
溶液的体积为V mL( )
)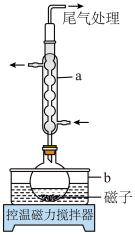
(1)仪器a的名称为
(2)步骤Ⅰ中反应生成
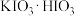 、
、 等,写出反应的化学方程式:
等,写出反应的化学方程式:(3)步骤Ⅱ“一系列操作”包括静置、
(4)碘酸钙粗晶纯度为
A.所配待测溶液中含有
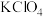 少量沉淀 B.定容时俯视读数
少量沉淀 B.定容时俯视读数C.盛放
 溶液的滴定管未润洗 D.滴定后俯视读数
溶液的滴定管未润洗 D.滴定后俯视读数
您最近一年使用:0次
2024-05-27更新
|
183次组卷
|
3卷引用:2024届九师联盟高三下学期四月月考化学试卷
4 . 已知 晶体在加热条件下发生如下反应:
晶体在加热条件下发生如下反应: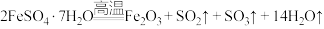 (已知:
(已知: 和
和 的熔点分别为-72.7℃、16.8℃,沸点分别为-10℃、44.8℃);利用下图装置可检验该反应的气体产物。下列说法错误的是
的熔点分别为-72.7℃、16.8℃,沸点分别为-10℃、44.8℃);利用下图装置可检验该反应的气体产物。下列说法错误的是
 晶体在加热条件下发生如下反应:
晶体在加热条件下发生如下反应: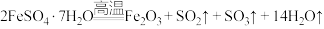 (已知:
(已知: 和
和 的熔点分别为-72.7℃、16.8℃,沸点分别为-10℃、44.8℃);利用下图装置可检验该反应的气体产物。下列说法错误的是
的熔点分别为-72.7℃、16.8℃,沸点分别为-10℃、44.8℃);利用下图装置可检验该反应的气体产物。下列说法错误的是
| A.仪器的连接顺序为a、f(或g)、g(或f)、h、i、d、e、b |
B.装置C中的X溶液为 溶液 溶液 |
| C.装置B的作用为处理尾气 |
D.反应中每生成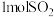 ,转移2mol电子 ,转移2mol电子 |
您最近一年使用:0次
解题方法
5 . 元素周期表可以用于探寻各种元素间的内在联系。
(1)下列关于元素周期表的说法错误的是______ 。
a.门捷列夫按照原子的核电荷数由小到大排列制出了第一张元素周期表
b.元素周期表由三个短周期,四个长周期构成
c.在金属和非金属的分界线处寻找半导体材料
d.元素周期表中含有主族、副族、第VⅢ族、0族等十八个族
(2)利用元素在周期表中的位置、结构、性质的关系,得出的结论正确的是______ 。
a.原子半径:Li>Na>K b.酸性:H3PO4>H2SO4>HClO4
c.稳定性:H2Se>H2S>H2O d.碱性:NaOH>Mg(OH)2>Al(OH)3
(3)碳族元素包括:C、Si、Ge、Sn、Pb、Fl(放射性元素)
①请完成CO2和KOH溶液恰好反应生成正盐的离子方程式_______ 。
②写出Si在元素周期表中的位置_______ 。由碳族元素结构特点,可推测Pb3O4中Pb的化合价为_____ 。
(4)卤族元素包括:F、Cl、Br、I、At(放射性元素)
①Br与F的原子序数的差值为______ 。
②已知某溶液中只含有Fe2+、Cl﹣、Br﹣、I﹣,且c(Cl﹣):c(Br﹣):c(I﹣)=1:1:2,则c(Fe2+):c(Br﹣)=____ 。向其中通入一定量的氯气发生反应,当c(Fe2+):c(Cl﹣)=1:4时,离子方程式为_____ 。
(1)下列关于元素周期表的说法错误的是
a.门捷列夫按照原子的核电荷数由小到大排列制出了第一张元素周期表
b.元素周期表由三个短周期,四个长周期构成
c.在金属和非金属的分界线处寻找半导体材料
d.元素周期表中含有主族、副族、第VⅢ族、0族等十八个族
(2)利用元素在周期表中的位置、结构、性质的关系,得出的结论正确的是
a.原子半径:Li>Na>K b.酸性:H3PO4>H2SO4>HClO4
c.稳定性:H2Se>H2S>H2O d.碱性:NaOH>Mg(OH)2>Al(OH)3
(3)碳族元素包括:C、Si、Ge、Sn、Pb、Fl(放射性元素)
①请完成CO2和KOH溶液恰好反应生成正盐的离子方程式
②写出Si在元素周期表中的位置
(4)卤族元素包括:F、Cl、Br、I、At(放射性元素)
①Br与F的原子序数的差值为
②已知某溶液中只含有Fe2+、Cl﹣、Br﹣、I﹣,且c(Cl﹣):c(Br﹣):c(I﹣)=1:1:2,则c(Fe2+):c(Br﹣)=
您最近一年使用:0次
解题方法
6 . 某化学兴趣小组为探究 的性质,按下图装置进行实验。回答下列问题:
的性质,按下图装置进行实验。回答下列问题:_______ ,A中发生反应的化学方程式为_______ 。
(2)B中出现淡黄色沉淀,则证明 具有
具有______ 性,发生反应的化学方程式为______ 。
(3)装置B、C、D中能够证明 具有还原性的是
具有还原性的是____ (填字母),观察到的现象为____ 。
(4)当反应进行一段时间后,装置E中最终生成少量红色沉淀,为确定红色沉淀的成分,进行以下实验:_______ (填“只有Cu”“只有 ”或“Cu和
”或“Cu和 的混合物”);E中出现少量红色沉淀的总反应的离子方程式为
的混合物”);E中出现少量红色沉淀的总反应的离子方程式为_______ 。
(5)在三颈烧瓶中加入 溶液和
溶液和 溶液,在加热条件下通入
溶液,在加热条件下通入 充分反应生成
充分反应生成 ,将含
,将含 的溶液进行结晶,可得到
的溶液进行结晶,可得到 晶体样品。用
晶体样品。用 溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取
溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取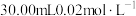 的
的 溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
已知实验过程中发生的反应的计算关系式为: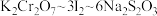 。则该样品的纯度为
。则该样品的纯度为_______ %(保留三位有效数字)。
 的性质,按下图装置进行实验。回答下列问题:
的性质,按下图装置进行实验。回答下列问题: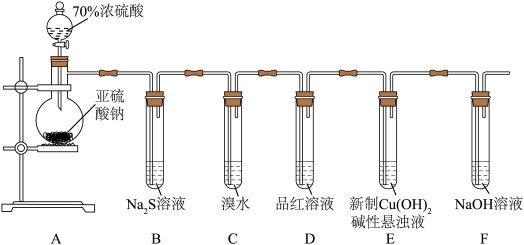
(2)B中出现淡黄色沉淀,则证明
 具有
具有(3)装置B、C、D中能够证明
 具有还原性的是
具有还原性的是(4)当反应进行一段时间后,装置E中最终生成少量红色沉淀,为确定红色沉淀的成分,进行以下实验:

 ”或“Cu和
”或“Cu和 的混合物”);E中出现少量红色沉淀的总反应的离子方程式为
的混合物”);E中出现少量红色沉淀的总反应的离子方程式为(5)在三颈烧瓶中加入
 溶液和
溶液和 溶液,在加热条件下通入
溶液,在加热条件下通入 充分反应生成
充分反应生成 ,将含
,将含 的溶液进行结晶,可得到
的溶液进行结晶,可得到 晶体样品。用
晶体样品。用 溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取
溶液测定样品的纯度,步骤如下:称取5.00g样品,用蒸馏水溶解,配成100mL样品溶液。取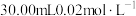 的
的 溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。
溶液,用稀硫酸酸化后加入过量KI溶液,然后滴加样品溶液至溶液呈淡黄绿色,再加入淀粉溶液作指示剂,继续滴加样品溶液,蓝色恰好完全消失时,共消耗样品溶液20.00mL。已知实验过程中发生的反应的计算关系式为:
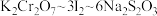 。则该样品的纯度为
。则该样品的纯度为
您最近一年使用:0次
解题方法
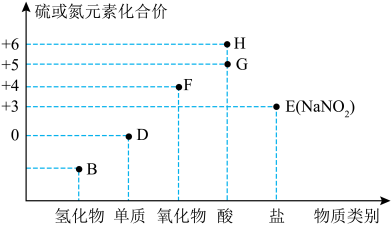
7 . “价—类”二维图是学习元素化合物的一种好方法。硫或氮及其化合物的部分“价—类”二维图如图所示,回答下列问题: ,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):
,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):_______ 。
(2)若B为 ,则下列关于氨气的性质和用途描述正确的是_______(填字母)。
,则下列关于氨气的性质和用途描述正确的是_______(填字母)。
(3)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸( ),该反应的化学方程式为
),该反应的化学方程式为_______ ;某厂废液中含有2%~5%的 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为
转化为 的是
的是_______ (填字母)。
A.NaOH B. C.
C. D.浓硫酸
D.浓硫酸
(4)D可以是 ,已知同温同压下,同体积的
,已知同温同压下,同体积的 与
与 (蒸气)的质量比为7:64,则x=
(蒸气)的质量比为7:64,则x=_____ 。
(5) 在空气中易变质,写出检验
在空气中易变质,写出检验 发生变质的实验方法:
发生变质的实验方法:_______ 。
(6)常温下,G的浓溶液可以用干燥的铁或铝制容器盛装,原因是_______ 。
 ,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):
,写出F和G的稀溶液反应生成H的化学方程式(还原产物为+2价氧化物):(2)若B为
 ,则下列关于氨气的性质和用途描述正确的是_______(填字母)。
,则下列关于氨气的性质和用途描述正确的是_______(填字母)。| A.氨气易液化;液氨可用作制冷剂 | B.可用排水法收集氨气 |
| C.氨气是一种无色、无味的气体 | D.向氨水中滴加酚酞,溶液变红 |
(3)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(
 ),该反应的化学方程式为
),该反应的化学方程式为 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为
转化为 的是
的是A.NaOH B.
 C.
C. D.浓硫酸
D.浓硫酸(4)D可以是
 ,已知同温同压下,同体积的
,已知同温同压下,同体积的 与
与 (蒸气)的质量比为7:64,则x=
(蒸气)的质量比为7:64,则x=(5)
 在空气中易变质,写出检验
在空气中易变质,写出检验 发生变质的实验方法:
发生变质的实验方法:(6)常温下,G的浓溶液可以用干燥的铁或铝制容器盛装,原因是
您最近一年使用:0次
解题方法
8 . 硼氢化钠是重要的贮氢材料,水解可以释放出氢气: (未配平),下列说法正确的是(
(未配平),下列说法正确的是( 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)
 (未配平),下列说法正确的是(
(未配平),下列说法正确的是( 为阿伏加德罗常数的值)
为阿伏加德罗常数的值)A. 中氢元素的化合价是+1价 中氢元素的化合价是+1价 | B.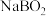 是氧化产物, 是氧化产物, 是还原产物 是还原产物 |
C.生成1mol 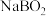 转移电子的数目为 转移电子的数目为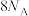 | D.水中加少量盐酸,会加快化学反应速率 |
您最近一年使用:0次
解题方法
9 . 化学让生活更加美好。下列对化学物质的使用所作的解释不正确的是
选项 | 化学物质的使用 | 解释 |
A | 滴眼液中含有微量硝酸银 | 银离子可使蛋白质变性 |
B | 用氢氟酸雕刻玻璃 |
|
C | 用铝罐盛放浓硫酸 | 浓硫酸不与 |
D | 维生素C常用作抗氧化剂 | 维生素C能被氧化为脱氢抗坏血酸 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-05-24更新
|
162次组卷
|
2卷引用:广东省部分学校2024届高三下学期5月份大联考化学试题
名校
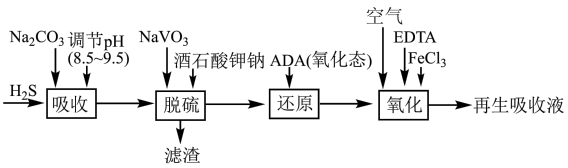
10 . 蒽醌二磺酸钠法(ADA法)对合成氨原料气进行脱硫(H2S)的工艺流程如图所示,该工艺的优势之一在于只要向“再生吸收液”不断通如空气即可实现连续吸收H2S气体。
ii.酒石酸钾钠、EDTA可分别与V4+、Fe3+形成可溶性配合物。
(1)“吸收”时,发生反应的离子方程式为___________ 。
(2)“脱硫”时,NaVO3先转化为Na2V4O9同时可得到S,则该转化过程反应的化学方程式为___________ 。
(3)“还原”时,氧化态ADA(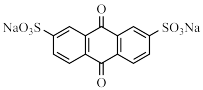 )转化为还原态ADA(
)转化为还原态ADA(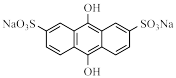 ),同时NaVO3得以再生。该转化过程需要消耗NaOH,但该工艺中并没有再加入该试剂的原因为
),同时NaVO3得以再生。该转化过程需要消耗NaOH,但该工艺中并没有再加入该试剂的原因为___________ ,Na2V4O9参与反应过程中氧化剂和还原剂的物质的量之比为___________ 。
(4)“氧化”时,ADA(还原态)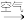 ADA(氧化态),同时有H2O2生成。从氧化还原反应角度分析,FeCl3的作用可能是
ADA(氧化态),同时有H2O2生成。从氧化还原反应角度分析,FeCl3的作用可能是___________ ;加入EDTA的目的是___________ 。
(5)“再生吸收液”中可循环使用的物质有___________ (填选项字母)。
A.NaOH B.酒石酸钾钠 C.NaVO3 D.EDTA E.ADA
ii.酒石酸钾钠、EDTA可分别与V4+、Fe3+形成可溶性配合物。
(1)“吸收”时,发生反应的离子方程式为
(2)“脱硫”时,NaVO3先转化为Na2V4O9同时可得到S,则该转化过程反应的化学方程式为
(3)“还原”时,氧化态ADA(
 )转化为还原态ADA(
)转化为还原态ADA( ),同时NaVO3得以再生。该转化过程需要消耗NaOH,但该工艺中并没有再加入该试剂的原因为
),同时NaVO3得以再生。该转化过程需要消耗NaOH,但该工艺中并没有再加入该试剂的原因为(4)“氧化”时,ADA(还原态)
 ADA(氧化态),同时有H2O2生成。从氧化还原反应角度分析,FeCl3的作用可能是
ADA(氧化态),同时有H2O2生成。从氧化还原反应角度分析,FeCl3的作用可能是(5)“再生吸收液”中可循环使用的物质有
A.NaOH B.酒石酸钾钠 C.NaVO3 D.EDTA E.ADA
您最近一年使用:0次

 与玻璃中
与玻璃中 反应
反应

