名校
1 . 二氧化氯( )是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备
)是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备 水溶液。下列说法错误的是
水溶液。下列说法错误的是
 )是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备
)是一种黄绿色到橙黄色的气体,极易溶于水,体积分数大于10%时,易发生爆炸,是一种无毒的绿色消毒剂。实验室可用下图所示装置(夹持仪器已省略)制备 水溶液。下列说法错误的是
水溶液。下列说法错误的是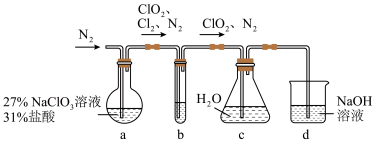
A.装置a的反应产物中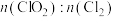 的比值一定为2:1 的比值一定为2:1 |
| B.装置b的主要作用是除去混合气体中的HCl |
C.通入氮气的目的为稀释装置a中产生的 并使其中产生的气体全部进入后续装置 并使其中产生的气体全部进入后续装置 |
D.装置d可除去多余的 |
您最近一年使用:0次
名校
2 . 尿素(分子式 )水溶液热解产生的NH3可去除尾气中的NOx,流程如下:
)水溶液热解产生的NH3可去除尾气中的NOx,流程如下:
 )水溶液热解产生的NH3可去除尾气中的NOx,流程如下:
)水溶液热解产生的NH3可去除尾气中的NOx,流程如下: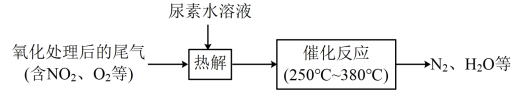
| A.尿素中氮元素的化合价为-3 |
B.“催化反应”过程中NH3还原NO2的化学方程式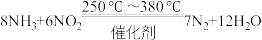 |
| C.若氧化处理后的尾气中混有SO2,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低NOx的去除率。硫酸盐的产生是因为SO2被O2、H2O还原成H2SO4,再与NH3反应而得 |
D.“催化反应”过程中需控制温度在 之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低 之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低 |
您最近一年使用:0次
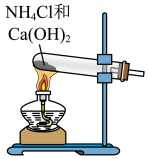
3 . 合成氨是人类科学技术发展史上的一项重大成就。实验室利用如右图所示装置及药品制取氨气:_____________ 。
(2)下列装置中,可用于收集氨的是_________ (填标号)。______________ 。
(4)在一定条件下,将2molN2和6molH2在体积恒为5L的密闭容器中混合,发生如下反应:N2(g)+3H2(g) 2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:
2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:
①2min内该反应的平均反应速率v(N2)=______ mol/(L·min)
②一段时间后反应达到平衡,密闭容器中混合气体的压强比反应前减少了25%,计算此时容器中NH3的浓度为____________ mol/L。
③能说明该反应已经达到平衡状态的是____________ 。
a.气体的密度保持不变 b.NH3的含量保持不变
c.N2和H2的物质的量之比为1:3 d.N2的转化率不再发生改变
(5)工业上通常用氨转化法处理含NO、NO2等氮氧化物的尾气:已知8 mol氨恰好能将含NO和NO2共7mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为_____ 。
(2)下列装置中,可用于收集氨的是
a. 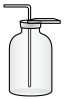 b.
b. 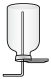 c.
c. 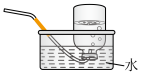
(4)在一定条件下,将2molN2和6molH2在体积恒为5L的密闭容器中混合,发生如下反应:N2(g)+3H2(g)
 2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:
2NH3(g)。2min时测得容器内N2的物质的量为1.6mol,则:①2min内该反应的平均反应速率v(N2)=
②一段时间后反应达到平衡,密闭容器中混合气体的压强比反应前减少了25%,计算此时容器中NH3的浓度为
③能说明该反应已经达到平衡状态的是
a.气体的密度保持不变 b.NH3的含量保持不变
c.N2和H2的物质的量之比为1:3 d.N2的转化率不再发生改变
(5)工业上通常用氨转化法处理含NO、NO2等氮氧化物的尾气:已知8 mol氨恰好能将含NO和NO2共7mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
您最近一年使用:0次
名校
4 . I.神舟十七号载人航天飞船于2023年10月26日成功发射,飞船搭载的是中国研制的长征二号F遥十七运载火箭,采用四氧化二氮(N2O4)和偏二甲肼(C2H8N2)作为推进剂,二者反应生成二氧化碳、水蒸气和氮气。
(1)偏二甲肼的摩尔质量为___________ 。
(2)四氧化二氮能与水反应生成亚硝酸和___________ (写化学式)。
(3)四氧化二氮和偏二甲肼反应的化学方程式为:2N2O4+C2H8N2 2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是
2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是___________ 。
(4)已知N2、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO2的质量为___________ 。
II.二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
(5)将二氧化氯通入紫色石蕊试液中,溶液褪色的理由是___________ 。
(6)设NA为阿伏加德罗常数的值,现有10g质量分数为64%的甲醇(CH3OH)水溶液,则该溶液所含氢原子数目为___________ 。
(7)假设CO2和ClO2在标准状况下均为气体,则反应CH3OH+NaClO3+H2SO4 → CO2↑+ClO2↑+Na2SO4 +H2O(未配平)中转移的电子数目为0.6NA时,该反应产生标准状况下气体的体积为___________ 。
(1)偏二甲肼的摩尔质量为
(2)四氧化二氮能与水反应生成亚硝酸和
(3)四氧化二氮和偏二甲肼反应的化学方程式为:2N2O4+C2H8N2
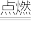 2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是
2CO2+3N2+4H2O,若反应生成3mol N2,则转移的电子的物质的量是(4)已知N2、CO2混合气体的质量共10.0g,在标准状况下的体积为6.72L,则混合气体中CO2的质量为
II.二氧化氯(ClO2)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。已知:工业上制备二氧化氯的方法之一是用甲醇在酸性介质中与氯酸钠反应。二氧化氯能与许多化学物质发生爆炸性反应,遇水则生成次氯酸、氯气和氧气。
(5)将二氧化氯通入紫色石蕊试液中,溶液褪色的理由是
(6)设NA为阿伏加德罗常数的值,现有10g质量分数为64%的甲醇(CH3OH)水溶液,则该溶液所含氢原子数目为
(7)假设CO2和ClO2在标准状况下均为气体,则反应CH3OH+NaClO3+H2SO4 → CO2↑+ClO2↑+Na2SO4 +H2O(未配平)中转移的电子数目为0.6NA时,该反应产生标准状况下气体的体积为
您最近一年使用:0次
解题方法
5 . 二氧化碲(TeO2)是一种性能优良的声光晶体材料,一种以铜碲渣(主要成分为Cu2Te,还含有少量Cu,Ag)为原料制备TeO2并获得海绵铜的工艺流程如图所示。
(1)Te位于元素周期表的___________ 族。
(2)“氧化酸浸”时:
①Cu2Te中被氧化的元素为___________ ,为了加快反应速率,不可以采取的措施为___________ (写字母)
A.搅拌反应物 B.升高反应体系的温度 C. 将铜碲渣粉碎 D.使用浓H2SO4
②除Cu2Te反应外,Ag、Cu溶解,配平其中Ag发生反应的离子方程式:______ 。
□Ag+□H++□ =□___________+□H2O+AgCl。
=□___________+□H2O+AgCl。
③若使用稀硝酸代替NaClO3,不足之处可能是___________ 。
(3)“碱浸提碲”时,TeO2反应的化学方程式为___________ ,浸渣b的主要成分为___________ 。
(4)“净化中和”时,稀硫酸参加的主要反应的离子方程式为___________ 。
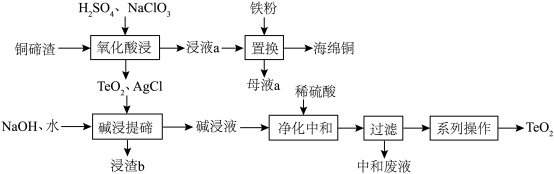
(1)Te位于元素周期表的
(2)“氧化酸浸”时:
①Cu2Te中被氧化的元素为
A.搅拌反应物 B.升高反应体系的温度 C. 将铜碲渣粉碎 D.使用浓H2SO4
②除Cu2Te反应外,Ag、Cu溶解,配平其中Ag发生反应的离子方程式:
□Ag+□H++□
 =□___________+□H2O+AgCl。
=□___________+□H2O+AgCl。③若使用稀硝酸代替NaClO3,不足之处可能是
(3)“碱浸提碲”时,TeO2反应的化学方程式为
(4)“净化中和”时,稀硫酸参加的主要反应的离子方程式为
您最近一年使用:0次
名校
6 . 铁是人类较早使用的金属之一,下图为铁元素的价类二维图,其中的箭头表示部分物质间的转化关系。运用铁及其化合物的知识,回答下列问题。_______ ;E→F反应的化学方程式是_______ ,该反应过程的现象为_______ 。
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,高铁酸钾作为自来水处理剂的优点_______ ;湿法制备高铁酸钾(K2FeO4)的反应体系中有六种微粒:Fe(OH)3、ClO-、OH-、FeO 、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式
、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式_______ 。
(3)将FeCl3饱和溶液滴入沸水中,继续煮沸至液体呈_______ ,制得分散系为_______ ,它与FeCl3溶液、Fe(OH)3浊液的本质区别是_______ 。
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路请写出FeCl3溶液与铜反应的离子方程式:_______ 。
(5)城市饮用水处理新技术用NaClO2、高铁酸钠代替Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么NaClO2、Na2FeO4、Cl2的消毒效率由大到小的顺序是_______ 。
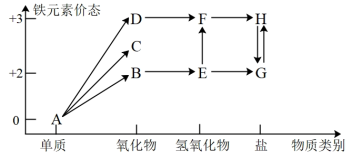
(2)高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,高铁酸钾作为自来水处理剂的优点
 、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式
、Cl-、H2O,写出并配平该法制备高铁酸钾的离子反应方程式(3)将FeCl3饱和溶液滴入沸水中,继续煮沸至液体呈
(4)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路请写出FeCl3溶液与铜反应的离子方程式:
(5)城市饮用水处理新技术用NaClO2、高铁酸钠代替Cl2,如果以单位质量的氧化剂所得到的电子数来表示消毒效率,那么NaClO2、Na2FeO4、Cl2的消毒效率由大到小的顺序是
您最近一年使用:0次
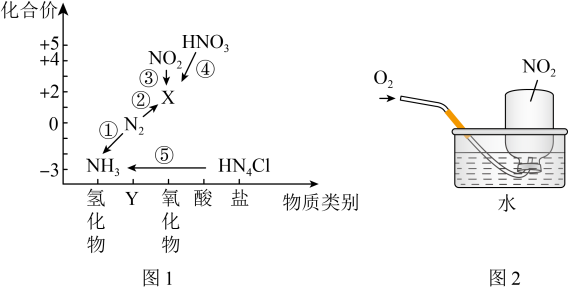
7 . 氮元素是高中化学学习的一种重要非金属元素,其价类二维图如图1所示。________ ,反应①~⑤中不属于氧化还原反应的是________ (填序号)。
(2)反应①中每消耗1mol氢气,转移电子________ mol。
(3)除去X中混有的少量 的方法是
的方法是________ 。
(4)工业以氨气为原料制备硝酸的第一步反应为氨的催化氧化,写出该反应的化学方程式________ 。
(5)用集气瓶收集 气体并倒置在水槽中,然后缓慢通入适量
气体并倒置在水槽中,然后缓慢通入适量 ,如图2所示。一段时间后,集气瓶中充满溶液。
,如图2所示。一段时间后,集气瓶中充满溶液。
①写出该过程总反应的化学方程式________ 。该实验对工业上生产硝酸的启示是________ 。
②假设该实验条件下,气体摩尔体积为 ,瓶内液体不扩散,则集气瓶中溶液的物质的量浓度为
,瓶内液体不扩散,则集气瓶中溶液的物质的量浓度为________ mol/L。
(2)反应①中每消耗1mol氢气,转移电子
(3)除去X中混有的少量
 的方法是
的方法是(4)工业以氨气为原料制备硝酸的第一步反应为氨的催化氧化,写出该反应的化学方程式
(5)用集气瓶收集
 气体并倒置在水槽中,然后缓慢通入适量
气体并倒置在水槽中,然后缓慢通入适量 ,如图2所示。一段时间后,集气瓶中充满溶液。
,如图2所示。一段时间后,集气瓶中充满溶液。①写出该过程总反应的化学方程式
②假设该实验条件下,气体摩尔体积为
 ,瓶内液体不扩散,则集气瓶中溶液的物质的量浓度为
,瓶内液体不扩散,则集气瓶中溶液的物质的量浓度为
您最近一年使用:0次
名校
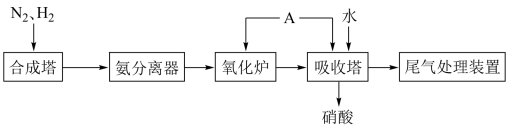
8 . 硝酸是重要的化工原料。工业制硝酸的原理示意图可简略表示如下(反应条件和部分生成物已略去):___________ 。
(2)物质A是___________ 。向吸收塔中通入A的作用是___________ 。
(3)硝酸能溶解铜,请写出铜和稀硝酸反应的离子方程式:___________ ,在该反应中硝酸体现了___________ 性。
(4)用绿色氧化剂(10%H2O2和20%稀硝酸的混合液)溶解铜,基本无氮氧化物排放,写出Cu与绿色氧化剂反应的离子反应方程式___________ 。
(5)硝酸工业尾气中的 会造成光化学烟雾和酸雨,污染环境,可用碱性溶液吸收。已知
会造成光化学烟雾和酸雨,污染环境,可用碱性溶液吸收。已知 用碳酸钠溶液吸收时会生成CO2、
用碳酸钠溶液吸收时会生成CO2、 和另一种化合物,写出反应的离子方程式
和另一种化合物,写出反应的离子方程式___________ 。
(2)物质A是
(3)硝酸能溶解铜,请写出铜和稀硝酸反应的离子方程式:
(4)用绿色氧化剂(10%H2O2和20%稀硝酸的混合液)溶解铜,基本无氮氧化物排放,写出Cu与绿色氧化剂反应的离子反应方程式
(5)硝酸工业尾气中的
 会造成光化学烟雾和酸雨,污染环境,可用碱性溶液吸收。已知
会造成光化学烟雾和酸雨,污染环境,可用碱性溶液吸收。已知 用碳酸钠溶液吸收时会生成CO2、
用碳酸钠溶液吸收时会生成CO2、 和另一种化合物,写出反应的离子方程式
和另一种化合物,写出反应的离子方程式
您最近一年使用:0次
2024-05-03更新
|
118次组卷
|
2卷引用:贵州省贵阳市清华中学、安顺一中等校2023-2024学年高一下学期第一次联考化学试题
名校
解题方法
9 . 碱式氧化镍是镍电池的正极活性材料。利用镍渣(主要含NiO,及少量 、CuO、CaO、
、CuO、CaO、 等杂质)制备碱式氧化镍的流程如下:
等杂质)制备碱式氧化镍的流程如下:
(2)浸渣的主要成分是_______ 。
(3)“沉铜”过程中生成单质S的离子方程式为______ 。
(4)“氧化”中的目的是将 氧化为
氧化为 ,试剂R可选用
,试剂R可选用_____ (填标号)。写出“氧化”时反应的离子方程式:_____ 。
A.氯水 B. 酸性溶液 C.
酸性溶液 C.
(5)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,电池的总反应为
 ,其工作时的正极电极反应式为
,其工作时的正极电极反应式为_______ 。
(6)若用2.0t废料(含NiO75%)制得NiOOH 0.92 t,则NiOOH的产率为_____ %。
 、CuO、CaO、
、CuO、CaO、 等杂质)制备碱式氧化镍的流程如下:
等杂质)制备碱式氧化镍的流程如下: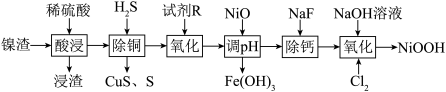
| A.研磨废料 | B.加入大量水 | C.搅拌 | D.适当升高温度 |
(2)浸渣的主要成分是
(3)“沉铜”过程中生成单质S的离子方程式为
(4)“氧化”中的目的是将
 氧化为
氧化为 ,试剂R可选用
,试剂R可选用A.氯水 B.
 酸性溶液 C.
酸性溶液 C.
(5)碱式氧化镍(NiOOH)可用作镍氢电池的正极材料,电池的总反应为

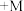 ,其工作时的正极电极反应式为
,其工作时的正极电极反应式为(6)若用2.0t废料(含NiO75%)制得NiOOH 0.92 t,则NiOOH的产率为
您最近一年使用:0次
2024-05-03更新
|
294次组卷
|
2卷引用:广东省深圳市翠园中学、龙城高级中学2023-2024学年高一下学期第一次月考化学试题
10 . 铁及其化合物与生产、生活关系密切:
(1)下列铁化合物中,可以通过化合反应得到是_______(填字母序号)。
(2) 可作为铜电路板的腐蚀液,该反应的化学方程式
可作为铜电路板的腐蚀液,该反应的化学方程式_______ 。向反应后的溶液加入_______ (填名称),可回收Cu,并得到 溶液。
溶液。
(3)用废铁皮制取( )的部分流程示意图如下:
)的部分流程示意图如下:_______ 。
(4) 可制取新型、高效水处理剂高铁酸钾,反应原理为
可制取新型、高效水处理剂高铁酸钾,反应原理为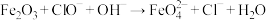 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为_______ 。
(5) 可将氨氮废水中
可将氨氮废水中 的转化为
的转化为 除去。从价态角度分析,
除去。从价态角度分析, 能处理氨氮废水的原因是
能处理氨氮废水的原因是_______ 。当该反应转移1.2mol电子时,能产生_______ mol 。
。
(1)下列铁化合物中,可以通过化合反应得到是_______(填字母序号)。
A. | B. | C. | D. |
(2)
 可作为铜电路板的腐蚀液,该反应的化学方程式
可作为铜电路板的腐蚀液,该反应的化学方程式 溶液。
溶液。(3)用废铁皮制取(
 )的部分流程示意图如下:
)的部分流程示意图如下: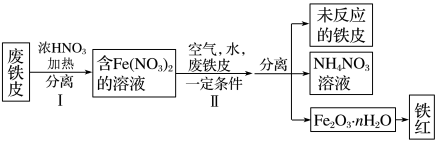
(4)
 可制取新型、高效水处理剂高铁酸钾,反应原理为
可制取新型、高效水处理剂高铁酸钾,反应原理为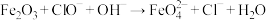 (未配平),该反应中氧化剂与还原剂的物质的量之比为
(未配平),该反应中氧化剂与还原剂的物质的量之比为(5)
 可将氨氮废水中
可将氨氮废水中 的转化为
的转化为 除去。从价态角度分析,
除去。从价态角度分析, 能处理氨氮废水的原因是
能处理氨氮废水的原因是 。
。
您最近一年使用:0次
2024-05-03更新
|
165次组卷
|
2卷引用:福建省晋江市养正中学2023-2024学年高一下学期3月第一次月考化学试题



