名校
解题方法
1 . 已知反应: ,
, 为阿伏加德罗常数的值,若消耗
为阿伏加德罗常数的值,若消耗 ,下列叙述的错误的是
,下列叙述的错误的是
 ,
, 为阿伏加德罗常数的值,若消耗
为阿伏加德罗常数的值,若消耗 ,下列叙述的错误的是
,下列叙述的错误的是A.转移电子数为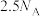 |
B.断裂的 键数为 键数为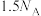 |
| C.还原产物比氧化产物多0.5mol |
D.将生成物配制成1L水溶液,溶液中 |
您最近一年使用:0次
名校
解题方法
2 . 锰在汽车电池、高端装备制造、新材料等领域有广泛应用。利用软锰矿(主要成分为 ,含
,含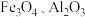 等杂质)和黄铁矿(主要成分为
等杂质)和黄铁矿(主要成分为 )联合制备绿矾和高纯
)联合制备绿矾和高纯 ,并用所得
,并用所得 制备
制备 的工艺流程如下:
的工艺流程如下: 如下:
如下:
回答下列问题:
(1)将软锰矿和黄铁矿“粉碎”,并用水调至糊状的目的是______ 。“浸渣”中除了含有不溶于酸的杂质外,还含有生成的单质 ,则“酸浸”时发生的主要反应的离子方程式为
,则“酸浸”时发生的主要反应的离子方程式为______ 。
(2)常温下, 的溶度积
的溶度积
______ 。“调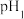 ”的范围为
”的范围为______ 。
(3)“沉锰”时,溶液的 、反应时间与
、反应时间与 的产率的关系如图1所示。“沉锰”时,应调节溶液的
的产率的关系如图1所示。“沉锰”时,应调节溶液的 为
为______ 。“沉锰”反应的离子方程式为______ 。______ 。
(5)“电解”制取金属锰的化学方程式为______ 。
(6)铜、钛和锰、铁都是第四周期的过渡元素。一种含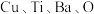 四元铜氧化物超导体晶体的晶胞结构如图2所示(晶胞参数为
四元铜氧化物超导体晶体的晶胞结构如图2所示(晶胞参数为 ),该晶体的密度为
),该晶体的密度为______  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 ,含
,含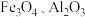 等杂质)和黄铁矿(主要成分为
等杂质)和黄铁矿(主要成分为 )联合制备绿矾和高纯
)联合制备绿矾和高纯 ,并用所得
,并用所得 制备
制备 的工艺流程如下:
的工艺流程如下: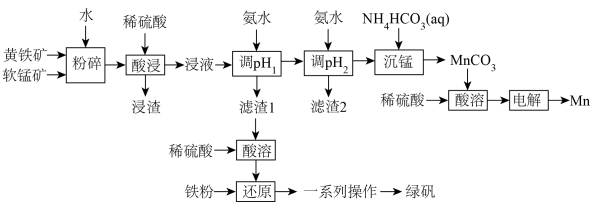
 如下:
如下:| 金属离子 |  |  |  |  |
| 开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全 的 的 | 10.1 | 8.3 | 2.8 | 4.7 |
(1)将软锰矿和黄铁矿“粉碎”,并用水调至糊状的目的是
 ,则“酸浸”时发生的主要反应的离子方程式为
,则“酸浸”时发生的主要反应的离子方程式为(2)常温下,
 的溶度积
的溶度积
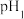 ”的范围为
”的范围为(3)“沉锰”时,溶液的
 、反应时间与
、反应时间与 的产率的关系如图1所示。“沉锰”时,应调节溶液的
的产率的关系如图1所示。“沉锰”时,应调节溶液的 为
为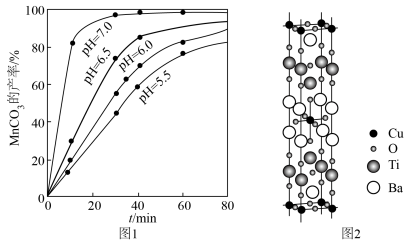
(5)“电解”制取金属锰的化学方程式为
(6)铜、钛和锰、铁都是第四周期的过渡元素。一种含
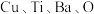 四元铜氧化物超导体晶体的晶胞结构如图2所示(晶胞参数为
四元铜氧化物超导体晶体的晶胞结构如图2所示(晶胞参数为 ),该晶体的密度为
),该晶体的密度为 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
您最近一年使用:0次
名校
解题方法
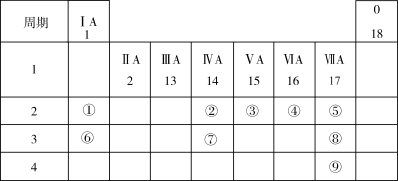
3 . 下表列出了9种元素在元素周期表中的位置示意图。
(1)画出元素⑧形成的简单离子的结构示意图___________ 。
(2)用电子式表示元素④和⑥的单质在常温下反应所得产物的形成过程为___________ 。
(3)将③的最简单氢化物通入③的最高价氧化物对应水化物的溶液中,所得溶液中主要阳离子含有的化学键是___________ 。
(4)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最差的是___________ (填化学式),写出元素⑧的单质与水反应的离子反应方程式___________ 。
(5)工业上可以用Na2CO3溶液吸收Br2(g),过程中有气体生成,且产物中BrO-与BrO 的物质的量之比为2:1,请写出该过程的离子反应方程式
的物质的量之比为2:1,请写出该过程的离子反应方程式___________ 。
(6)32.64gCu与一定浓度③的最高价氧化物对应水化物反应生成NO、NO2、N2O4等气体,将生成的NO、NO2、N2O4与0.1molO2混合后,通入NaOH溶液,气体被完全吸收得到NaNO3和NaNO2的混合溶液,则混合溶液中NaNO2的物质的量为___________ mol。
(1)画出元素⑧形成的简单离子的结构示意图
(2)用电子式表示元素④和⑥的单质在常温下反应所得产物的形成过程为
(3)将③的最简单氢化物通入③的最高价氧化物对应水化物的溶液中,所得溶液中主要阳离子含有的化学键是
(4)②、③、④、⑤四种元素的简单气态氢化物中,稳定性最差的是
(5)工业上可以用Na2CO3溶液吸收Br2(g),过程中有气体生成,且产物中BrO-与BrO
 的物质的量之比为2:1,请写出该过程的离子反应方程式
的物质的量之比为2:1,请写出该过程的离子反应方程式(6)32.64gCu与一定浓度③的最高价氧化物对应水化物反应生成NO、NO2、N2O4等气体,将生成的NO、NO2、N2O4与0.1molO2混合后,通入NaOH溶液,气体被完全吸收得到NaNO3和NaNO2的混合溶液,则混合溶液中NaNO2的物质的量为
您最近一年使用:0次
4 . 已知FeSO4有如图所示的转化关系,下列叙述正确的是

| A.M一定是红棕色粉末 |
| B.图中发生了3个氧化还原反应 |
| C.生成HNO3的反应中,浓硫酸表现强氧化性、难挥发性和强酸性 |
D.“褪色”的原因是SO2+Br2+2H2O=4H++ +2Br- +2Br- |
您最近一年使用:0次
名校
解题方法
5 . 碘化亚铜(CuI)是白色粉末,不溶于水和乙醇,溶于浓硫酸,易被氧化,常用作有机反应催化剂、阳极射线管覆盖物、动物饲料添加剂等。在实验室制备CuI的装置如图所示(部分夹持装置已省略)。
(1)装置D的作用是除去SO2中的H2SO4蒸气,盛放的溶液是___________(填选项字母)。
(2)按气流从左到右的方向,各装置的连接顺序为a→___________ (填仪器接口小写字母)。
(3)装置C中发生反应的化学方程式为___________ 。
(4)实验结束时的现象是___________ 。
(5)实验结束后,熄灭装置A中的酒精灯,打开K,向装置内鼓入N2一段时间,其目的是___________ 。
(6)先用装置B中的溶液洗涤制得的CuI,然后再用无水乙醇洗涤,可能的原因是___________ 。
(7)准确称取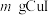 样品,加入足量
样品,加入足量 溶液,发生反应
溶液,发生反应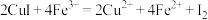 ,待样品完全反应后,用
,待样品完全反应后,用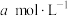 酸性
酸性 溶液滴定
溶液滴定 ,消耗
,消耗 溶液的体积为
溶液的体积为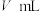 ,则样品中
,则样品中 的质量分数为
的质量分数为___________ 。(用含a、V、m的代数式表示,列出计算式即可)

(1)装置D的作用是除去SO2中的H2SO4蒸气,盛放的溶液是___________(填选项字母)。
| A.品红溶液 | B.NaOH溶液 | C.饱和NaHSO3溶液 | D.饱和Na2SO3溶液 |
(2)按气流从左到右的方向,各装置的连接顺序为a→
(3)装置C中发生反应的化学方程式为
(4)实验结束时的现象是
(5)实验结束后,熄灭装置A中的酒精灯,打开K,向装置内鼓入N2一段时间,其目的是
(6)先用装置B中的溶液洗涤制得的CuI,然后再用无水乙醇洗涤,可能的原因是
(7)准确称取
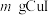 样品,加入足量
样品,加入足量 溶液,发生反应
溶液,发生反应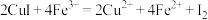 ,待样品完全反应后,用
,待样品完全反应后,用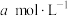 酸性
酸性 溶液滴定
溶液滴定 ,消耗
,消耗 溶液的体积为
溶液的体积为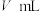 ,则样品中
,则样品中 的质量分数为
的质量分数为
您最近一年使用:0次
名校
6 . 请根据硫元素的价类二维图,回答下列问题:___________ (填化学式)。
(2)宋代著名法医学家宋慈的 洗冤集录
洗冤集录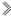 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法错误 的是___________(填字母)。
(3)Y转化为Z可以选择下列试剂___________ 。
A.酸性KMnO4溶液 B.FeCl2溶液 C.NaOH溶液 D.X的水溶液
写出你所选试剂将Y转化为Z的离子方程式___________ 。
(4)若N是CuSO4,某同学设计了甲和乙两种方法制备:
甲: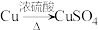 乙:
乙:
①写出甲方法反应的化学方程式:___________ 。
②甲和乙方法更合理的是___________ (填“甲”或“乙”),理由是___________ (答两点)。
(5)已知空气中SO2的最大允许排放浓度不得超过0.02 mg•L-1,可通过下列装置定量分析空气中SO2的含量。___________ mg•L-1(结果精确到0.001)。

(2)宋代著名法医学家宋慈的
 洗冤集录
洗冤集录 中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法
中有关于“银针验毒”的记载,银针主要用于检验是否有含硫元素的有毒物质。其反应原理之一为:Ag + X + O2 →Ag2S + H2O(反应未配平),已知:Ag2S为一种不溶于水的灰黑色固体。以下有关说法| A.当银针变黑时,说明所检验的物质中可能有毒 |
| B.银针验毒时,Ag被氧化 |
| C.X在上述验毒反应中作还原剂 |
| D.上述验毒反应中氧化剂和还原剂的物质的量之比为4∶1 |
(3)Y转化为Z可以选择下列试剂
A.酸性KMnO4溶液 B.FeCl2溶液 C.NaOH溶液 D.X的水溶液
写出你所选试剂将Y转化为Z的离子方程式
(4)若N是CuSO4,某同学设计了甲和乙两种方法制备:
甲:
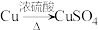 乙:
乙:
①写出甲方法反应的化学方程式:
②甲和乙方法更合理的是
(5)已知空气中SO2的最大允许排放浓度不得超过0.02 mg•L-1,可通过下列装置定量分析空气中SO2的含量。
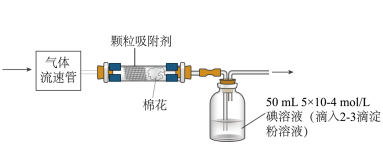
您最近一年使用:0次
2024-04-29更新
|
242次组卷
|
2卷引用:四川省南充高级中学2023-2024学年高一下学期3月月考化学试题
名校
7 . 铬铁渣是火法炼铬所产生的废渣,其中铬以低价态的 存在,主要杂质为铁、铝、硅的氧化物,从铬铁渣中提取铬的一种流程如图所示
存在,主要杂质为铁、铝、硅的氧化物,从铬铁渣中提取铬的一种流程如图所示 存在,在碱性介质中以
存在,在碱性介质中以 存在。下列说法错误的是
存在。下列说法错误的是
 存在,主要杂质为铁、铝、硅的氧化物,从铬铁渣中提取铬的一种流程如图所示
存在,主要杂质为铁、铝、硅的氧化物,从铬铁渣中提取铬的一种流程如图所示
 存在,在碱性介质中以
存在,在碱性介质中以 存在。下列说法错误的是
存在。下列说法错误的是A.焙烧后,含铬化合物主要以 存在 存在 |
| B.加水浸取过滤,滤渣1的主要成分应含有铁元素 |
| C.除铝步骤,为使杂质沉淀彻底,应加入足量稀硫酸 |
D.还原步骤发生的离子反应是: |
您最近一年使用:0次
2024-04-29更新
|
103次组卷
|
2卷引用:山东省烟台市龙口第一中学东校2023-2024学年高二下学期6月月考化学试题
名校
解题方法
8 . 碲( )是第ⅥA族元素,可用作合金材料的添加剂、催化剂等。一种利用含碲废料(主要成分是
)是第ⅥA族元素,可用作合金材料的添加剂、催化剂等。一种利用含碲废料(主要成分是 、
、 )制取粗碲、
)制取粗碲、 固体的工艺流程如图所示。
固体的工艺流程如图所示。 属于两性氧化物,难溶于水,易溶于强酸和强碱,分别生成
属于两性氧化物,难溶于水,易溶于强酸和强碱,分别生成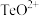 和
和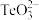 。
。
回答下列问题:
(1)“焙烧”过程在焙烧炉内完成,焙烧炉内壁材料可以为___________(填标号)。
(2)“焙烧”常采用逆流操作,即空气从焙烧炉下部通入,废料粉从上部加入,这样操作的目的是___________ ;“焙烧”时, 转化为
转化为 和
和 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(3)“调 ”时控制
”时控制 为
为 ,此时生成
,此时生成 的离子方程式为
的离子方程式为___________ ;加入硫酸的量不宜过多,其原因是___________ 。
(4)“还原”时,获得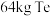 理论上需要标准状况下
理论上需要标准状况下 的体积为
的体积为___________  ;流程中可以循环利用的物质是
;流程中可以循环利用的物质是___________ (填化学式)。
(5)获得 固体“一系列操作”包含
固体“一系列操作”包含___________ 、过滤、洗涤、干燥。
 )是第ⅥA族元素,可用作合金材料的添加剂、催化剂等。一种利用含碲废料(主要成分是
)是第ⅥA族元素,可用作合金材料的添加剂、催化剂等。一种利用含碲废料(主要成分是 、
、 )制取粗碲、
)制取粗碲、 固体的工艺流程如图所示。
固体的工艺流程如图所示。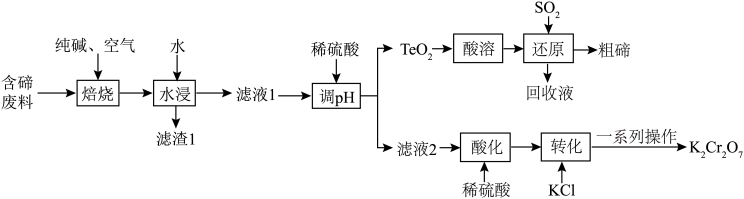
 属于两性氧化物,难溶于水,易溶于强酸和强碱,分别生成
属于两性氧化物,难溶于水,易溶于强酸和强碱,分别生成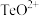 和
和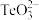 。
。回答下列问题:
(1)“焙烧”过程在焙烧炉内完成,焙烧炉内壁材料可以为___________(填标号)。
A. | B. | C. | D. |
(2)“焙烧”常采用逆流操作,即空气从焙烧炉下部通入,废料粉从上部加入,这样操作的目的是
 转化为
转化为 和
和 ,该反应的化学方程式为
,该反应的化学方程式为(3)“调
 ”时控制
”时控制 为
为 ,此时生成
,此时生成 的离子方程式为
的离子方程式为(4)“还原”时,获得
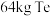 理论上需要标准状况下
理论上需要标准状况下 的体积为
的体积为 ;流程中可以循环利用的物质是
;流程中可以循环利用的物质是(5)获得
 固体“一系列操作”包含
固体“一系列操作”包含
您最近一年使用:0次
名校
9 . 含硫石油、煤、天然气的燃烧,硫化矿石的熔炼和焙烧,及各种含硫原料的加工生产过程等均能产生二氧化硫。
(1)画出硫原子的原子结构示意图_______ 。
(2)实验室常用亚硫酸钠固体和70%的浓硫酸反应制取二氧化硫,该反应的化学方程式_______ ;用该方法制备 时,能随时控制反应速率的装置是
时,能随时控制反应速率的装置是_______ (填标号),原因是_______ 。 的含量,某小组同学将空气样品经过管道通入盛有
的含量,某小组同学将空气样品经过管道通入盛有 酸性
酸性 溶液的密闭容器中,若管道中空气流量为
溶液的密闭容器中,若管道中空气流量为 ,经过
,经过 恰好使酸性
恰好使酸性 溶液完全褪色(假定样品中的
溶液完全褪色(假定样品中的 可被溶液充分吸收且样品中其他成分不与
可被溶液充分吸收且样品中其他成分不与 反应)。
反应)。
①写出上述反应的离子方程式_______ 。
②该空气样品中 的含量为
的含量为_______  。
。
(4)为了减少二氧化硫产生的危害,可以采取的措施是_______ 。
(1)画出硫原子的原子结构示意图
(2)实验室常用亚硫酸钠固体和70%的浓硫酸反应制取二氧化硫,该反应的化学方程式
 时,能随时控制反应速率的装置是
时,能随时控制反应速率的装置是A. B.
B. C.
C.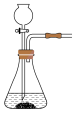 D.
D.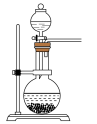
 的含量,某小组同学将空气样品经过管道通入盛有
的含量,某小组同学将空气样品经过管道通入盛有 酸性
酸性 溶液的密闭容器中,若管道中空气流量为
溶液的密闭容器中,若管道中空气流量为 ,经过
,经过 恰好使酸性
恰好使酸性 溶液完全褪色(假定样品中的
溶液完全褪色(假定样品中的 可被溶液充分吸收且样品中其他成分不与
可被溶液充分吸收且样品中其他成分不与 反应)。
反应)。①写出上述反应的离子方程式
②该空气样品中
 的含量为
的含量为 。
。(4)为了减少二氧化硫产生的危害,可以采取的措施是
您最近一年使用:0次
名校
解题方法
10 . 正钒酸(H3VO4)溶于水,其氧化性大于氯气,酸性条件下与乙二酸(H2C2O4)发生离子反应: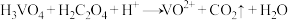 (未配平)。下列说法错误的是
(未配平)。下列说法错误的是
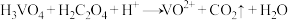 (未配平)。下列说法错误的是
(未配平)。下列说法错误的是A.该反应中,还原剂与氧化剂的物质的量之比为 |
B.每生成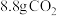 ,转移 ,转移 电子 电子 |
C.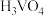 为强酸 为强酸 |
D.向正钒酸溶液中通入一定量的 ,溶液变浑浊 ,溶液变浑浊 |
您最近一年使用:0次



