锰在汽车电池、高端装备制造、新材料等领域有广泛应用。利用软锰矿(主要成分为 ,含
,含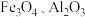 等杂质)和黄铁矿(主要成分为
等杂质)和黄铁矿(主要成分为 )联合制备绿矾和高纯
)联合制备绿矾和高纯 ,并用所得
,并用所得 制备
制备 的工艺流程如下:
的工艺流程如下: 如下:
如下:
回答下列问题:
(1)将软锰矿和黄铁矿“粉碎”,并用水调至糊状的目的是______ 。“浸渣”中除了含有不溶于酸的杂质外,还含有生成的单质 ,则“酸浸”时发生的主要反应的离子方程式为
,则“酸浸”时发生的主要反应的离子方程式为______ 。
(2)常温下, 的溶度积
的溶度积
______ 。“调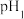 ”的范围为
”的范围为______ 。
(3)“沉锰”时,溶液的 、反应时间与
、反应时间与 的产率的关系如图1所示。“沉锰”时,应调节溶液的
的产率的关系如图1所示。“沉锰”时,应调节溶液的 为
为______ 。“沉锰”反应的离子方程式为______ 。______ 。
(5)“电解”制取金属锰的化学方程式为______ 。
(6)铜、钛和锰、铁都是第四周期的过渡元素。一种含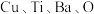 四元铜氧化物超导体晶体的晶胞结构如图2所示(晶胞参数为
四元铜氧化物超导体晶体的晶胞结构如图2所示(晶胞参数为 ),该晶体的密度为
),该晶体的密度为______  (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
 ,含
,含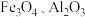 等杂质)和黄铁矿(主要成分为
等杂质)和黄铁矿(主要成分为 )联合制备绿矾和高纯
)联合制备绿矾和高纯 ,并用所得
,并用所得 制备
制备 的工艺流程如下:
的工艺流程如下: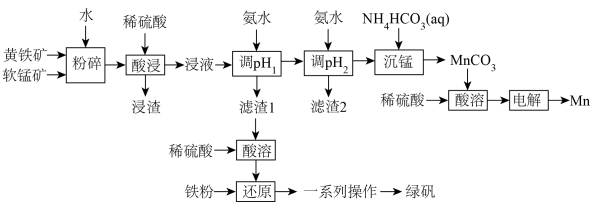
 如下:
如下:| 金属离子 |  |  |  |  |
| 开始沉淀的 | 8.1 | 6.3 | 1.5 | 3.4 |
沉淀完全 的 的 | 10.1 | 8.3 | 2.8 | 4.7 |
(1)将软锰矿和黄铁矿“粉碎”,并用水调至糊状的目的是
 ,则“酸浸”时发生的主要反应的离子方程式为
,则“酸浸”时发生的主要反应的离子方程式为(2)常温下,
 的溶度积
的溶度积
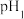 ”的范围为
”的范围为(3)“沉锰”时,溶液的
 、反应时间与
、反应时间与 的产率的关系如图1所示。“沉锰”时,应调节溶液的
的产率的关系如图1所示。“沉锰”时,应调节溶液的 为
为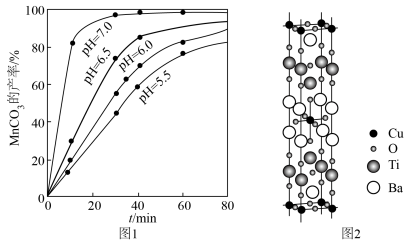
(5)“电解”制取金属锰的化学方程式为
(6)铜、钛和锰、铁都是第四周期的过渡元素。一种含
 四元铜氧化物超导体晶体的晶胞结构如图2所示(晶胞参数为
四元铜氧化物超导体晶体的晶胞结构如图2所示(晶胞参数为 ),该晶体的密度为
),该晶体的密度为 (列出计算式,阿伏加德罗常数的值为
(列出计算式,阿伏加德罗常数的值为 )。
)。
更新时间:2024-04-29 15:25:32
|
相似题推荐
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】湿法炼锌净化钴渣中含有Zn、Co、Cu和Fe的单质及Zn(OH)2,可利用过硫酸钠氧化水解法实现钴的富集,同时分别回收锌、铜和铁元素,工艺流程如下:
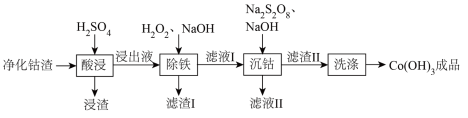
该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
回答下列问题:
(1)净化钴渣研细的目的是___________ 。
(2)浸渣的主要成分为________ (填名称),其对应元素原子的价电子排布式为_________ 。
(3)钴属于铁系元素,性质与铁相似。根据流程可知:Co2+的还原性___________ (填“强于”、“弱于”)Fe2+。
(4)利用上述表格数据,计算Co(OH)2的Ksp=___________ ;如果滤液I中Co2+浓度为0.1mol·L−1,则“除铁”应控制的pH范围是___________ 。
(5)氨水可代替沉钴工序中的NaOH,此时发生的主要反应的离子方程式为___________ 。
(6)上述流程中___________(填标号)可返回湿法炼锌系统,提高锌的利用率。
(7)Co(OH)3可与浓盐酸反应产生黄绿色气体,其化学方程式为___________ 。

该工艺条件下,有关金属离子开始沉淀和沉淀完全的pH见下表
| 金属离子 | Fe3+ | Fe2+ | Co2+ |
| 开始沉淀(c=0.01mol/L)的pH | 1.9 | 7.5 | 7.7 |
| 沉淀完全(c=1.0×10-5mol/L)的pH | 3.2 | 9.0 | 9.2 |
(1)净化钴渣研细的目的是
(2)浸渣的主要成分为
(3)钴属于铁系元素,性质与铁相似。根据流程可知:Co2+的还原性
(4)利用上述表格数据,计算Co(OH)2的Ksp=
(5)氨水可代替沉钴工序中的NaOH,此时发生的主要反应的离子方程式为
(6)上述流程中___________(填标号)可返回湿法炼锌系统,提高锌的利用率。
| A.浸渣 | B.滤渣I | C.滤液Ⅱ | D.滤渣Ⅱ |
您最近一年使用:0次
【推荐2】某小组同学探究不同条件下氯气与二价锰化合物的反应
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
ii.浓碱条件下, 可被OH-还原为
可被OH-还原为 。
。
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)
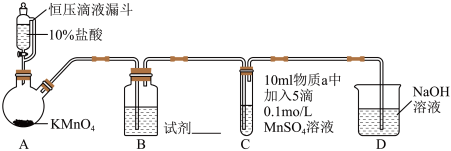
(1)实验室中利用MnO2和浓盐酸加热的反应来制取氯气,对比本实验A中的反应,说明氧化性MnO2_______ KMnO4(填“>”或“<”)。
(2)B中试剂是_______ 。(填序号)
①浓硫酸 ②饱和食盐水
(3)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色[Mn(OH)2]变为棕黑色,补全发生反应的化学方程式:___________ 。
Mn(OH)2+_______=________+H2O
(4)对比实验I、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是:
①__________ ;
②在碱性条件下可以被氧化到更高价态。
(5)根据资料ii,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①用化学方程式表示可能导致溶液碱性减弱的原因___________ ,但通过实验测定,溶液的碱性变化很小。
②针对原因二小组同学做如下探究:
Ⅳ中溶液紫色迅速变为绿色的离子方程式为_________ 。
 +OH-=
+OH-= +___________+___________。
+___________+___________。
资料:i.Mn2+在一定条件下被Cl2或ClO-氧化成MnO2(棕黑色)、
 (绿色)、
(绿色)、 (紫色)。
(紫色)。ii.浓碱条件下,
 可被OH-还原为
可被OH-还原为 。
。iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略)

| 序号 | I | Ⅱ | Ⅲ |
| 物质a | 水 | 5%NaOH溶液 | 40%NaOH溶液 |
| 通入Cl2前 C中实验现象 | 得到无色溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 |
| 通入Cl2后 C中实验现象 | 产生棕黑色沉淀,且放置后不发生变化 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(1)实验室中利用MnO2和浓盐酸加热的反应来制取氯气,对比本实验A中的反应,说明氧化性MnO2
(2)B中试剂是
①浓硫酸 ②饱和食盐水
(3)通入Cl2前,Ⅱ、Ⅲ中沉淀由白色[Mn(OH)2]变为棕黑色,补全发生反应的化学方程式:
Mn(OH)2+_______=________+H2O
(4)对比实验I、Ⅱ通入Cl2后的实验现象,对于二价锰化合物还原性的认识是:
①
②在碱性条件下可以被氧化到更高价态。
(5)根据资料ii,Ⅲ中应得到绿色溶液,实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①用化学方程式表示可能导致溶液碱性减弱的原因
②针对原因二小组同学做如下探究:
| 序号 | Ⅳ | Ⅴ |
| 操作 | 取Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液 | 取Ⅲ中放置后的1mL悬浊液,加入4mL水, |
| 现象 | 溶液紫色迅速变为绿色,且绿色缓慢加深 | 溶液紫色缓慢加深 |
 +OH-=
+OH-= +___________+___________。
+___________+___________。
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐3】砷为VA族元素,金属冶炼过程产生的含砷有毒废弃物需处理与检测。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:
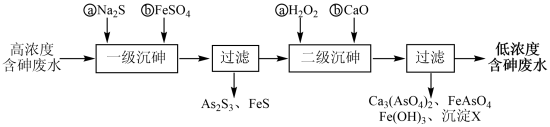
已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) 2 AsS
2 AsS (aq);
(aq);
②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为_______ ;砷酸的第一步电离方程式为_______ 。
(2)“一级沉砷”中FeSO4的作用是_______ ;“二级沉砷”中H2O2与含砷物质反应的化学方程式为_______ 。
(3)沉淀X为_______ (填化学式)。
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为_______ .
(5)步骤2的离子方程式为_______ 。
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,则该排放的废渣中砷元素的含量_______ (填“符合”、“不符合”)排放标准。
I.冶炼废水中砷元素主要以亚砷酸(H3AsO3)形式存在,可用化学沉降法处理酸性高浓度含砷废水,其工艺流程如下:

已知:①As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq)
 2 AsS
2 AsS (aq);
(aq);②亚砷酸盐的溶解性大于相应砷酸盐。
(1)亚砷酸中砷元素的化合价为
(2)“一级沉砷”中FeSO4的作用是
(3)沉淀X为
Ⅱ.冶炼废渣中的砷元素主要以As2S3的形式存在,可用古氏试砷法半定量检测(As的最低检出限为3.0×10-6g)。
步骤1:取10g废渣样品,粉碎后与锌粉混合,加入H2SO4共热,生成AsH3气体。
步骤2:将AsH3气体通入AgNO3溶液中,生成银镜和As2O3。
步骤3:取1g废渣样品,重复上述实验,未见银镜生成。
(4)AsH3的电子式为
(5)步骤2的离子方程式为
(6)固体废弃物的排放标准中,砷元素不得高于4.0×10-5g·kg-1,则该排放的废渣中砷元素的含量
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
解题方法
【推荐1】工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁[Fe(OH)SO4]的工艺流程如下:
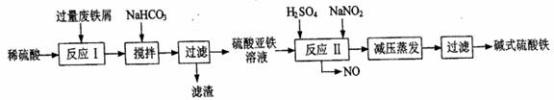
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:
回答下列问题:
(1)加入过量废铁屑的目的是________________________ (用离子方程式表示);加入少量NaHCO3的目的是________________________ ;该工艺中“搅拌”的作用是________________________ ;
(2)反应Ⅱ中的离子方程式为__________ ;该流程中可以循环、回收利用的物质是________ ;
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是________ ;
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-;为检验所得产品中是否含有Fe2+,应使用的试剂为______ 。(填写字母)

已知:部分阳离子以氢氧化物形式沉淀时溶液的pH如下表:

回答下列问题:
(1)加入过量废铁屑的目的是
(2)反应Ⅱ中的离子方程式为
(3)生产中碱式硫酸铁溶液蒸发时需要在减压条件下的原因是
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO3-;为检验所得产品中是否含有Fe2+,应使用的试剂为
| A.酸性KMnO4溶液 | B.KSCN溶液 | C.氯水 | D.NaOH溶液 |
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐2】聚合硫酸铁[ ,Fe为+3价]是高效水处理剂。实验室用某冶金厂的废渣(主要成分为
,Fe为+3价]是高效水处理剂。实验室用某冶金厂的废渣(主要成分为 、
、 和少量
和少量 )制备聚合硫酸铁的流程如下:
)制备聚合硫酸铁的流程如下:
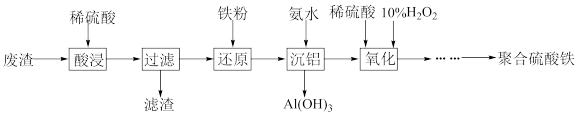
请回答下列问题:
(1)基态 核外电子排布式为
核外电子排布式为_______ ,“酸浸”时 与稀硫酸反应的化学方程式为
与稀硫酸反应的化学方程式为_______ 。
(2)“还原”后,检验溶液中是否还存在 的的试剂是
的的试剂是_______ 。
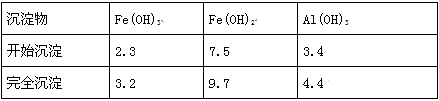
(3)不同金属离子生成氢氧化物开始沉淀和完全沉淀时的pH如下表所示:
①沉铝时应控制溶液pH的范围是_______ 。
②写出沉铝时反应的离子方程式:_______ 。
(4)聚合硫酸铁[ ]的组成可通过下列实验测定:
]的组成可通过下列实验测定:
①称取一定质量的聚合硫酸铁溶于稀盐酸中,向所得溶液中滴加 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体23.30g;
溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体23.30g;
②另称取与①等质量的聚合硫酸铁溶于稀硫酸中,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并,用0.500mol/L的 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液32.00mL。该步反应为:
溶液32.00mL。该步反应为: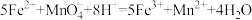 。
。
通过计算确定该聚合硫酸铁的化学式_______ (请写出计算过程)。
 ,Fe为+3价]是高效水处理剂。实验室用某冶金厂的废渣(主要成分为
,Fe为+3价]是高效水处理剂。实验室用某冶金厂的废渣(主要成分为 、
、 和少量
和少量 )制备聚合硫酸铁的流程如下:
)制备聚合硫酸铁的流程如下:
请回答下列问题:
(1)基态
 核外电子排布式为
核外电子排布式为 与稀硫酸反应的化学方程式为
与稀硫酸反应的化学方程式为(2)“还原”后,检验溶液中是否还存在
 的的试剂是
的的试剂是(3)不同金属离子生成氢氧化物开始沉淀和完全沉淀时的pH如下表所示:
| 金属阳离子 |  |  |  |
| 开始沉淀时的pH | 6.5 | 1.5 | 3.3 |
| 完全沉淀时的pH | 9.7 | 3.2 | 5.2 |
②写出沉铝时反应的离子方程式:
(4)聚合硫酸铁[
 ]的组成可通过下列实验测定:
]的组成可通过下列实验测定:①称取一定质量的聚合硫酸铁溶于稀盐酸中,向所得溶液中滴加
 溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体23.30g;
溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体23.30g;②另称取与①等质量的聚合硫酸铁溶于稀硫酸中,加入足量铜粉,充分反应后过滤、洗涤,将滤液和洗液合并,用0.500mol/L的
 溶液滴定至终点,消耗
溶液滴定至终点,消耗 溶液32.00mL。该步反应为:
溶液32.00mL。该步反应为: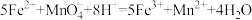 。
。通过计算确定该聚合硫酸铁的化学式
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
解题方法
【推荐3】磁选后的炼铁高钛炉渣,主要成分有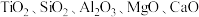 以及少量的
以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
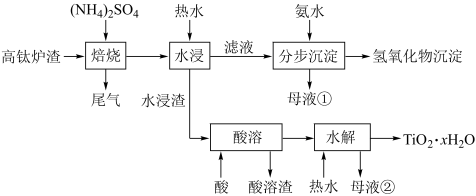
该工艺条件下,有关金属离子开始沉淀和沉淀完全的 见下表,回答下列问题:
见下表,回答下列问题:
(1)“焙烧”中,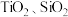 几乎不发生反应,
几乎不发生反应,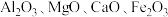 转化为相应的硫酸盐,
转化为相应的硫酸盐, 转化为
转化为 ,写出向
,写出向 中加入过量氨水的离子方程式:
中加入过量氨水的离子方程式:_______ 。
(2)“水浸”后滤液的 约为2.0,在“分步沉淀时用氨水逐步调节
约为2.0,在“分步沉淀时用氨水逐步调节 至11.6,最先析出的金属离子是
至11.6,最先析出的金属离子是_______ 。(填写离子符号)
(3)“母液①”中 浓度为
浓度为_______  。
。
(4)“水浸渣”在 “酸溶”最适合的酸是
“酸溶”最适合的酸是_______ 。“酸溶渣”的成分是_______ 、_______ 。
(5)“酸溶”后,将溶液适当稀释并加热, 水解析出
水解析出 沉淀,该反应的离子方程式是:
沉淀,该反应的离子方程式是:_______ 。
(6)将“母液①”和“母液②”混合,吸收尾气,经处理得_______ ,循环利用。
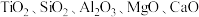 以及少量的
以及少量的 。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
。为节约和充分利用资源,通过如下工艺流程回收钛、铝、镁等。
该工艺条件下,有关金属离子开始沉淀和沉淀完全的
 见下表,回答下列问题:
见下表,回答下列问题:| 金属离子 |  |  |  |  |
开始沉淀的 | 2.2 | 3.5 | 9.5 | 12.4 |
沉淀完全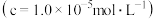 的 的 | 3.2 | 4.7 | 11.1 | 13.8 |
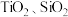 几乎不发生反应,
几乎不发生反应,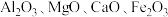 转化为相应的硫酸盐,
转化为相应的硫酸盐, 转化为
转化为 ,写出向
,写出向 中加入过量氨水的离子方程式:
中加入过量氨水的离子方程式:(2)“水浸”后滤液的
 约为2.0,在“分步沉淀时用氨水逐步调节
约为2.0,在“分步沉淀时用氨水逐步调节 至11.6,最先析出的金属离子是
至11.6,最先析出的金属离子是(3)“母液①”中
 浓度为
浓度为 。
。(4)“水浸渣”在
 “酸溶”最适合的酸是
“酸溶”最适合的酸是(5)“酸溶”后,将溶液适当稀释并加热,
 水解析出
水解析出 沉淀,该反应的离子方程式是:
沉淀,该反应的离子方程式是:(6)将“母液①”和“母液②”混合,吸收尾气,经处理得
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐1】钛硅分子筛是一种新型固体催化剂,可催化合成重要有机合成活性试剂甲乙酮肟(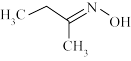 )。回答下列问题:
)。回答下列问题:
(1)基态硅原子的核外电子空间运动状态有____ 种。
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为____ ,氮原子的杂化方式为____ ,C=N与C—C键夹角____ (填“<”“>”或“=”)C=N与N—O键夹角。
(3)TiO2和TiCl4均是制备钛硅分子筛的重要中间体。
①TiO2与光气COCl2反应可用于制取四氯化钛。COCl2中σ键和π键的数目比为____ ,其空间构型为____ 。
②TiCl4与金属Ti在高温条件下可反应生成TiCl3,TiCl3中Ti3+极易被氧化,还原性很强。试解释Ti3+还原性强的原因____ 。
(4)研究表明,在TiO2通过氮掺杂反应生成TiO2-mNn,能使TiO2对可见光具有活性,反应如图所示。

若TiO2晶体密度为ρg·cm-3,则阿伏加德罗常数的值NA=____ ,TiO2-mNn晶体中m=____ 。
 )。回答下列问题:
)。回答下列问题:(1)基态硅原子的核外电子空间运动状态有
(2)甲乙酮肟中同周期三种元素电负性由大到小的顺序为
(3)TiO2和TiCl4均是制备钛硅分子筛的重要中间体。
①TiO2与光气COCl2反应可用于制取四氯化钛。COCl2中σ键和π键的数目比为
②TiCl4与金属Ti在高温条件下可反应生成TiCl3,TiCl3中Ti3+极易被氧化,还原性很强。试解释Ti3+还原性强的原因
(4)研究表明,在TiO2通过氮掺杂反应生成TiO2-mNn,能使TiO2对可见光具有活性,反应如图所示。

若TiO2晶体密度为ρg·cm-3,则阿伏加德罗常数的值NA=
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
【推荐2】(1)基态Co原子的电子排布式为_______ 。
(2)BF3与一定量的水形成(H2O)2•BF3晶体Q,Q在一定条件下可转化为R:
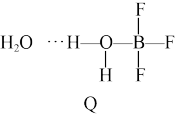
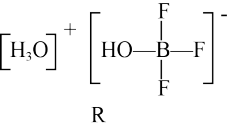
晶体Q中各种微粒间的作用力不涉及_______ (填序号)。
a.离子键 b.共价键 c. 配位键 d.金属键
(3)NaF和NaCl属于同一主族的钠盐,但NaF的硬度比NaCl大,原因是_______ 。
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为_______ 。
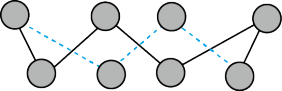
(5)第一电离能介于B、N之间的第二周期元素有_______ 种。S单质的常见形式为S8,其环状结构如图所示,该分子中S原子采用的轨道杂化方式是_______ 。
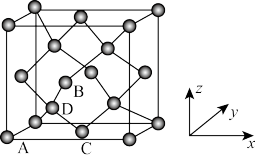
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,图为金刚石的晶胞,其中原子坐标参数A为(0,0,0);B为( ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子坐标参数为
,0)。则D原子坐标参数为_______ 。②晶胞参数,描述晶胞的大小和形状,已知金刚石的晶胞参数a=356.89pm,其密度为_______ g•cm-3。(列出计算式即可,不必计算出结果)
(2)BF3与一定量的水形成(H2O)2•BF3晶体Q,Q在一定条件下可转化为R:


晶体Q中各种微粒间的作用力不涉及
a.离子键 b.共价键 c. 配位键 d.金属键
(3)NaF和NaCl属于同一主族的钠盐,但NaF的硬度比NaCl大,原因是
(4)向CuSO4溶液中加入过量NaOH溶液可生成[Cu(OH)4]2-。不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为
(5)第一电离能介于B、N之间的第二周期元素有

(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,图为金刚石的晶胞,其中原子坐标参数A为(0,0,0);B为(
 ,0,
,0, );C为(
);C为( ,
, ,0)。则D原子坐标参数为
,0)。则D原子坐标参数为
您最近一年使用:0次
解答题-结构与性质
|
较难
(0.4)
名校
解题方法
【推荐3】开发高效储氢材料是重要的研究方向。回答下列问题:
(1)最新研究发现,在镍的表面覆盖石墨烯,可大大增加储氢材料释放氢气的速率。石墨烯是单层碳原子组成的平面结构,具有良好的导电、导热性。
①基态 原子的电子排布式为
原子的电子排布式为___________ 。
②石墨烯中碳碳键长___________ 乙烯中碳碳键长(填“>”“<”或“=”。)
③下列反应常用来检验,请补全方程式:_______ 
___________  (填“>”“<”或“=”)。
(填“>”“<”或“=”)。
(2)镧(La)和氢原子可以形成一系列储氢晶体材料 ,
,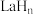 属于立方晶系,La原子作面心立方堆积。La晶体吸附,形成
属于立方晶系,La原子作面心立方堆积。La晶体吸附,形成 ,
, 晶胞中H填充在La原子的正四面体空隙中,晶胞沿体对角线的投影如图①所示。高压下,
晶胞中H填充在La原子的正四面体空隙中,晶胞沿体对角线的投影如图①所示。高压下, 中每个H再结合4个H构成小正四面体结构形成,其晶胞从各个面的投影均如图②所示。
中每个H再结合4个H构成小正四面体结构形成,其晶胞从各个面的投影均如图②所示。 晶胞中La原子的分数坐标有
晶胞中La原子的分数坐标有___________ 种,晶胞中La原子个数与正四面体空隙数之比为___________ ,H原子的配位数为___________ 。
②高压下, 吸附
吸附 得到晶体
得到晶体 的反应式为
的反应式为___________ (x用数字表示)。若 晶胞棱长为apm,La原子与最近的氢原子的距离为bpm,则
晶胞棱长为apm,La原子与最近的氢原子的距离为bpm,则 晶胞中每个小正四面体内H-H的最短距离为
晶胞中每个小正四面体内H-H的最短距离为___________ pm(用含a和b的式子表示)。
(1)最新研究发现,在镍的表面覆盖石墨烯,可大大增加储氢材料释放氢气的速率。石墨烯是单层碳原子组成的平面结构,具有良好的导电、导热性。
①基态
 原子的电子排布式为
原子的电子排布式为②石墨烯中碳碳键长
③下列反应常用来检验,请补全方程式:
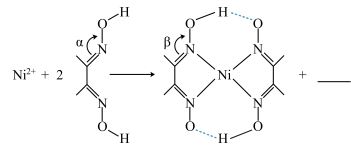

 (填“>”“<”或“=”)。
(填“>”“<”或“=”)。(2)镧(La)和氢原子可以形成一系列储氢晶体材料
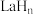 ,
,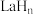 属于立方晶系,La原子作面心立方堆积。La晶体吸附,形成
属于立方晶系,La原子作面心立方堆积。La晶体吸附,形成 ,
, 晶胞中H填充在La原子的正四面体空隙中,晶胞沿体对角线的投影如图①所示。高压下,
晶胞中H填充在La原子的正四面体空隙中,晶胞沿体对角线的投影如图①所示。高压下, 中每个H再结合4个H构成小正四面体结构形成,其晶胞从各个面的投影均如图②所示。
中每个H再结合4个H构成小正四面体结构形成,其晶胞从各个面的投影均如图②所示。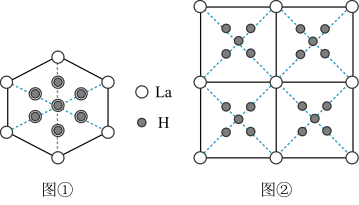
 晶胞中La原子的分数坐标有
晶胞中La原子的分数坐标有②高压下,
 吸附
吸附 得到晶体
得到晶体 的反应式为
的反应式为 晶胞棱长为apm,La原子与最近的氢原子的距离为bpm,则
晶胞棱长为apm,La原子与最近的氢原子的距离为bpm,则 晶胞中每个小正四面体内H-H的最短距离为
晶胞中每个小正四面体内H-H的最短距离为
您最近一年使用:0次
解答题-工业流程题
|
较难
(0.4)
名校
【推荐1】CIGS靶材是一种主要含铜、镓(Ga)、铟(In)、硒(Se)的合金,由于其良好的电学传导和光学透明性能,被广泛运用在薄膜太阳能电池领域。实验室设计从废弃CIGS中回收稀散金属铟和镓的氯化物(性质类似于AlCl3)的流程图:
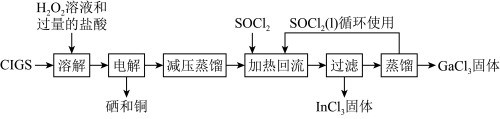
已知:Ⅰ.“溶解”步骤所得溶液中含有 、
、 、
、 和H2SeO3。
和H2SeO3。
Ⅱ.“减压蒸馏”步骤中得到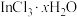 和
和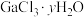 固体混合物。
固体混合物。
回答下列问题:
(1)镓位于元素周期表第四周期ⅢA族,则其原子结构示意图为___________ 。
(2)“溶解”过程中生成 的离子方程式为
的离子方程式为___________ 和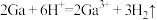 ;溶解温度控制在30℃左右,温度不宜过高的原因是
;溶解温度控制在30℃左右,温度不宜过高的原因是___________ 。利用王水也能溶解CIGS,试分析以王水(浓HNO3和浓HCl体积比1∶3的混合物)代替HCl和H2O2的缺点是___________ (答出一点即可)。
(3)SOCl2与水反应,液面上有白雾形成,并生成一种能使品红溶液褪色的气体,SOCl2与水反应的方程式为:___________ ,则“加热回流”步骤中加入SOCl2的目的除了脱水外,还有___________ 。
(4)写出 离子的电子排布式
离子的电子排布式___________ ,写出Se的价电子排布式___________ 。

已知:Ⅰ.“溶解”步骤所得溶液中含有
 、
、 、
、 和H2SeO3。
和H2SeO3。Ⅱ.“减压蒸馏”步骤中得到
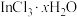 和
和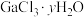 固体混合物。
固体混合物。回答下列问题:
(1)镓位于元素周期表第四周期ⅢA族,则其原子结构示意图为
(2)“溶解”过程中生成
 的离子方程式为
的离子方程式为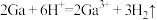 ;溶解温度控制在30℃左右,温度不宜过高的原因是
;溶解温度控制在30℃左右,温度不宜过高的原因是(3)SOCl2与水反应,液面上有白雾形成,并生成一种能使品红溶液褪色的气体,SOCl2与水反应的方程式为:
(4)写出
 离子的电子排布式
离子的电子排布式
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
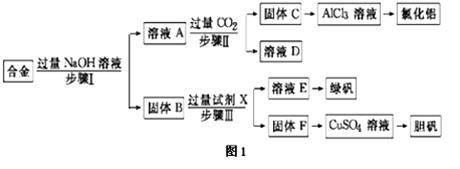
【推荐2】某工厂的废金属屑的主要成分为铝、铁和铜,某化学兴趣小组在学习了元素及其化合物的相关知识后,设计了如图1实验流程,用该工厂的金属废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体(CuSO4·5H2O)。
请回答:
(1)写出步骤Ⅱ反应的离子方程式:________________ 。
(2)步骤Ⅰ、Ⅱ、Ⅲ进行的实验操作中均需用到的玻璃仪有________________ 。
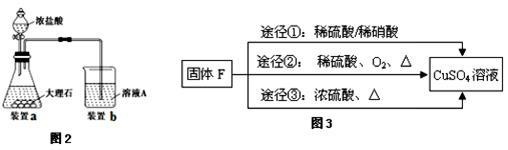
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂制取CO2并将制得的气体通入溶液A中一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,原因是_________________ 。
(4)从溶液E得到绿矾晶体的实验操作是___________ 、___________ 过滤。
(5)用固体F制备CuSO4溶液,可设计如图3三种途径:
写出途径③中反应的化学方程式:_________________ ,用途径①制备CuSO4溶液时,混酸中硫酸和硝酸的最佳物质的量之比为_________ 。
(6)用惰性电极电解硫酸铜溶液一段时间后,阴极增重3.2g。阳极产生________ L气体(标准状况)。


请回答:
(1)写出步骤Ⅱ反应的离子方程式:
(2)步骤Ⅰ、Ⅱ、Ⅲ进行的实验操作中均需用到的玻璃仪有
(3)进行步骤Ⅱ时,该小组用如图2所示装置及试剂制取CO2并将制得的气体通入溶液A中一段时间后,观察到烧杯中产生的白色沉淀会逐渐减少,原因是
(4)从溶液E得到绿矾晶体的实验操作是
(5)用固体F制备CuSO4溶液,可设计如图3三种途径:
写出途径③中反应的化学方程式:
(6)用惰性电极电解硫酸铜溶液一段时间后,阴极增重3.2g。阳极产生
您最近一年使用:0次
解答题-实验探究题
|
较难
(0.4)
名校
解题方法
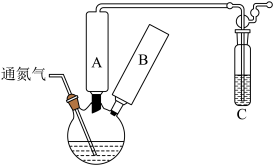
【推荐3】醋酸钴与双水杨醛缩乙二胺形成的配合物 具有可逆载氧能力,能模拟金属蛋白的载氧作用,在催化氧化反应中应用广泛,合成反应如图。回答下列问题:
具有可逆载氧能力,能模拟金属蛋白的载氧作用,在催化氧化反应中应用广泛,合成反应如图。回答下列问题:___________ (填名称,下同),B处应安装的仪器是___________ ;装置C的作用是___________ ,通氮气的目的是___________ 。
(2)回流 ,沉淀转化为暗红色晶体。回流结束后进行如下操作:
,沉淀转化为暗红色晶体。回流结束后进行如下操作:
①停止通氮气 ②停止加热 ③关闭冷凝水
正确的操作顺序为___________ (填标号)。充分冷却后将溶液过滤,洗涤并干燥,得到配合物 。
。
(3)测定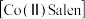 的载氧能力。将
的载氧能力。将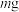 的
的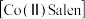 (相对分子质量为
(相对分子质量为 )加入圆底烧瓶中,在恒压漏斗中加入
)加入圆底烧瓶中,在恒压漏斗中加入 (配合物在
(配合物在 中可吸氧),如图搭建装置。
中可吸氧),如图搭建装置。___________ ,然后调节水平仪的水位至与量气管水位产生一定液面差。装置不漏气的现象是___________ 。
②调整水平仪高度,待___________ (填现象)时,记录量气管水位的体积刻度为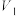 。将
。将 加入圆底烧瓶,待吸氧反应结束并规范操作后,记录量气管水位的体积刻度为
加入圆底烧瓶,待吸氧反应结束并规范操作后,记录量气管水位的体积刻度为 。已知大气压为
。已知大气压为 ,氧气的压强为
,氧气的压强为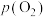 ,温度为
,温度为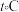 。配合物载氧量的
。配合物载氧量的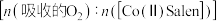 计算式为
计算式为___________ 。
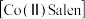 具有可逆载氧能力,能模拟金属蛋白的载氧作用,在催化氧化反应中应用广泛,合成反应如图。回答下列问题:
具有可逆载氧能力,能模拟金属蛋白的载氧作用,在催化氧化反应中应用广泛,合成反应如图。回答下列问题:
(2)回流
 ,沉淀转化为暗红色晶体。回流结束后进行如下操作:
,沉淀转化为暗红色晶体。回流结束后进行如下操作:①停止通氮气 ②停止加热 ③关闭冷凝水
正确的操作顺序为
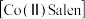 。
。(3)测定
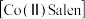 的载氧能力。将
的载氧能力。将 的
的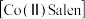 (相对分子质量为
(相对分子质量为 )加入圆底烧瓶中,在恒压漏斗中加入
)加入圆底烧瓶中,在恒压漏斗中加入 (配合物在
(配合物在 中可吸氧),如图搭建装置。
中可吸氧),如图搭建装置。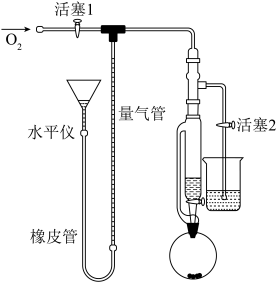
②调整水平仪高度,待
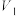 。将
。将 加入圆底烧瓶,待吸氧反应结束并规范操作后,记录量气管水位的体积刻度为
加入圆底烧瓶,待吸氧反应结束并规范操作后,记录量气管水位的体积刻度为 。已知大气压为
。已知大气压为 ,氧气的压强为
,氧气的压强为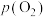 ,温度为
,温度为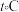 。配合物载氧量的
。配合物载氧量的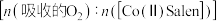 计算式为
计算式为
您最近一年使用:0次



