解题方法
1 . 铁和铝是两种重要的金属,它们的单质及其化合物有着各自的性质。
(1)现配制100mL 0.01mol∙L-1 FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要____________________ 。
(2)将FeCl3溶液滴入沸水可得到红褐色液体,反应的离子方程式是______________ 。此液体具有的性质是 _______ (填写序号字母)。
a.光束通过该液体时形成光亮的“通路”
b. 将该液体进行过滤,可得到红褐色固体
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)在隔绝空气的条件下,用镁条引燃Fe3O4粉末和铝粉的均匀混合物,使其充分反应。向充分反应后的剩余固体中加入足量的NaOH溶液,有大量气泡产生,所得剩余固体中除铁外还含有的固体物质是_________ (填化学式)。写出以上过程中涉及到的化学反应方程式,如果是离子反应,用离子反应方程式表示_________ 。
(4)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为______________________ 。
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:
______ Cu2S+______ Fe3++____ H2O
_____ Cu2++______ Fe2++______ ( ) +______ SO42- 。
(5)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是_____________________ 。
(1)现配制100mL 0.01mol∙L-1 FeCl3溶液,配制过程中需要的玻璃仪器除量筒、胶头滴管、烧杯外,还需要
(2)将FeCl3溶液滴入沸水可得到红褐色液体,反应的离子方程式是
a.光束通过该液体时形成光亮的“通路”
b. 将该液体进行过滤,可得到红褐色固体
c.向该液体中加入硝酸银溶液,无沉淀产生
d.将该液体加热、蒸干、灼烧后,有氧化物生成
(3)在隔绝空气的条件下,用镁条引燃Fe3O4粉末和铝粉的均匀混合物,使其充分反应。向充分反应后的剩余固体中加入足量的NaOH溶液,有大量气泡产生,所得剩余固体中除铁外还含有的固体物质是
(4)“细菌冶金”是利用某些细菌的特殊代谢功能开采金属矿石,例如溶液中氧化亚铁硫杆菌能利用空气中的氧气将黄铁矿(主要成分FeS2)氧化为Fe2(SO4)3,并使溶液酸性增强。
①该过程反应的化学方程式为
②人们可利用Fe2(SO4)3作强氧化剂溶解铜矿石(Cu2S),然后加入铁屑进一步得到铜,该过程中发生的离子反应方程式如下,请补充完整并配平:

(5)羟胺(NH2OH)是一种还原剂,用25.00 mL 0.049 mol/L羟胺的酸性溶液跟足量的硫酸铁溶液在煮沸条件下反应,生成的Fe2+离子恰好与24.5 mL 0.020 mol/L的KMnO4酸性溶液反应。则在上述反应中,羟胺的氧化产物是
您最近一年使用:0次
2016-12-09更新
|
813次组卷
|
2卷引用:2016届山东省邹城市第一中学高三上学期10月月考化学试卷
2 . Ⅰ.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究。向A中通入氯气至过量,观察A中,发现溶液先呈红色,然后变为黄色。
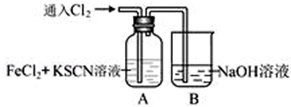
(1)B中反应的离子方程式是.
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在________.
(3)资料显示:SCN -的电子式为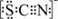 .甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究.
①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是.
②甲同学通过实验证明了SCN―中氮元素转化为NO3―,已知SCN―中碳元素没有被氧化,若SCN―与Cl2反应生成1mol CO2,则转移电子的物质的量是mol.
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄漏的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1) 写出NaCN的电子式__________,偏碱性条件下,氰化钠溶液的CN―被双氧水氧化为HCO3―,同时放出NH3,该反应的离子方程式:________。
(2)Cu2+可作为双氧水氧化CN―中的催化剂。某兴趣小组要探究Cu2+对双氧水氧化CN―是否起催化作用,请你完成下实验方案。填写实验步骤、实验现象和结论(已知:CN―浓度可用离子色谱仪测定)

(1)B中反应的离子方程式是.
(2)为了探究A中溶液由红色变为黄色的原因,甲同学进行如下实验.取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在________.
(3)资料显示:SCN -的电子式为
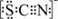 .甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究.
.甲同学猜想SCN―可能被Cl2氧化了,他进行了如下研究.①取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液, 产生白色沉淀,由此证明SCN―中被氧化的元素是.
②甲同学通过实验证明了SCN―中氮元素转化为NO3―,已知SCN―中碳元素没有被氧化,若SCN―与Cl2反应生成1mol CO2,则转移电子的物质的量是mol.
Ⅱ.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒。有少量因爆炸冲击发生泄漏。这些泄漏的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染。
(1) 写出NaCN的电子式__________,偏碱性条件下,氰化钠溶液的CN―被双氧水氧化为HCO3―,同时放出NH3,该反应的离子方程式:________。
(2)Cu2+可作为双氧水氧化CN―中的催化剂。某兴趣小组要探究Cu2+对双氧水氧化CN―是否起催化作用,请你完成下实验方案。填写实验步骤、实验现象和结论(已知:CN―浓度可用离子色谱仪测定)
| 步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,________________________________ ___________________________________________ ___________________________________________ __________________________________________ | 现象与结论: 若____________________________ _______________________________ 若____________________________ _______________________________ |
您最近一年使用:0次
2016-12-09更新
|
427次组卷
|
2卷引用:2016届广东省广州六中等六校高三第一次联考化学试卷
3 . CrO3主要用于电镀工业,做自行车、仪表等日用五金电镀铬的原料。CrO3具有强氧化性,热稳定性较差,加热时逐步分解,其固体残留率随温度的变化如图所示。

请回答下列问题:
(1)B点时剩余固体的化学式是____________ 。
(2)加热至A点时反应的化学方程式为______________________________ 。
(3)CrO3具有两性,写出CrO3溶解予KOH溶液的反应化学方程式____________________ 。
(4)三氧化铬还用于交警的酒精测试仪,以检查司机是否酒后驾车。若反应后红色的CrO3变为绿色的Cr2(SO4)3,酒精被完全氧化为CO2,则其离子方程式为_______________ 。
(5)由于CrO3和K2Cr2O7均易溶于水,所以电镀废水的排放是造成铬污染的主要原因。某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图:
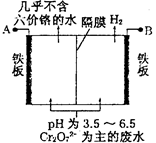
①A为电源___________ 极,阳极区溶液中发生的氧化还原反应为________________________ 。
②已知电解后阳极区溶液中c(Fe3+)为2.0×10-13 mol·L-1,则c(Cr3+)为__________ mol·L-1。{已知Ksp[Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31}

请回答下列问题:
(1)B点时剩余固体的化学式是
(2)加热至A点时反应的化学方程式为
(3)CrO3具有两性,写出CrO3溶解予KOH溶液的反应化学方程式
(4)三氧化铬还用于交警的酒精测试仪,以检查司机是否酒后驾车。若反应后红色的CrO3变为绿色的Cr2(SO4)3,酒精被完全氧化为CO2,则其离子方程式为
(5)由于CrO3和K2Cr2O7均易溶于水,所以电镀废水的排放是造成铬污染的主要原因。某工厂采用电解法处理含铬废水,耐酸电解槽用铁板作阴、阳极,槽中盛放含铬废水,原理示意图如图:

①A为电源
②已知电解后阳极区溶液中c(Fe3+)为2.0×10-13 mol·L-1,则c(Cr3+)为
您最近一年使用:0次
4 . 111
Ⅰ.已知向含有淀粉的10mL 0.2mol/L KIO3酸性溶液滴加0.3mol/LNaHSO3溶液的过程中,溶液的颜色先变蓝色,然后褪色,发生的离子反应如下:
①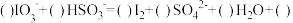 ;
;
②I2+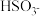 +H2O=2I-+SO
+H2O=2I-+SO +3H+
+3H+
回答下列问题:
(1)写出①反应的离子反应方程式____________________ .
(2)根据①②反应写出还原性粒子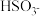 ,I2,I-由强到弱的顺序
,I2,I-由强到弱的顺序____________ .
(3)溶液刚好褪色时,则消耗的NaHSO3溶液的体积为__________________ .
(4)预测已知向含有淀粉的NaHSO3溶液滴加KIO3溶液的现象_________________ .
Ⅱ.在密闭容器中,将碳酸氢钠和过氧化钠的混合粉未加热至250℃,使其充分反应最后测得残余固体中两种化合物的组成分别为amol和bmol,且a>b,试回答下列问题
(5)反应后中固体的成分及其物质的量是:_______________
(6)原混合物中碳酸氢钠和过氧化钠的物质的量分别为:_______________
(7)反应后容器气态物质成分及其物质的量是:_______________
Ⅰ.已知向含有淀粉的10mL 0.2mol/L KIO3酸性溶液滴加0.3mol/LNaHSO3溶液的过程中,溶液的颜色先变蓝色,然后褪色,发生的离子反应如下:
①
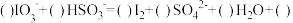 ;
;②I2+
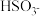 +H2O=2I-+SO
+H2O=2I-+SO +3H+
+3H+回答下列问题:
(1)写出①反应的离子反应方程式
(2)根据①②反应写出还原性粒子
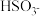 ,I2,I-由强到弱的顺序
,I2,I-由强到弱的顺序(3)溶液刚好褪色时,则消耗的NaHSO3溶液的体积为
(4)预测已知向含有淀粉的NaHSO3溶液滴加KIO3溶液的现象
Ⅱ.在密闭容器中,将碳酸氢钠和过氧化钠的混合粉未加热至250℃,使其充分反应最后测得残余固体中两种化合物的组成分别为amol和bmol,且a>b,试回答下列问题
(5)反应后中固体的成分及其物质的量是:
(6)原混合物中碳酸氢钠和过氧化钠的物质的量分别为:
(7)反应后容器气态物质成分及其物质的量是:
您最近一年使用:0次
5 . 连二亚硫酸钠(Na2S2O4),又称保险粉,是印刷工业中重要的还原剂。某课题小组进行如下实验:
I.【查阅资料】
(1)连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇。
(2)2Na2S2O4+4HCl= 4NaCl+S↓+3SO2↑+2H2O;Na2S2O3+2HCl= 2NaCl+S↓+SO2↑+H2O。
II.【制备方法】
75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:

冷却至40~50℃,过滤,用___ 洗涤,干燥制得Na2S2O4。
III.【Na2S2O4的性质】
(1)Na2S2O4溶液在空气中易被氧化.课题小组测定0.050mol/L
Na2S2O4溶液在空气中pH变化如图所示:0~t1段主要先生成HSO3-,根据pH变化图,HSO3-的电离程度___ 水解程度(填“<”或“>”)。

课题小组推测Na2S2O4溶液在空气中易被氧化,0~t1段发生离子反应方程式为___ 。t3时溶液中主要阴离子符号是___ 。
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体为_______ (填化学式).
请你设计实验验证产物有Na2S2O3存在,完成下表中内容。
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
I.【查阅资料】
(1)连二亚硫酸钠(Na2S2O4)是一种白色粉末,易溶于水,难溶于乙醇。
(2)2Na2S2O4+4HCl= 4NaCl+S↓+3SO2↑+2H2O;Na2S2O3+2HCl= 2NaCl+S↓+SO2↑+H2O。
II.【制备方法】
75℃时将甲酸钠和纯碱加入乙醇水溶液中,通入SO2进行反应,完成其反应方程式:

冷却至40~50℃,过滤,用
III.【Na2S2O4的性质】
(1)Na2S2O4溶液在空气中易被氧化.课题小组测定0.050mol/L
Na2S2O4溶液在空气中pH变化如图所示:0~t1段主要先生成HSO3-,根据pH变化图,HSO3-的电离程度

课题小组推测Na2S2O4溶液在空气中易被氧化,0~t1段发生离子反应方程式为
(2)隔绝空气加热Na2S2O4固体完全分解,得到固体产物Na2SO3、Na2S2O3和气体为
请你设计实验验证产物有Na2S2O3存在,完成下表中内容。
(供选择的试剂:稀盐酸、稀硝酸、BaCl2溶液、KMnO4溶液)
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
您最近一年使用:0次
6 . 硫酸铅(PbSO4)广泛应用于制造铅蓄电池、白色颜料等。利用方铅矿精矿(PbS)直接制备硫酸铅粉末的流程如下:
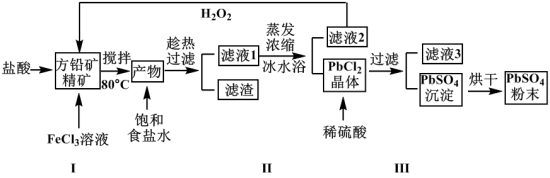
已知:(ⅰ)PbCl2(s)+2Cl-(aq)

 (aq) △H>0
(aq) △H>0
(ⅱ)Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、7.04
(1)步骤Ⅰ中FeCl3溶液与PbS反应生成PbCl2和S的离子方程式为_____________________ ,步骤Ⅰ中另一个反应是H2O2与FeCl2、盐酸反应生成FeCl3,实现FeCl3的重复利用,其离子方程式为__________ ,加入盐酸的另一个目的是为了控制pH在0.5~1.0,原因是_____________________________ 。
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因___________________________ 。
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式__________________________________ 。
(4)滤液3是_______________ 。
(5)铅蓄电池的电解液是稀硫酸(22%~28%),充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,铅蓄电池充电时阴极的电极反应式为________________________________ 。

已知:(ⅰ)PbCl2(s)+2Cl-(aq)


 (aq) △H>0
(aq) △H>0(ⅱ)Ksp(PbSO4)=1.08×10-8,Ksp(PbCl2)=1.6×10-5
(ⅲ)Fe3+、Pb2+以氢氧化物形式完全沉淀时,溶液的pH分别为3.2、7.04
(1)步骤Ⅰ中FeCl3溶液与PbS反应生成PbCl2和S的离子方程式为
(2)用化学平衡移动的原理解释步骤Ⅱ中使用冰水浴的原因
(3)写出PbCl2晶体转化为PbSO4沉淀的离子方程式
(4)滤液3是
(5)铅蓄电池的电解液是稀硫酸(22%~28%),充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,铅蓄电池充电时阴极的电极反应式为
您最近一年使用:0次
13-14高一下·浙江宁波·阶段练习
7 . A、B、C、D、F是常见的化合物,其中F在常温下是一种无色液体,D为强酸,请根据下图转化关系(反应条件及部分产物已略去),回答下列问题:
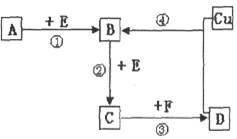
(1)若A、B、C、D均为含硫元素的化合物,A是一种常见的矿石的主要成分,且A的摩尔质量为120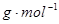 。 反应①的化学方程式为
。 反应①的化学方程式为_________________________ ;
(2)若A、B、C、D均为含氮元素的化合物,且A的一个分子中只含有10个电子,则:
①A分子式为__________ ;
②反应④的离子方程式为________________________________________________
③取Cu和Cu2O的混合物样品12.0g,加入到足量的D的稀溶液中,用排水法收集产生的气体,标准状况下其体积为2.24L,则样品中Cu2O的质量为__________ g。

(1)若A、B、C、D均为含硫元素的化合物,A是一种常见的矿石的主要成分,且A的摩尔质量为120
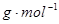 。 反应①的化学方程式为
。 反应①的化学方程式为(2)若A、B、C、D均为含氮元素的化合物,且A的一个分子中只含有10个电子,则:
①A分子式为
②反应④的离子方程式为
③取Cu和Cu2O的混合物样品12.0g,加入到足量的D的稀溶液中,用排水法收集产生的气体,标准状况下其体积为2.24L,则样品中Cu2O的质量为
您最近一年使用:0次
13-14高三下·浙江·阶段练习
解题方法
8 . 短周期元素X、Y、Z、W在周期表中的位置关系如右图所示,已知在同周期元素的常见简单离子中,W的简单离子半径最小,X、Y、Z、W的单质及其化合物在日常生活中用途极其广泛。
(1)X元素在元素周期表中的位置_______ 。
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阳离子的电子式为_________ 。
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为_______________ 。
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器_____ (填“能”或“不能”)用来腌制咸菜,原因是__________ 。
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式___________ 。关于该电池的下列说法,正确的是_______

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性其对应的酸常存在于自然界中的植物中,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:_________________

X | Y | Z | |
W |
(2)X、Y、Z元素的氢化物均有两种或两种以上,其中一定条件下,液态YH3与液态H2Z可以发生类似方式电离,则液态YH3中阳离子的电子式为
(3)超细WY粉末被应用于大规模集成电路领域。其制作原理为W2Z3、Y2、X在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1∶1;其反应的化学方程式为
(4)以W为材料制成的容器在空气中具有自我保护作用,这种容器
(5)某汽车尾气分析仪以燃料电池为工作原理测定XZ的浓度,其装置如图所示,该电池中电解质为氧化钇-氧化钠,其中Z2-可以在固体介质NASICON中自由移动。则负极的反应式

A.工作时电极b作正极,Z2- 通过固体介质NASICON由电极b流向电极a
B.工作时电流由电极a通过传感器流向电极b
C.传感器中通过的电流越大,尾气中XZ的含量越高
(6)由元素X与元素Z组成的某种阴离子具有还原性其对应的酸常存在于自然界中的植物中,能被酸性KMnO4氧化,请填写相应的离子,并给予配平:

您最近一年使用:0次
13-14高三·湖南长沙·阶段练习
解题方法
9 . X、Y、Z是三种短周期元素,X和Z的质子数之和与Y的质子数相等,Z的电子层数是X的电子层数的2倍。A、B、C、D、E、F是中学化学中的常见物质,它们由上述三种元素中的一种、两种或三种组成,其中A是能使湿润红色石蕊试纸变蓝的气体,D、E是两种酸,F是一种单质,反应③④均在微生物作用下进行,其转化关系如图所示。
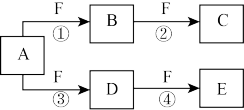
回答下列问题:
(1)A的电子式为______ 。
(2)A和E反应生成G,C与G中都含有______ (填化学键的类型)。
(3)反应③中如果转移的电子为3 mol,则被氧化的A为______ mol。
(4)科学家发明了使ZX3直接用于燃料电池的方法,其装置用铂作电极,加入碱性电解质溶液,往一极通入空气,另一电极通入ZX3并使之转化为无污染的气体,试写出负极的电极反应式:______ 。
(5)由Z、X两元素形成的含10个电子的阳离子可和XSO 形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为:
形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为:______ 。

回答下列问题:
(1)A的电子式为
(2)A和E反应生成G,C与G中都含有
(3)反应③中如果转移的电子为3 mol,则被氧化的A为
(4)科学家发明了使ZX3直接用于燃料电池的方法,其装置用铂作电极,加入碱性电解质溶液,往一极通入空气,另一电极通入ZX3并使之转化为无污染的气体,试写出负极的电极反应式:
(5)由Z、X两元素形成的含10个电子的阳离子可和XSO
 形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为:
形成一种盐A,若往A的溶液中缓缓滴入稀NaOH溶液至溶液恰好呈中性,则溶液中所含离子浓度由大到小的顺序为:
您最近一年使用:0次
10 . 磷是地壳中含量较为丰富的非金属元素,主要以难溶于水的磷酸盐如Ca3(PO4)2等形式存在。它的单质和化合物在工农业生产中有着重要的应用。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
写出由磷酸钙矿制取白磷总的反应方程式____________ 。
(2)白磷在热的浓氢氧化钾溶液中歧化得到一种次磷酸盐(KH2PO2)和一种气体________ (写化学式)。
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在________ 之间(已知磷酸的各级电离常数为:K1 = 7.1×10−3 K2 = 6.3×10−8 K3 =4.2×10−13 lg7.1≈0.9 lg6.3≈0.8 lg4.2≈0.6) 。Na2HPO4溶液显碱性,若向其溶液中加入足量的CaCl2溶液,溶液则显酸性,其原因是________________ (用离子方程式表示)。
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O= 20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是_________ 。
(1)白磷(P4)可由Ca3(PO4)2、焦炭和SiO2在电炉中高温(~1550℃)下通过下面三个反应共熔得到。
①4Ca3(PO4)2(s)+10C(s)=12CaO(s)+2P4(s)+10CO2(g)ΔH1=+Q1kJ·mol-1
②CaO(s)+SiO2(s)=CaSiO3(s) ΔH2=-Q2 kJ·mol-1
③CO2 (g)+C(s)=2CO(g) ΔH3=+Q3kJ·mol-1
已知:CaSiO3的熔点(1546℃)比SiO2低。
写出由磷酸钙矿制取白磷总的反应方程式
(2)白磷在热的浓氢氧化钾溶液中歧化得到一种次磷酸盐(KH2PO2)和一种气体
(3)磷的重要化合物NaH2PO4可通过H3PO4与NaOH溶液反应获得。工业上为了使反应的主要产物是NaH2PO4,通常将pH控制在
(4)白磷中毒后可用CuSO4溶液解毒,解毒原理可用下列化学方程式表示:
11P 4+60CuSO4+96H2O= 20Cu3P+24H3PO4+60H2SO4
60molCuSO4能氧化白磷的物质的量是
您最近一年使用:0次



