名校
解题方法
1 . 某种合金由镁,铝,铜,铁中的两种或两种以上组成,取该合金10.0g,放入足量H2SO4 溶液,收集到标准状况下的H210.08L;另取该合金10.0g,放入足量NaOH溶液中,收集到标准状况下的H28.96L。
(1)试据此判断,合金中一定含有的元素是_______________ 。(写元素符号);
(2)该合金与NaOH溶液反应的离子方程式:_________________________________ 。
(3)该合金组成可能是________________ 。(写出所有可能)
(1)试据此判断,合金中一定含有的元素是
(2)该合金与NaOH溶液反应的离子方程式:
(3)该合金组成可能是
您最近一年使用:0次
名校
2 . 从定性分析到定量研究是高中生化学学习的重要发展历程。请你根据所学知识对以下化学问题进行定量分析。
(1)高锰酸钾是一种典型的强氧化剂。在用KMnO4酸性溶液处理CuS的混合物时,发生的反应如下:6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O,请用单线桥法标出该反应中电子转移的方向和数目:
6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O________________
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol, 则转移的电子数为__________ , 被氧化的N原子的物质的量为__________ 。
(3)实验室需要为无土栽培配制1 L内含0.24 mol K2SO4、0.5 mol NH4Cl、0.16 mol KCl的某营养液。某小组计划用(NH4)2SO4、KCl、NH4Cl配制,则需这三种固体的物质的量分别为_________ 、_________ 、_________ 。
(1)高锰酸钾是一种典型的强氧化剂。在用KMnO4酸性溶液处理CuS的混合物时,发生的反应如下:6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O,请用单线桥法标出该反应中电子转移的方向和数目:
6 MnO4-+5 CuS + 28H+ = 5Cu2+ + 5SO2↑ +6 Mn2++ 14H2O
(2)汽车剧烈碰撞时,安全气囊中发生反应10NaN3+2KNO3=K2O+5Na2O+16N2↑。若氧化产物比还原产物多1.75 mol, 则转移的电子数为
(3)实验室需要为无土栽培配制1 L内含0.24 mol K2SO4、0.5 mol NH4Cl、0.16 mol KCl的某营养液。某小组计划用(NH4)2SO4、KCl、NH4Cl配制,则需这三种固体的物质的量分别为
您最近一年使用:0次
2017-12-06更新
|
1330次组卷
|
2卷引用:山西大学附属中学2017-2018学年高一上学期11月期中考试化学试题
3 . 二氧化铈(CeO2) 是一种重要的稀土氧化物,平板电视显示屏生产过程中产生大量的废玻璃粉末(含 SiO2、 Fe2O3、CeO2、FeO等物质)。某课题组以此粉末为原料,设计如下工艺流程对资源进行回收,得到纯净的CeO2和硫酸铁铵晶体。
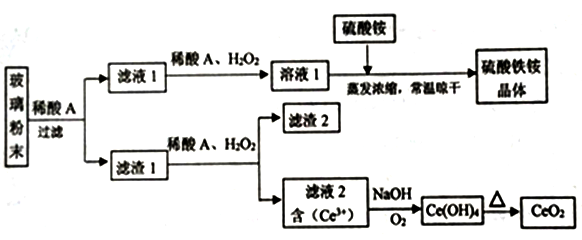
已知: CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1) 稀酸A的分子式是__________ 。
(2) 滤液I中加入H2O2溶液的目的是__________ 。
(3) 由滤渣1生成滤液2的离子方程式为__________ 。
(4) 设计实验证明滤液1中含有Fe2+__________ 。
(5) 已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe2O4,写出该反应的离子方程式__________ 。
(6)由滤液2 生成Ce(OH)4的离子方程式为__________ 。
(7) 硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,用离子方程式表示其净水原理__________ 。

已知: CeO2不溶于稀硫酸,也不溶于NaOH溶液。
(1) 稀酸A的分子式是
(2) 滤液I中加入H2O2溶液的目的是
(3) 由滤渣1生成滤液2的离子方程式为
(4) 设计实验证明滤液1中含有Fe2+
(5) 已知Fe2+溶液可以和难溶于水的FeO(OH)反应生成Fe2O4,写出该反应的离子方程式
(6)由滤液2 生成Ce(OH)4的离子方程式为
(7) 硫酸铁铵晶体[Fe2(SO4)3·2(NH4)2SO4·3H2O]广泛用于水的净化处理,用离子方程式表示其净水原理
您最近一年使用:0次
4 . (Ι)HNO2是一种弱酸,且不稳定,易分解生成NO和NO2;它能被常见的强氧化剂氧化;在酸性溶液中它也是一种氧化剂,如能把Fe2+氧化成Fe3+。AgNO2是一种难溶于水、易溶于酸的化合物。试回答下列问题:
(1)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(2)某同学把新制的氯水加到NaNO2溶液中,请写出反应的离子方程式:________________。
(3)铝能溶解在碱性亚硝酸盐溶液中,生成能使湿润的红色石蕊变蓝的气体,请写出反应的离子方程式__________________;
(Ⅱ)某暗紫色化合物A在常温和干燥的条件下,可以稳定存在,但它在酸性水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。为探究其成分,某学习兴趣小组的同学取化合物A粉末进行试验。经组成分析,该粉末仅含有O、K、Fe三种元素。另取3.96g化合物A的粉末溶于水,滴加足量稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。
下列物质中有可能提高化合物A水溶液稳定性的是 。
A.醋酸钠 B.醋酸 C.Fe(NO3)3 D.KOH
(2)请设计一个实验方案,研究温度对化合物A溶液稳定性的影响
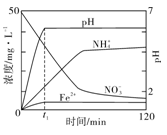
(3)下图表示足量 Fe粉还原KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式:
(1)下列方法中,不能用来区分NaNO2和NaCl的是________(填序号)。
A.测定这两种溶液的pH
B.分别在两种溶液中滴加甲基橙
C.在酸性条件下加入KI—淀粉溶液来区别
D.用AgNO3和HNO3两种试剂来区别
(2)某同学把新制的氯水加到NaNO2溶液中,请写出反应的离子方程式:________________。
(3)铝能溶解在碱性亚硝酸盐溶液中,生成能使湿润的红色石蕊变蓝的气体,请写出反应的离子方程式__________________;
(Ⅱ)某暗紫色化合物A在常温和干燥的条件下,可以稳定存在,但它在酸性水溶液中不稳定,一段时间后转化为红褐色沉淀,同时产生一种气体单质。为探究其成分,某学习兴趣小组的同学取化合物A粉末进行试验。经组成分析,该粉末仅含有O、K、Fe三种元素。另取3.96g化合物A的粉末溶于水,滴加足量稀硫酸,向反应后的溶液中加入含有0.08mol KOH的溶液,恰好完全反应。过滤,将洗涤后的沉淀充分灼烧,得到红棕色固体粉末1.60g;将所得滤液在一定条件下蒸发可得到一种纯净的不含结晶水的盐10.44g。
(1)目前,人们针对化合物A的稳定性进行了大量的探索,并取得了一定的进展。
下列物质中有可能提高化合物A水溶液稳定性的是 。
A.醋酸钠 B.醋酸 C.Fe(NO3)3 D.KOH
(2)请设计一个实验方案,研究温度对化合物A溶液稳定性的影响
(3)下图表示足量 Fe粉还原KNO3溶液过程中,测出的溶液中相关离子浓度、pH随时间的变化关系(部分副反应产物曲线略去)。请根据图中信息写出t1时刻前该反应的离子方程式:

您最近一年使用:0次
解题方法
5 . 钼酸钠(Na2MoO4)具有广泛的用途.可做新型水处理荆、优良的金属缓蚀剂及可用于局部过热的循环水系统;Al(OH)3工业和医药上都具有重要用途.现从某废钼催化剂(主要成分MoO3、Al2O3、Fe2O3等)中回收Na2MoO4和Al(OH)3,其工艺如图:
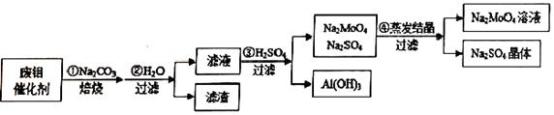
回答下列问题:
(1)已知MoO3、Al2O3与SiO2相似,均能在高温下跟Na2CO3发生类似反应,试写出MoO3与Na2CO3反应的化学方程式:__________________ 。
(2)第②步操作所后的滤液中,溶质有Na2MoO4、_________ 和过量的Na2CO3;检验第②步操作所得滤渣中含有三价铁的方法是___________________ 。
(3)第③步操作H2SO4需要适量,通常是通过_________ 来调控H2SO4的用量;与Na2SO4相比,Na2MoO4的溶解度受温度的影响变化__________ (填“较大”或“较小”)。
(4)利用铝热反应可回收金属钼。将所得钼酸钠溶液用酸处理得到沉淀,再加热可得MoO3。写出MoO3发生铝热反应的化学方程式:_________________ 。
(5)取废钼催化剂5.00g,加入5.30gNa2CO3(足量),经上述实验操作后,最终得到2.34g Al(OH)3和6.39gNa2SO4晶体,则废钼催化剂中Al2O3、MoO3的物质的量的比值为_______ 。

回答下列问题:
(1)已知MoO3、Al2O3与SiO2相似,均能在高温下跟Na2CO3发生类似反应,试写出MoO3与Na2CO3反应的化学方程式:
(2)第②步操作所后的滤液中,溶质有Na2MoO4、
(3)第③步操作H2SO4需要适量,通常是通过
(4)利用铝热反应可回收金属钼。将所得钼酸钠溶液用酸处理得到沉淀,再加热可得MoO3。写出MoO3发生铝热反应的化学方程式:
(5)取废钼催化剂5.00g,加入5.30gNa2CO3(足量),经上述实验操作后,最终得到2.34g Al(OH)3和6.39gNa2SO4晶体,则废钼催化剂中Al2O3、MoO3的物质的量的比值为
您最近一年使用:0次
6 . 亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强。某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:
㈠鉴别NaCl和NaNO2
(1)测定溶液pH
用pH试纸分别测定0.1mol•L-1两种盐溶液的pH,测得NaNO2溶液呈碱性.NaNO2溶液呈碱性的原因是__________ (用离子方程式解释),NaNO2溶液中c(HNO2)=__________ (用溶液中其它离子的浓度关系式表示)。
(2)沉淀法
取2mL0.1mol•L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液,两支试管均产生白色沉淀,分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。该温度下Ksp(AgNO2)=2×10-8 (mol•L-1)2; Ksp(AgCl)=1.8×10-10(mol•L-1)2,则反应AgNO2(s)+Cl-(aq)═AgCl(s)+NO2-(aq)的化学平衡常数K=__________ (计算结果写成分数)。
(二)实验室可用如下装置(略去部分夹持仪器)备亚硝酸钠。
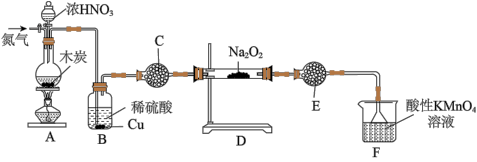
已知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(3)加热装置A前,先通一段时间N2,目的是__________ 。
(4)装置A中发生反应的化学方程式为__________ ,装置B的作用是__________ 。
(5)仪器C的名称为__________ ,其中盛放的药品为__________ (填名称)。
㈠鉴别NaCl和NaNO2
(1)测定溶液pH
用pH试纸分别测定0.1mol•L-1两种盐溶液的pH,测得NaNO2溶液呈碱性.NaNO2溶液呈碱性的原因是
(2)沉淀法
取2mL0.1mol•L-1两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液,两支试管均产生白色沉淀,分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解。该温度下Ksp(AgNO2)=2×10-8 (mol•L-1)2; Ksp(AgCl)=1.8×10-10(mol•L-1)2,则反应AgNO2(s)+Cl-(aq)═AgCl(s)+NO2-(aq)的化学平衡常数K=
(二)实验室可用如下装置(略去部分夹持仪器)备亚硝酸钠。

已知:①2NO+Na2O2=2NaNO2;②酸性条件下,NO和NO2都能与MnO4-反应生成NO3-和Mn2+;Na2O2能使酸性高锰酸钾溶液褪色.
(3)加热装置A前,先通一段时间N2,目的是
(4)装置A中发生反应的化学方程式为
(5)仪器C的名称为
您最近一年使用:0次
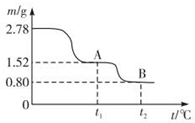
7 . 在中国古代,炼丹家以绿矾(FeSO4•7H2O为原料,放在炼丹炉中煅烧可制得绿矾油.绿矾油是一种无色粘稠液体,可用于除掉兵器上的铁锈.如图是2.78g绿矾隔绝空气受热分解时,所得固体产物的质量随温度变化的曲线.将加热产生的所有气体通入足量的BaCl2溶液.得自色沉淀1.16g.
(1)绿矾油主要成份的化学式为_________ .t1~t2.发生反应的化学方程式为_________________ .
(2)若将2.88g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到1.44g黑色细粉,则可推知该黑色细粉为_________ .
(3)以下是FeSO4•7H2O的实验室制备流理图.
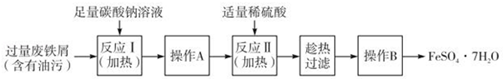
根据题意完成下列填空:
①反应II需要100mL1. 5mol•L﹣1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1.84g•cm﹣3的浓H2SO4配制.所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及____________ .
②操作A的名称为_____________ .
③测定FeSO4•7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法.已知称取6.0g FeSO4•7H2O产品,配制成溶液,用硫酸酸化的0.2000mol•L﹣1KMnO4溶液滴定,消耗KMnO4溶液的体积为20.00mL.发生反应的离子方程式为_______________ ,计算上述样品中FeSO4•7H2O的质量分数为_________ (保留两位有效数字).
(1)绿矾油主要成份的化学式为
(2)若将2.88g草酸亚铁(FeC2O4)隔绝空气加热至100℃,得到1.44g黑色细粉,则可推知该黑色细粉为
(3)以下是FeSO4•7H2O的实验室制备流理图.

根据题意完成下列填空:

①反应II需要100mL1. 5mol•L﹣1的稀H2SO4溶解洁净的铁屑,用质量分数为98%、密度为1.84g•cm﹣3的浓H2SO4配制.所用的仪器有量筒、烧杯、玻璃捧、胶头滴管及
②操作A的名称为
③测定FeSO4•7H2O产品中Fe2+含量的常用方法是KMnO4溶液滴定法.已知称取6.0g FeSO4•7H2O产品,配制成溶液,用硫酸酸化的0.2000mol•L﹣1KMnO4溶液滴定,消耗KMnO4溶液的体积为20.00mL.发生反应的离子方程式为
您最近一年使用:0次
8 . I.向100 mL FeI2溶液中逐渐通入Cl2,会依次生成I2、Fe3+、IO3-,其中Fe3+、I2的物质的量随n(Cl2)的变化如图所示,请回答下列问题:

(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为________ >________ >________ ;
(2)按顺序写出通入Cl2过程中发生反应的离子方程式为
__________________________________________ ;
__________________________________________ ;
__________________________________________ 。
(3)当溶液中n(Cl-)∶n(IO3-)=8∶1时,通入的Cl2在标准状况下的体积为________ 。
II.新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。生产K2FeO4的工艺流程如下图所示:
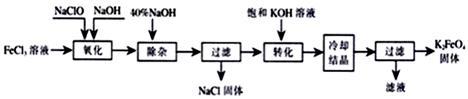
(1)写出“氧化”过程中生成Na2FeO4的化学方程式________________________ 。
(2)“转化”过程中发生的化学反应方程式为__________________________ 。

(1)由图可知,I-、Fe2+、I2三种粒子的还原性由强到弱的顺序为
(2)按顺序写出通入Cl2过程中发生反应的离子方程式为
(3)当溶液中n(Cl-)∶n(IO3-)=8∶1时,通入的Cl2在标准状况下的体积为
II.新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水,在中性或酸性溶液中逐渐分解,在碱性溶液中稳定。生产K2FeO4的工艺流程如下图所示:

(1)写出“氧化”过程中生成Na2FeO4的化学方程式
(2)“转化”过程中发生的化学反应方程式为
您最近一年使用:0次
9 . 碘是生命体中的必需元素,请根据如下有关碘及其化合物的性质,回答下列问题:
(1) 实验室中制取少量碘可采用如下方法:KI + CuSO4 → A (白色)↓+ K2SO4 + I2。16.0 g CuSO4与过量KI反应后可得19.1 g 的A,写出A的化学式:_______ 。工业生产中,可用智利硝石(含有NaIO3)为原料,与NaHSO3反应后生成碘,写出此反应的离子方程式:_______ 。
(2)单质碘与氟气反应可得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2O⇌H3O++ OH-),生成的阳离子为_______ ;阴离子为_______ 。
(3)将单质碘与铝屑置于管式电炉中,隔绝空气加热至500℃得到棕色片状固体,此固体溶于Na2CO3溶液可产生白色沉淀和气体。请写出上述实验过程中发生的化学反应方程式:_______ ,_______ 。
(4) 某化学课外小组用海带为原料制得少量含碘离子的溶液。现用0.10 mol·L-1的酸性高锰酸钾溶液滴定20.00 mL该溶液需10.25 mL,则该溶液中碘离子的浓度为_______ mol·L-1(精确到0.01)。
(5) I2O5是白色粉末状固体,可用作氧化剂使H2S、CO、HCl等氧化,在合成氨工业中常用I2O5来定量测量CO的含量。已知:
2I2(s)+5O2(g)=2I2O5(s) ΔH=-75.56kJ•mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ•mol-1
写出CO(g)与I2O5(s)反应析出固态I2的热化学方程式:_______ 。
(1) 实验室中制取少量碘可采用如下方法:KI + CuSO4 → A (白色)↓+ K2SO4 + I2。16.0 g CuSO4与过量KI反应后可得19.1 g 的A,写出A的化学式:
(2)单质碘与氟气反应可得IF5,实验表明液态IF5具有一定的导电性,研究人员发现产生这一现象的可能原因在于IF5的自偶电离(如:2H2O⇌H3O++ OH-),生成的阳离子为
(3)将单质碘与铝屑置于管式电炉中,隔绝空气加热至500℃得到棕色片状固体,此固体溶于Na2CO3溶液可产生白色沉淀和气体。请写出上述实验过程中发生的化学反应方程式:
(4) 某化学课外小组用海带为原料制得少量含碘离子的溶液。现用0.10 mol·L-1的酸性高锰酸钾溶液滴定20.00 mL该溶液需10.25 mL,则该溶液中碘离子的浓度为
(5) I2O5是白色粉末状固体,可用作氧化剂使H2S、CO、HCl等氧化,在合成氨工业中常用I2O5来定量测量CO的含量。已知:
2I2(s)+5O2(g)=2I2O5(s) ΔH=-75.56kJ•mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566.0kJ•mol-1
写出CO(g)与I2O5(s)反应析出固态I2的热化学方程式:
您最近一年使用:0次
解题方法
10 . 铅及其化合物可用于蓄电池、耐酸设备及X射线防护材料等。回答下列问题:
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为_________________ ,Fe3O4可写成FeO·Fe2O3的形式,如果将Pb3O4也写成相对应的形式应为:______________
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为___________________ 。PbO2可由PbO与次氯酸钠溶液反应制得,其反应的离子方程式为______________ 。
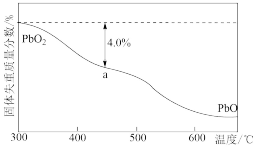
(3)PbO2在加热过程发生分解的失重曲线如右图所示,已知失重曲线上的a点为样品失重4.0%(即 ×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n
×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n_______________ ,____________ 。
(1)铅是碳的同族元素,比碳多4个电子层,铅在元素周期表的位置为
(2)PbO2与浓盐酸共热生成黄绿色气体,反应的化学方程式为

(3)PbO2在加热过程发生分解的失重曲线如右图所示,已知失重曲线上的a点为样品失重4.0%(即
 ×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n
×100%)的残留固体,若a点固体组成表示为PbOx或mPbO2·nPbO,计算x值和m︰n
您最近一年使用:0次



