解题方法
1 . 短周期元素在生产生活中应用广泛。根据题意,请回答下列问题:
Ⅰ.焦亚硫酸钠 是一种食品抗氧化剂,易溶于水。
是一种食品抗氧化剂,易溶于水。
(1)焦亚硫酸钠中硫元素的化合价为_____ 。
(2)向某些饮料中添加少量焦亚硫酸钠,可降低饮料中溶解氧的含量,发生反应的离子方程式为_____ 。
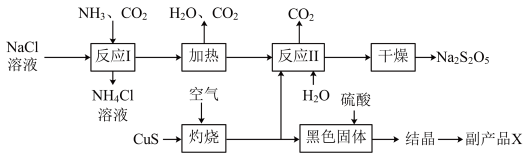
(3)工业上以侯氏制碱法为基础生产焦亚硫酸钠的工艺流程如下图: 溶液中先通入
溶液中先通入_____ (填“ ”或“
”或“ ”)。
”)。
②副产品 的化学式为
的化学式为_____ ;该生产工艺中可循环利用的物质为_____ (化学式)。
③为了减少产品 中的杂质含量,理论上需控制反应Ⅱ中固体与气体反应物的物质的量之比为
中的杂质含量,理论上需控制反应Ⅱ中固体与气体反应物的物质的量之比为_____ 。
Ⅱ.铝氢化钠 是有机合成的重要还原剂。将氢化钠和氯化铝在乙醚(有机溶剂)中反应可制备铝氢化钠。
是有机合成的重要还原剂。将氢化钠和氯化铝在乙醚(有机溶剂)中反应可制备铝氢化钠。
(4)写出制备铝氢化钠的化学方程式_____ 。
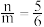
(5)在化学上,含氢还原剂的还原能力用“有效氢”表示,“有效氢”的含义是单位质量的含氢还原剂的还原能力相当于多少克氢气。一般含氢还原剂中的氢被氧化成 ,“还原能力”用氢失去电子数的多少表示。则
,“还原能力”用氢失去电子数的多少表示。则 、
、 的“有效氢”之比为
的“有效氢”之比为_____ 。
Ⅰ.焦亚硫酸钠
 是一种食品抗氧化剂,易溶于水。
是一种食品抗氧化剂,易溶于水。(1)焦亚硫酸钠中硫元素的化合价为
(2)向某些饮料中添加少量焦亚硫酸钠,可降低饮料中溶解氧的含量,发生反应的离子方程式为
(3)工业上以侯氏制碱法为基础生产焦亚硫酸钠的工艺流程如下图:
 溶液中先通入
溶液中先通入 ”或“
”或“ ”)。
”)。②副产品
 的化学式为
的化学式为③为了减少产品
 中的杂质含量,理论上需控制反应Ⅱ中固体与气体反应物的物质的量之比为
中的杂质含量,理论上需控制反应Ⅱ中固体与气体反应物的物质的量之比为Ⅱ.铝氢化钠
 是有机合成的重要还原剂。将氢化钠和氯化铝在乙醚(有机溶剂)中反应可制备铝氢化钠。
是有机合成的重要还原剂。将氢化钠和氯化铝在乙醚(有机溶剂)中反应可制备铝氢化钠。(4)写出制备铝氢化钠的化学方程式
(5)在化学上,含氢还原剂的还原能力用“有效氢”表示,“有效氢”的含义是单位质量的含氢还原剂的还原能力相当于多少克氢气。一般含氢还原剂中的氢被氧化成
 ,“还原能力”用氢失去电子数的多少表示。则
,“还原能力”用氢失去电子数的多少表示。则 、
、 的“有效氢”之比为
的“有效氢”之比为
您最近一年使用:0次
解题方法
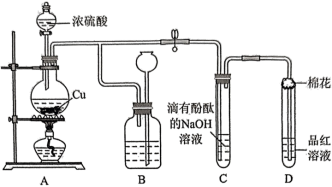
2 . 鲁能巴蜀中学化学学习小组探究了铜的氧化过程及铜的氧化物的组成。回答下列问题:_____ ,圆底烧瓶中发生反应的化学方程式为_____ 。
(2)装置 的作用是贮存多余的气体,
的作用是贮存多余的气体, 中广口瓶内应盛放的液体是
中广口瓶内应盛放的液体是_____ (填序号)。
①水 ②饱和的 溶液 ③
溶液 ③ 溶液 ④酸性
溶液 ④酸性 溶液
溶液
(3)装置 和
和 中产生的现象相同,但原因却不同。
中产生的现象相同,但原因却不同。 中是由于
中是由于 具有漂白性,而
具有漂白性,而 中的原因是
中的原因是_____ 。
(4)铜与过量 反应的探究如下:
反应的探究如下: 溶解的离子方程式为
溶解的离子方程式为_____ ;产生的气体为_____ 。
(5)比较实验①和②,说明 的作用是
的作用是_____ 。
(6)用足量 处理实验②新制的溶液得到沉淀
处理实验②新制的溶液得到沉淀 ,元素分析表明
,元素分析表明 为铜的氧化物,提纯干燥后的
为铜的氧化物,提纯干燥后的 在惰性氛围下加热,
在惰性氛围下加热, 完全分解为
完全分解为 黑色氧化物
黑色氧化物 ,
, 。
。 的化学式为
的化学式为_____ 。
(2)装置
 的作用是贮存多余的气体,
的作用是贮存多余的气体, 中广口瓶内应盛放的液体是
中广口瓶内应盛放的液体是①水 ②饱和的
 溶液 ③
溶液 ③ 溶液 ④酸性
溶液 ④酸性 溶液
溶液(3)装置
 和
和 中产生的现象相同,但原因却不同。
中产生的现象相同,但原因却不同。 中是由于
中是由于 具有漂白性,而
具有漂白性,而 中的原因是
中的原因是(4)铜与过量
 反应的探究如下:
反应的探究如下: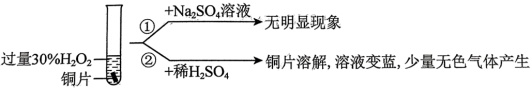
 溶解的离子方程式为
溶解的离子方程式为(5)比较实验①和②,说明
 的作用是
的作用是(6)用足量
 处理实验②新制的溶液得到沉淀
处理实验②新制的溶液得到沉淀 ,元素分析表明
,元素分析表明 为铜的氧化物,提纯干燥后的
为铜的氧化物,提纯干燥后的 在惰性氛围下加热,
在惰性氛围下加热, 完全分解为
完全分解为 黑色氧化物
黑色氧化物 ,
, 。
。 的化学式为
的化学式为
您最近一年使用:0次
3 .  是重要的化工原料,软锰矿制备
是重要的化工原料,软锰矿制备 的一种工艺流程如图:
的一种工艺流程如图:
软锰矿
资料:①软锰矿的主要成分为 ,主要杂质有
,主要杂质有 和
和 ;
;
②金属离于沉淀的 。
。
③该工艺条件下, 与
与 反应。
反应。
(1)溶出
①溶出前,软锰矿需研磨。目的是_____ 。
②溶出时, 的氧化过程及得到
的氧化过程及得到 的主要途径如图所示:
的主要途径如图所示: 的主要反应,反应的离子方程式是
的主要反应,反应的离子方程式是_____ 。
ii.若 全部来源于反应
全部来源于反应 ,完全溶出
,完全溶出 所需
所需 与
与 的物质的量比值为2.而实际比值
的物质的量比值为2.而实际比值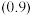 小于2,原因是
小于2,原因是_____ 。
(2)纯化。已知: 的氧化性与溶液
的氧化性与溶液 有关。纯化时先加入
有关。纯化时先加入 ,目的是
,目的是_____ ,后加入 ,调节溶液
,调节溶液 的区间是:
的区间是:_____ 。
(3)电解 纯化液经电解得
纯化液经电解得 。生成
。生成 的电极反应式是
的电极反应式是_____ 。
(4)写出铁原子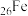 的电子排布式:
的电子排布式:_____ 。
 是重要的化工原料,软锰矿制备
是重要的化工原料,软锰矿制备 的一种工艺流程如图:
的一种工艺流程如图:软锰矿

资料:①软锰矿的主要成分为
 ,主要杂质有
,主要杂质有 和
和 ;
;②金属离于沉淀的
 。
。 |  |  |  | |
| 开始沉淀时 | 1.5 | 3.4 | 5.8 | 6.3 |
| 完全沉淀时 | 2.8 | 4.7 | 7.8 | 8.3 |
 与
与 反应。
反应。(1)溶出
①溶出前,软锰矿需研磨。目的是
②溶出时,
 的氧化过程及得到
的氧化过程及得到 的主要途径如图所示:
的主要途径如图所示: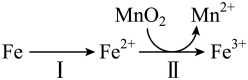
 的主要反应,反应的离子方程式是
的主要反应,反应的离子方程式是ii.若
 全部来源于反应
全部来源于反应 ,完全溶出
,完全溶出 所需
所需 与
与 的物质的量比值为2.而实际比值
的物质的量比值为2.而实际比值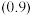 小于2,原因是
小于2,原因是(2)纯化。已知:
 的氧化性与溶液
的氧化性与溶液 有关。纯化时先加入
有关。纯化时先加入 ,目的是
,目的是 ,调节溶液
,调节溶液 的区间是:
的区间是:(3)电解
 纯化液经电解得
纯化液经电解得 。生成
。生成 的电极反应式是
的电极反应式是(4)写出铁原子
 的电子排布式:
的电子排布式:
您最近一年使用:0次
解题方法
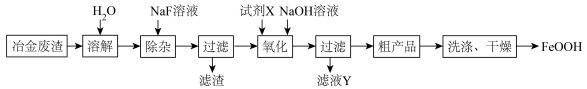
4 . FeOOH可用于脱硫工序,脱除效果较好。工业上利用冶金废渣[主要成分为FeSO4,还含有少量的Fe2(SO4)3、MgSO4及TiOSO4]为主要原料生产FeOOH的一种工艺流程如下:
(1)FeOOH中Fe的化合价为___________ 。
(2)“溶解”时TiOSO4生成难溶于酸的H2TiO3,该反应的化学方程式为___________ 。“除杂”时,加入NaF溶液的作用为沉淀Mg2+,则过滤所得滤渣的成分是___________ ,滤液Y中的主要溶质为_______ 。
(3)氧化时试剂X的最佳选择为__________ (填序号)。
a.KMnO4 b.HNO3 c.Cl2 d.空气
若用O2“氧化”时发生反应的离子方程式为____________ 。
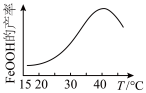
(4)生产中测得反应溶液的温度对FeOOH的产率的影响如图所示:___________ 。
(5)FeOOH纯度的测定:
①将FeOOH溶于盐酸中,发生的反应为:FeOOH+3HCl=FeCl3+2H2O
②加入适量的Zn粉,将Fe3+完全转化为Fe2+。
③用已知浓度的K2Cr2O7溶液测定生成的Fe2+,发生的反应为:6FeCl2+K2Cr2O7+14HCl=6FeCl3+2KCl+2CrCl3+7H2O,现取样品0.650g(假定杂质不参加反应),经上述各步反应后,共用去0.100mol/LK2Cr2O7溶液12.0mL。则FeOOH纯度为________ (保留三位有效数字)。
(1)FeOOH中Fe的化合价为
(2)“溶解”时TiOSO4生成难溶于酸的H2TiO3,该反应的化学方程式为
(3)氧化时试剂X的最佳选择为
a.KMnO4 b.HNO3 c.Cl2 d.空气
若用O2“氧化”时发生反应的离子方程式为
(4)生产中测得反应溶液的温度对FeOOH的产率的影响如图所示:
(5)FeOOH纯度的测定:
①将FeOOH溶于盐酸中,发生的反应为:FeOOH+3HCl=FeCl3+2H2O
②加入适量的Zn粉,将Fe3+完全转化为Fe2+。
③用已知浓度的K2Cr2O7溶液测定生成的Fe2+,发生的反应为:6FeCl2+K2Cr2O7+14HCl=6FeCl3+2KCl+2CrCl3+7H2O,现取样品0.650g(假定杂质不参加反应),经上述各步反应后,共用去0.100mol/LK2Cr2O7溶液12.0mL。则FeOOH纯度为
您最近一年使用:0次
名校
5 . 按要求完成下列方程式(在答题卡作答)
(1)45~50 ℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2,写出并配平该反应的化学方程式___________ 。
(2)KMnO4与热的稀硫酸酸化的Na2C2O4反应生成Mn2+和CO2,写出并配平该反应的离子方程式___________ 。
(3)PbO2可由PbO与次氯酸钠溶液反应制得,写出并配平该反应的离子方程式___________ 。
(4)饱和碳酸钠溶液能将锅炉水垢中的硫酸钙难溶物转化为碳酸钙,写出转化反应的离子方程式___________ 。
(5)写出用惰性电极电解硫酸铜溶液的阳极反应式___________ 。
(6)写出甲醇-空气碱性燃料电池的负极反应式___________ 。
(1)45~50 ℃时,向CuCl悬浊液中持续通入空气得到Cu2(OH)2Cl2,写出并配平该反应的化学方程式
(2)KMnO4与热的稀硫酸酸化的Na2C2O4反应生成Mn2+和CO2,写出并配平该反应的离子方程式
(3)PbO2可由PbO与次氯酸钠溶液反应制得,写出并配平该反应的离子方程式
(4)饱和碳酸钠溶液能将锅炉水垢中的硫酸钙难溶物转化为碳酸钙,写出转化反应的离子方程式
(5)写出用惰性电极电解硫酸铜溶液的阳极反应式
(6)写出甲醇-空气碱性燃料电池的负极反应式
您最近一年使用:0次
名校
解题方法
6 . 电解精炼粗铜过程中,从阳极进入到电解液中的少量砷会与铜一起沉积在阴极,形成黑铜泥(主要成分是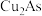 、
、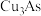 )阻碍精炼正常进行。黑铜泥可用于制备砷酸、三氧化二砷等重要化工原料。其部分实验流程如下。
)阻碍精炼正常进行。黑铜泥可用于制备砷酸、三氧化二砷等重要化工原料。其部分实验流程如下。_______ 。
(2)“酸浸”时提高As元素浸出率的措施有_______ 。(写出任意两项)。
(3)请写出“酸浸”步骤中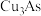 反应生成
反应生成 的化学方程式
的化学方程式_______ 。
(4)工业生产中也可以用雄黄(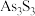 )代替
)代替 作还原剂。已知雌黄(
作还原剂。已知雌黄( )的结构如图,雄黄(
)的结构如图,雄黄(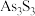 )中没有π键且各原子最外层均达8电子稳定结构,试画出雄黄(
)中没有π键且各原子最外层均达8电子稳定结构,试画出雄黄(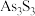 )结构图
)结构图_______ 。 水溶液中含砷的各物种的物质的量分数与pH的关系如图所示。
水溶液中含砷的各物种的物质的量分数与pH的关系如图所示。 的电离常数分别为
的电离常数分别为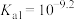 、
、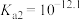 、
、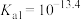 ,则a点pH=
,则a点pH=_______ 。
②工业含As(Ⅲ)废水具有剧毒,常用铁盐处理后排放。其原理是:铁盐混凝剂在溶液中产生 胶粒,其表面带有正电荷,可吸附含砷化合物。不同pH条件下铁盐对水中As(Ⅲ)的去除率如图所示。在pH=5~9溶液中,pH越大,铁盐混凝剂去除水中As(Ⅲ)的速率越快,原因是
胶粒,其表面带有正电荷,可吸附含砷化合物。不同pH条件下铁盐对水中As(Ⅲ)的去除率如图所示。在pH=5~9溶液中,pH越大,铁盐混凝剂去除水中As(Ⅲ)的速率越快,原因是_______ 。
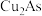 、
、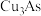 )阻碍精炼正常进行。黑铜泥可用于制备砷酸、三氧化二砷等重要化工原料。其部分实验流程如下。
)阻碍精炼正常进行。黑铜泥可用于制备砷酸、三氧化二砷等重要化工原料。其部分实验流程如下。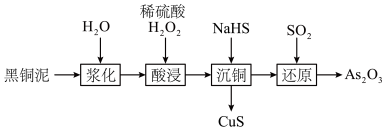
(2)“酸浸”时提高As元素浸出率的措施有
(3)请写出“酸浸”步骤中
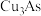 反应生成
反应生成 的化学方程式
的化学方程式(4)工业生产中也可以用雄黄(
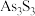 )代替
)代替 作还原剂。已知雌黄(
作还原剂。已知雌黄( )的结构如图,雄黄(
)的结构如图,雄黄(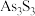 )中没有π键且各原子最外层均达8电子稳定结构,试画出雄黄(
)中没有π键且各原子最外层均达8电子稳定结构,试画出雄黄(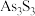 )结构图
)结构图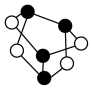
 水溶液中含砷的各物种的物质的量分数与pH的关系如图所示。
水溶液中含砷的各物种的物质的量分数与pH的关系如图所示。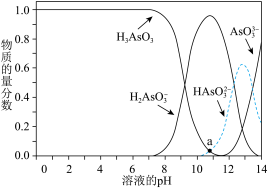
 的电离常数分别为
的电离常数分别为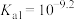 、
、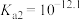 、
、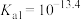 ,则a点pH=
,则a点pH=②工业含As(Ⅲ)废水具有剧毒,常用铁盐处理后排放。其原理是:铁盐混凝剂在溶液中产生
 胶粒,其表面带有正电荷,可吸附含砷化合物。不同pH条件下铁盐对水中As(Ⅲ)的去除率如图所示。在pH=5~9溶液中,pH越大,铁盐混凝剂去除水中As(Ⅲ)的速率越快,原因是
胶粒,其表面带有正电荷,可吸附含砷化合物。不同pH条件下铁盐对水中As(Ⅲ)的去除率如图所示。在pH=5~9溶液中,pH越大,铁盐混凝剂去除水中As(Ⅲ)的速率越快,原因是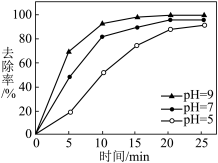
您最近一年使用:0次
解题方法
7 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等氧化物,从铬钒渣中分离提取铬和钒的一种流程如图所示:
i)最高价铬酸根离子在酸性介质中以 存在,在碱性介质中以
存在,在碱性介质中以 存在;
存在;
ii) 时,硅元素以
时,硅元素以 形式存在;
形式存在;
iii) 在
在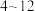 之间,铝元素以
之间,铝元素以 形式存在。
形式存在。
回答下列问题:
(1)基态 基态原子共有
基态原子共有_______ 种空间运动状态的电子。
(2)向浸取液中滴加稀硫酸过程中含铬离子转化反应的离子方程式为_______ 。
(3)水浸渣中主要物质为_______ (填化学式)。
(4)“沉淀”步骤调 到弱碱性,主要除去的杂质为
到弱碱性,主要除去的杂质为_______ (填化学式)。
(5)“除硅磷”步骤中,使硅、磷分别以 和
和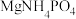 的形式沉淀,该步需要控制溶液的
的形式沉淀,该步需要控制溶液的 以达到最好的除杂效果,下列说法正确的是
以达到最好的除杂效果,下列说法正确的是_______ (填标号)。
a.若 过小,磷酸根离子会与
过小,磷酸根离子会与 反应使其浓度降低导致
反应使其浓度降低导致 无法完全沉淀
无法完全沉淀
b.若 过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
c.若 过大,会导致镁离子生成氢氧化镁沉淀,不能形成
过大,会导致镁离子生成氢氧化镁沉淀,不能形成 沉淀,导致产品中混有杂质
沉淀,导致产品中混有杂质
d.若 过大,溶液中铵根离子浓度增大,导致
过大,溶液中铵根离子浓度增大,导致 无法完全沉淀
无法完全沉淀
(6)“分离钒”步骤中,将溶液 调到1.8左右得到
调到1.8左右得到 沉淀,
沉淀, 在
在 时,溶解为
时,溶解为 或
或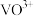 ,在碱性条件下,溶解为
,在碱性条件下,溶解为 或
或 ,上述性质说明
,上述性质说明 具有
具有_______ (填标号)。
A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠 溶液,反应的离子方程式为
溶液,反应的离子方程式为_______ 。

i)最高价铬酸根离子在酸性介质中以
 存在,在碱性介质中以
存在,在碱性介质中以 存在;
存在;ii)
 时,硅元素以
时,硅元素以 形式存在;
形式存在;iii)
 在
在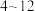 之间,铝元素以
之间,铝元素以 形式存在。
形式存在。回答下列问题:
(1)基态
 基态原子共有
基态原子共有(2)向浸取液中滴加稀硫酸过程中含铬离子转化反应的离子方程式为
(3)水浸渣中主要物质为
(4)“沉淀”步骤调
 到弱碱性,主要除去的杂质为
到弱碱性,主要除去的杂质为(5)“除硅磷”步骤中,使硅、磷分别以
 和
和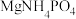 的形式沉淀,该步需要控制溶液的
的形式沉淀,该步需要控制溶液的 以达到最好的除杂效果,下列说法正确的是
以达到最好的除杂效果,下列说法正确的是a.若
 过小,磷酸根离子会与
过小,磷酸根离子会与 反应使其浓度降低导致
反应使其浓度降低导致 无法完全沉淀
无法完全沉淀b.若
 过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀
过小,会抑制硅酸根离子水解,导致硅酸镁无法完全沉淀c.若
 过大,会导致镁离子生成氢氧化镁沉淀,不能形成
过大,会导致镁离子生成氢氧化镁沉淀,不能形成 沉淀,导致产品中混有杂质
沉淀,导致产品中混有杂质d.若
 过大,溶液中铵根离子浓度增大,导致
过大,溶液中铵根离子浓度增大,导致 无法完全沉淀
无法完全沉淀(6)“分离钒”步骤中,将溶液
 调到1.8左右得到
调到1.8左右得到 沉淀,
沉淀, 在
在 时,溶解为
时,溶解为 或
或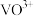 ,在碱性条件下,溶解为
,在碱性条件下,溶解为 或
或 ,上述性质说明
,上述性质说明 具有
具有A.酸性 B.碱性 C.两性
(7)“还原”步骤中加入焦亚硫酸钠
 溶液,反应的离子方程式为
溶液,反应的离子方程式为
您最近一年使用:0次
解题方法
8 . 利用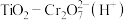 可快速测定水体化学需氧量,以
可快速测定水体化学需氧量,以 表示水体中的有机物,已知
表示水体中的有机物,已知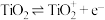 ,部分反应机理如图所示。下列叙述错误的是
,部分反应机理如图所示。下列叙述错误的是
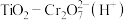 可快速测定水体化学需氧量,以
可快速测定水体化学需氧量,以 表示水体中的有机物,已知
表示水体中的有机物,已知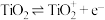 ,部分反应机理如图所示。下列叙述错误的是
,部分反应机理如图所示。下列叙述错误的是
A.该过程中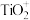 和 和 均表现出还原性 均表现出还原性 |
B.该过程中 是催化剂 是催化剂 |
C. 可以防止 可以防止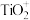 和 和 重新结合 重新结合 |
D.该过程的离子方程式可以表示为 |
您最近一年使用:0次
名校
解题方法
9 . 镍、钴及其化合物在工业上有广泛的应用。某工厂从镍钴矿(主要成分为 、
、 ,含少量
,含少量 、
、 、
、 、
、 、
、 )回收镍、钴、镁元素的工艺流程如图。
)回收镍、钴、镁元素的工艺流程如图。 (
( 的电离第一步完全,第二步微弱),用石灰乳调节
的电离第一步完全,第二步微弱),用石灰乳调节 ,
, 被氧化为
被氧化为 。
。
②离子浓度c≤1.0×10-6mol/L时,可认为该离子沉淀完全
③常见物质的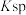
下列说法错误的是
 、
、 ,含少量
,含少量 、
、 、
、 、
、 、
、 )回收镍、钴、镁元素的工艺流程如图。
)回收镍、钴、镁元素的工艺流程如图。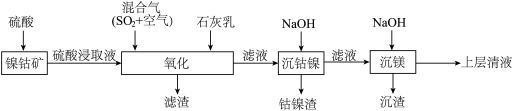
 (
( 的电离第一步完全,第二步微弱),用石灰乳调节
的电离第一步完全,第二步微弱),用石灰乳调节 ,
, 被氧化为
被氧化为 。
。②离子浓度c≤1.0×10-6mol/L时,可认为该离子沉淀完全
③常见物质的
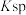
| 物质 |  |  |  |  |
| Ksp | 10-37.4 | 10-14.7 | 10-14.7 | 10-10.8 |
A. 发生“氧化”的离子方程式为 发生“氧化”的离子方程式为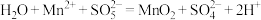 |
B.滤渣的主要成分为 、 、 |
C. 中过氧键的数目为 中过氧键的数目为 |
D.“沉钴镍”时钴镍恰好完全沉淀时溶液中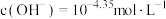 |
您最近一年使用:0次
解题方法
10 . 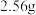 铜完全溶于一定浓度的硝酸溶液中,得到的
铜完全溶于一定浓度的硝酸溶液中,得到的 和
和 物质的量相同。若将收集
物质的量相同。若将收集 和
和 的集气瓶倒立于水中,通入一定量的氧气,充分反应后发现无气体剩余。
的集气瓶倒立于水中,通入一定量的氧气,充分反应后发现无气体剩余。
(1)反应中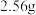 铜失去的电子数目为
铜失去的电子数目为___________ ;
(2)参加反应的硝酸的物质的量为___________ ;
(3)通入 的体积在标准状况下为
的体积在标准状况下为___________ mL。
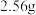 铜完全溶于一定浓度的硝酸溶液中,得到的
铜完全溶于一定浓度的硝酸溶液中,得到的 和
和 物质的量相同。若将收集
物质的量相同。若将收集 和
和 的集气瓶倒立于水中,通入一定量的氧气,充分反应后发现无气体剩余。
的集气瓶倒立于水中,通入一定量的氧气,充分反应后发现无气体剩余。(1)反应中
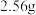 铜失去的电子数目为
铜失去的电子数目为(2)参加反应的硝酸的物质的量为
(3)通入
 的体积在标准状况下为
的体积在标准状况下为
您最近一年使用:0次



