名校
1 . 环境保护与绿色发展是新时代人们关心的共同话题。NO、 是大气主要污染物,因此对工业烟气(主要成分为
是大气主要污染物,因此对工业烟气(主要成分为 ,
, 、
、 )脱硝是工业生产中的重要一环。脱除的方法有多种,比较常见的有水吸收法、酸吸收法、碱吸收法、氧化吸收法、还原吸收法和综合吸收法等。
)脱硝是工业生产中的重要一环。脱除的方法有多种,比较常见的有水吸收法、酸吸收法、碱吸收法、氧化吸收法、还原吸收法和综合吸收法等。
(1)碱液吸收:NaOH溶液可吸收工业烟气,获得副产品 。
。
①等物质的量的NO与 被NaOH溶液吸收,反应的离子方程式为
被NaOH溶液吸收,反应的离子方程式为____________ 。
②若吸收时NO与 的比例控制不当,则吸收液经浓缩结晶、过滤得到的
的比例控制不当,则吸收液经浓缩结晶、过滤得到的 晶体中最有可能混有的杂质是
晶体中最有可能混有的杂质是______ (填化学式)。
(2)目前常见方法是采用酸化处理的NaClO溶液液相氧化法脱除烟气中的 ,其主要过程如下:
,其主要过程如下:
Ⅰ.
 kJ/mol
kJ/mol
Ⅱ.
 kJ/mol
kJ/mol
①写出 转化为
转化为 的热化学方程式:
的热化学方程式:____________ 。
②研究不同温度下对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是______ 。
(3)氨气催化吸收处理尾气法:已知6mol氨气恰好能将含NO和 共7mol的混合气体完全转化为
共7mol的混合气体完全转化为 ,则混合气体中NO和
,则混合气体中NO和 的物质的量之比为
的物质的量之比为______ 。
方法1:直接使用尿素 溶液吸收烟气中的
溶液吸收烟气中的 。
。
方法2:先用合适的氧化剂将 中的NO氧化为
中的NO氧化为 ,再用
,再用 溶液还原吸收。
溶液还原吸收。
还原吸收等量的 ,消耗尿素较少的是
,消耗尿素较少的是______ (填“方法1”或“方法2”)。工业上选择方法2处理 的原因是
的原因是____________ 。
 是大气主要污染物,因此对工业烟气(主要成分为
是大气主要污染物,因此对工业烟气(主要成分为 ,
, 、
、 )脱硝是工业生产中的重要一环。脱除的方法有多种,比较常见的有水吸收法、酸吸收法、碱吸收法、氧化吸收法、还原吸收法和综合吸收法等。
)脱硝是工业生产中的重要一环。脱除的方法有多种,比较常见的有水吸收法、酸吸收法、碱吸收法、氧化吸收法、还原吸收法和综合吸收法等。(1)碱液吸收:NaOH溶液可吸收工业烟气,获得副产品
 。
。①等物质的量的NO与
 被NaOH溶液吸收,反应的离子方程式为
被NaOH溶液吸收,反应的离子方程式为②若吸收时NO与
 的比例控制不当,则吸收液经浓缩结晶、过滤得到的
的比例控制不当,则吸收液经浓缩结晶、过滤得到的 晶体中最有可能混有的杂质是
晶体中最有可能混有的杂质是(2)目前常见方法是采用酸化处理的NaClO溶液液相氧化法脱除烟气中的
 ,其主要过程如下:
,其主要过程如下:Ⅰ.

 kJ/mol
kJ/molⅡ.

 kJ/mol
kJ/mol①写出
 转化为
转化为 的热化学方程式:
的热化学方程式:②研究不同温度下对NO脱除率的影响,结果如图所示。在60~80℃时,NO脱除率下降的原因是
(3)氨气催化吸收处理尾气法:已知6mol氨气恰好能将含NO和
 共7mol的混合气体完全转化为
共7mol的混合气体完全转化为 ,则混合气体中NO和
,则混合气体中NO和 的物质的量之比为
的物质的量之比为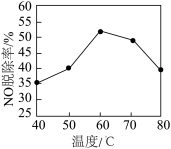
方法1:直接使用尿素
 溶液吸收烟气中的
溶液吸收烟气中的 。
。方法2:先用合适的氧化剂将
 中的NO氧化为
中的NO氧化为 ,再用
,再用 溶液还原吸收。
溶液还原吸收。还原吸收等量的
 ,消耗尿素较少的是
,消耗尿素较少的是 的原因是
的原因是
您最近一年使用:0次
名校
2 . 自然界中的含硫物质通过各种化学过程建立起硫循环,其循环过程如下图所示:
1.下列说法错误的是___________。
2.空气中粉尘可能在过程①中起到___________ 作用,收集一定量的酸雨,发现短时间内样品的 值一直在
值一直在___________ (填“变大”或“变小”),说明其溶质不仅仅是 。
。
Ⅱ.过程②
微生物的厌氧活动可产生 并将其排向大气中,
并将其排向大气中, 可在空气中被氧化为
可在空气中被氧化为
3.实验室产生多余 ,可用
,可用 溶液进行吸收,当
溶液进行吸收,当 吸收了过量
吸收了过量 时,其溶质的电离方程式为:
时,其溶质的电离方程式为:___________ 。
4.还可用硫酸铜溶液吸收 ,现象是溶液中产生黑色沉淀,写出反应的离子方程式:
,现象是溶液中产生黑色沉淀,写出反应的离子方程式:___________ 。
5. 还是工业制硫酸的重要中间物质,它可以通过硫酸厂的沸腾炉中
还是工业制硫酸的重要中间物质,它可以通过硫酸厂的沸腾炉中 (过硫化亚铁)与氧气的反应得到,用单线桥法标明电子转移:
(过硫化亚铁)与氧气的反应得到,用单线桥法标明电子转移:___________ 。

6. 与酸反应时生成
与酸反应时生成 与
与 相似,易分解。实验室用过量稀硫酸与
相似,易分解。实验室用过量稀硫酸与 颗粒混合,不可能生成的物质是___________。
颗粒混合,不可能生成的物质是___________。
Ⅲ.过程③7.海水中硫酸根离子含量大约为 ,会干扰海水中
,会干扰海水中 的检验,写出检验海水中
的检验,写出检验海水中 的实验方法
的实验方法___________ 。IV.过程④生物体内少量的和 反应生成
反应生成 和S,说明
和S,说明 具有还原性8.某种卤离子也能与
具有还原性8.某种卤离子也能与 在溶液中作用生成亚铁盐与卤素单质,它应该是___________。
在溶液中作用生成亚铁盐与卤素单质,它应该是___________。
9.由于化石能源的开采与使用量的不断增长,直接导致硫循环中的过程___________加剧,对环境造成了一定程度的破坏,请提出减缓这一过程的措施。
10.措施:___________ 。

1.下列说法错误的是___________。
A.工厂废气中的 与 与 可能来自于煤炭中的含硫物质。 可能来自于煤炭中的含硫物质。 |
| B.火山口产生的气体可以使酸性高锰酸钾溶液褪色,说明其具有漂白性 |
C. 有毒,其含量是空气污染程度指标之一 有毒,其含量是空气污染程度指标之一 |
D. 可添加到红酒中,起到一定的杀菌、抗氧化作用 可添加到红酒中,起到一定的杀菌、抗氧化作用 |
 值一直在
值一直在 。
。Ⅱ.过程②
微生物的厌氧活动可产生
 并将其排向大气中,
并将其排向大气中, 可在空气中被氧化为
可在空气中被氧化为
3.实验室产生多余
 ,可用
,可用 溶液进行吸收,当
溶液进行吸收,当 吸收了过量
吸收了过量 时,其溶质的电离方程式为:
时,其溶质的电离方程式为:4.还可用硫酸铜溶液吸收
 ,现象是溶液中产生黑色沉淀,写出反应的离子方程式:
,现象是溶液中产生黑色沉淀,写出反应的离子方程式:5.
 还是工业制硫酸的重要中间物质,它可以通过硫酸厂的沸腾炉中
还是工业制硫酸的重要中间物质,它可以通过硫酸厂的沸腾炉中 (过硫化亚铁)与氧气的反应得到,用单线桥法标明电子转移:
(过硫化亚铁)与氧气的反应得到,用单线桥法标明电子转移:
6.
 与酸反应时生成
与酸反应时生成 与
与 相似,易分解。实验室用过量稀硫酸与
相似,易分解。实验室用过量稀硫酸与 颗粒混合,不可能生成的物质是___________。
颗粒混合,不可能生成的物质是___________。A. | B.S | C. | D. |
 ,会干扰海水中
,会干扰海水中 的检验,写出检验海水中
的检验,写出检验海水中 的实验方法
的实验方法 反应生成
反应生成 和S,说明
和S,说明 具有还原性8.某种卤离子也能与
具有还原性8.某种卤离子也能与 在溶液中作用生成亚铁盐与卤素单质,它应该是___________。
在溶液中作用生成亚铁盐与卤素单质,它应该是___________。A. | B. | C. | D. |
| A.① | B.② | C.③ | D.④ |
您最近一年使用:0次
名校
解题方法
3 . 一种制备 的方法如下:将铜与足量的浓硫酸加热,接着有两步操作
的方法如下:将铜与足量的浓硫酸加热,接着有两步操作
Ⅰ:将生成的气体用适量 溶液吸收得到单一组分的正盐溶液X
溶液吸收得到单一组分的正盐溶液X
Ⅱ:除去余酸,将硫酸铜配成溶液,并加入溶液X,反应过滤即得
已知第Ⅱ步反应需及时补加 以保持反应在
以保持反应在 条件下进行.下列有关说法不正确的是
条件下进行.下列有关说法不正确的是
 的方法如下:将铜与足量的浓硫酸加热,接着有两步操作
的方法如下:将铜与足量的浓硫酸加热,接着有两步操作Ⅰ:将生成的气体用适量
 溶液吸收得到单一组分的正盐溶液X
溶液吸收得到单一组分的正盐溶液XⅡ:除去余酸,将硫酸铜配成溶液,并加入溶液X,反应过滤即得

已知第Ⅱ步反应需及时补加
 以保持反应在
以保持反应在 条件下进行.下列有关说法不正确的是
条件下进行.下列有关说法不正确的是| A.铜和浓硫酸的反应中,浓硫酸表现为氧化性和酸性 |
| B.若从溶液X获得固体X,可将X溶液蒸发浓缩,冷却结晶 |
| C.硫酸铜和石灰乳混合可以制备波尔多液 |
D.若 产量不变,参与反应Ⅱ的X与 产量不变,参与反应Ⅱ的X与 物质的量之比 物质的量之比 增大时,需补加 增大时,需补加 的量减少 的量减少 |
您最近一年使用:0次
名校
4 . FeOOH在生产生活中有广泛应用。
I.用硫酸渣(主要成分为 、
、 )制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。
)制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。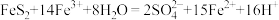 ;
; 、
、 均与
均与 不反应。
不反应。
(1)基态 价层电子排布式为
价层电子排布式为___________ 。
(2)“还原”时还原产物与氧化产物的物质的量之比为___________ 。
(3)“氧化”时,当滴加氨水至pH为6.0时,停止滴加氨水,开始通空气,生成铁黄。通入空气过程中,记录溶液pH变化如图所示。 完全沉淀的
完全沉淀的 。
。 时段发生的反应为
时段发生的反应为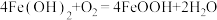 ;
; 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:___________ 。
II. 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。
(4)在80℃下,向 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得
溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。
①制备1mol 理论上需要
理论上需要 的物质的量为
的物质的量为___________ mol;实际生产过程中所加 低于理论用量的原因是
低于理论用量的原因是___________ 。
②为检验 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是___________ 。
(5) 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 结构如图2所示。
结构如图2所示。 分子中的共价键的物质的量为
分子中的共价键的物质的量为___________ mol。
②写出反应II的化学方程式:___________ 。
I.用硫酸渣(主要成分为
 、
、 )制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。
)制备铁基颜料铁黄(FeOOH)的一种工艺流程如下图。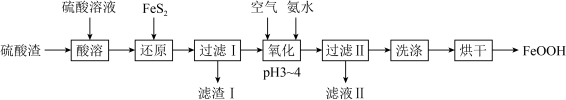
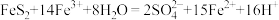 ;
; 、
、 均与
均与 不反应。
不反应。(1)基态
 价层电子排布式为
价层电子排布式为(2)“还原”时还原产物与氧化产物的物质的量之比为
(3)“氧化”时,当滴加氨水至pH为6.0时,停止滴加氨水,开始通空气,生成铁黄。通入空气过程中,记录溶液pH变化如图所示。
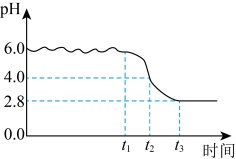
 完全沉淀的
完全沉淀的 。
。 时段发生的反应为
时段发生的反应为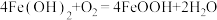 ;
; 时段,溶液pH明显降低,请解释原因:
时段,溶液pH明显降低,请解释原因:II.
 在环境保护等领域有广泛应用。
在环境保护等领域有广泛应用。(4)在80℃下,向
 溶液中边搅拌边分批加入
溶液中边搅拌边分批加入 固体,同时滴加
固体,同时滴加 溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得
溶液,使溶液pH控制在4~4.5之间。一段时间后,过滤、洗涤得 固体。
固体。①制备1mol
 理论上需要
理论上需要 的物质的量为
的物质的量为 低于理论用量的原因是
低于理论用量的原因是②为检验
 已被完全氧化,某同学向过滤所得滤液中滴加酸性
已被完全氧化,某同学向过滤所得滤液中滴加酸性 溶液,该设计方案不合理的理由是
溶液,该设计方案不合理的理由是(5)
 可用于脱除烟气中的
可用于脱除烟气中的 。脱硫、再生过程中可能的物种变化如图1所示。生成的
。脱硫、再生过程中可能的物种变化如图1所示。生成的 结构如图2所示。
结构如图2所示。
 分子中的共价键的物质的量为
分子中的共价键的物质的量为②写出反应II的化学方程式:
您最近一年使用:0次
7日内更新
|
49次组卷
|
2卷引用:江苏省南通市海安高级中学2023-2024学年高一下学期期中考试化学试题
名校
解题方法
5 . 将3.2g铜与60.0mL稀硝酸发生反应,铜完全溶解,假设还原产物只有一种,则用排水法可收集到________ L气体(STP)。
您最近一年使用:0次
名校
6 . 天然气中的 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为 ,一定条件下向
,一定条件下向 溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:
溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:________________ .当消耗标准状况下22.4L富氧空气时,有________ mol电子转移。
 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为 ,一定条件下向
,一定条件下向 溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:
溶液中通入富氧空气(含氧体积分数50%),得到单质硫并使吸收液再生,写出该反应的化学方程式:
您最近一年使用:0次
7 . 自然界的氮循环如图所示
(2)施用化肥可有效提高粮食产量.化肥氯化铵施用时需要注意避免烈日曝晒,因为(写出对应的化学方程式)______________________________ .此类铵态氮肥不宜和草木灰等碱性肥料混合使用,原因是________________ .
(3)海洋生物参与氮循环的过程如图所示(其它含氮物质不参与反应).________ 种价态.过程②中氮元素被________ .(填“氧化”或“还原”)
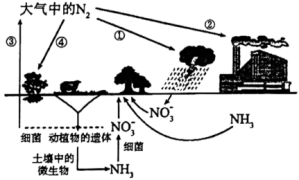
| A.图中表示了三种不同的固氮方式 | B.②中合成氨属于人工固氮 |
C.除 外,①和④中均需还原剂参与 外,①和④中均需还原剂参与 | D.含氮有机物和含氮无机物可相互转化 |
(3)海洋生物参与氮循环的过程如图所示(其它含氮物质不参与反应).

您最近一年使用:0次
名校
解题方法
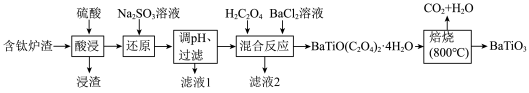
8 . BaTiO3,被用作陶瓷电容器的介电材料、麦克风和其他传感器的压电材料。以含钛炉渣(主要成分是TiO2,含少量Fe2O3、CaO、SiO2等)为原料制备BaTiO3的流程如下:
回答下列问题:
(1)下列为Ba粒子简化电子排布式,其中能量最高的是 (填字母)。
(2)“还原”中发生反应的离子方程式为________ 。若省去“还原”工艺,则________ 。
(3)设计实验检验滤液1中是否含有Fe2+:________ 。
(4)BaTiO(C2O4)2·4H2O中Ti的化合价为________ ,“焙烧”发生反应的化学方程式为________ 。
(5)经X射线分析鉴定,钛酸钡(BaTiO3)的晶胞结构如下图所示(Ti4+、Ba2+均与O2-相接触),已知晶胞边长为 pm,O2-的半径为
pm,O2-的半径为 pm,则Ti4+、Ba2+的半径分别为
pm,则Ti4+、Ba2+的半径分别为______ pm、______ pm。(用含 、
、 的代数式表示)
的代数式表示)
| 金属离子 | TiO2+ | Fe2+ | Fe3+ |
| 开始沉淀的pH | 0.5 | 6.3 | 1.5 |
| 完全沉淀的pH | 2.5 | 8.3 | 2.8 |
(1)下列为Ba粒子简化电子排布式,其中能量最高的是 (填字母)。
| A.[Xe]6s2 | B.[Xe]6s1 | C.[Xe]6s16p1 | D.[Xe]6s0p2 |
(2)“还原”中发生反应的离子方程式为
(3)设计实验检验滤液1中是否含有Fe2+:
(4)BaTiO(C2O4)2·4H2O中Ti的化合价为
(5)经X射线分析鉴定,钛酸钡(BaTiO3)的晶胞结构如下图所示(Ti4+、Ba2+均与O2-相接触),已知晶胞边长为
 pm,O2-的半径为
pm,O2-的半径为 pm,则Ti4+、Ba2+的半径分别为
pm,则Ti4+、Ba2+的半径分别为 、
、 的代数式表示)
的代数式表示)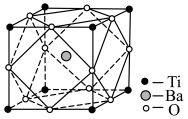
您最近一年使用:0次
名校
解题方法
9 . 含硫的物质与人们的生活密切相关。已知硫元素常见的化合价有-2、0、+4、+6四种,其不同价态的物质间可相互转化。完成下列填空:
(1)请写出硫在元素周期表的位置:___________ 。
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径: 转化成
转化成 的化学方程式:
的化学方程式:___________ 。
你认为减少酸雨产生的无效措施是___________ (填字母序号)
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:___________ 。
(5)当观察到②中溶液颜色变浅时,①中的现象是___________ 。
(6)装置③的作用是___________ 。
(7)②中的现象说明二氧化硫具有的性质是___________ 。
(8)从氧化还原角度制备硫代硫酸钠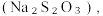 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。
(9)为进一步减少 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原 得到单质硫的方法来除去
得到单质硫的方法来除去 写出该反应的化学方程式:
写出该反应的化学方程式:___________ 。
(1)请写出硫在元素周期表的位置:
(2)硫与硅为同一周期元素,通过下列事实能比较两者非金属性强弱的是___________。
A.热稳定性: | B.溶解度: 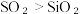 |
C.单质的熔点: | D.酸性:  |
(3)二氧化硫是形成酸雨的“元凶”之一,由二氧化硫形成的酸雨的主要成分是硫酸。以下是二氧化硫形成酸雨的两种途径:

 转化成
转化成 的化学方程式:
的化学方程式:你认为减少酸雨产生的无效措施是
A.少用煤作燃料 B.把工厂烟囱造高 C.燃料脱硫 D.开发新能源
某同学利用如图所示装置探究二氧化硫气体的性质,回答下列问题:
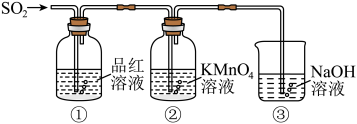
(5)当观察到②中溶液颜色变浅时,①中的现象是
(6)装置③的作用是
(7)②中的现象说明二氧化硫具有的性质是
(8)从氧化还原角度制备硫代硫酸钠
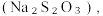 下列方案合理的是(填编号)___________。
下列方案合理的是(填编号)___________。A.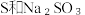 | B. 和浓 和浓 | C. 和 和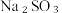 | D.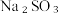 和 和 |
(9)为进一步减少
 的污染并变废为宝,我国正在探索在一定条件下,用CO还原
的污染并变废为宝,我国正在探索在一定条件下,用CO还原 得到单质硫的方法来除去
得到单质硫的方法来除去 写出该反应的化学方程式:
写出该反应的化学方程式:
您最近一年使用:0次
名校
10 . 研究氮及其化合物的性质对改善人类的生存环境具有重要意义。回答下列问题:
(1)氨气是氮的最简单氢化物,电子式为_______ ,其水溶液呈_______ (填“酸性”、“中性”或“碱性”)。
(2)①以氨气为原料可制得铵态氮肥。下列属于铵态氮肥的是_______ (填选项字母)。
A.硝酸钾 B. C.尿素
C.尿素 D.碳铵
D.碳铵
② 常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的
常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的 溶液480 mL,需要称量
溶液480 mL,需要称量 固体的质量为
固体的质量为_______ g。
(3)在催化剂的作用下,向280~420℃的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质。写出 消除
消除 的化学反应方程式:
的化学反应方程式:_______ 。
(4)亚硝酸钠( )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。工业制备亚硝酸钠的途径有两种。
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。工业制备亚硝酸钠的途径有两种。
途径一: 加热到380℃分解,原理为
加热到380℃分解,原理为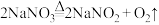 ;
;
途径二:NaOH溶液吸收NO、 气体。
气体。
①写出途径二反应的离子方程式:_______ 。
②制备等量的 ,途径一与途径二转移电子的物质的量之比为
,途径一与途径二转移电子的物质的量之比为_______ 。
(1)氨气是氮的最简单氢化物,电子式为
(2)①以氨气为原料可制得铵态氮肥。下列属于铵态氮肥的是
A.硝酸钾 B.
 C.尿素
C.尿素 D.碳铵
D.碳铵②
 常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的
常作为水培植物营养液的氮肥来源,若用容量瓶配制0.2 mol/L的 溶液480 mL,需要称量
溶液480 mL,需要称量 固体的质量为
固体的质量为(3)在催化剂的作用下,向280~420℃的烟气中喷入氨可使工厂废气中的氮氧化物转化为无污染的物质。写出
 消除
消除 的化学反应方程式:
的化学反应方程式:(4)亚硝酸钠(
 )是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。工业制备亚硝酸钠的途径有两种。
)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。工业制备亚硝酸钠的途径有两种。途径一:
 加热到380℃分解,原理为
加热到380℃分解,原理为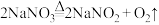 ;
;途径二:NaOH溶液吸收NO、
 气体。
气体。①写出途径二反应的离子方程式:
②制备等量的
 ,途径一与途径二转移电子的物质的量之比为
,途径一与途径二转移电子的物质的量之比为
您最近一年使用:0次



