名校
解题方法
1 . I.汽车尾气中含有CO、NOx等有害气体。
(1)NOx能形成酸雨,氮有多种价态的氧化物,氮元素从+1~+5价都有对应的氧化物,常见的有N2O、NO、N2O3、NO2(或N2O4)、N2O5,其中属于酸性氧化物的是___________ 。
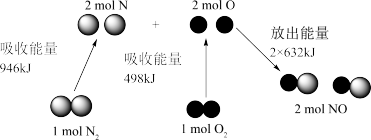
(2)汽车尾气中NO生成过程的能量变化示意图如下:___________ (填“吸热”或“放热”)___________ kJ的能量。
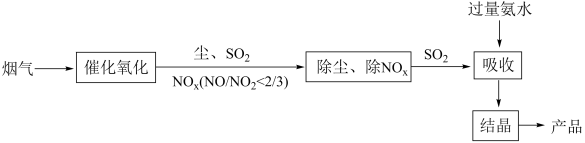
Ⅱ.目前工业上烟气脱硫脱硝的工艺流程如下: > 9)。
> 9)。
(3)“氧化”的目的是___________ 。图中产品中含硫成分为___________ (填化学式)。
Ⅲ.海洋生物参与氮循环的过程如图所示(其它含氮物质不参与反应)。___________ 种价态。反应③和⑤中,若生成等物质的量的N2,则转移的电子数之比为___________ 。
Ⅳ.利用NaOH溶液吸收NO2,避免硝酸生产尾气中的氮氧化物对环境的破坏作用。
(5)已知用NaOH溶液吸收时会生成NaNO2和另一种盐,则吸收NO2的离子方程式为___________ 。
(1)NOx能形成酸雨,氮有多种价态的氧化物,氮元素从+1~+5价都有对应的氧化物,常见的有N2O、NO、N2O3、NO2(或N2O4)、N2O5,其中属于酸性氧化物的是
(2)汽车尾气中NO生成过程的能量变化示意图如下:
Ⅱ.目前工业上烟气脱硫脱硝的工艺流程如下:
 > 9)。
> 9)。(3)“氧化”的目的是
Ⅲ.海洋生物参与氮循环的过程如图所示(其它含氮物质不参与反应)。
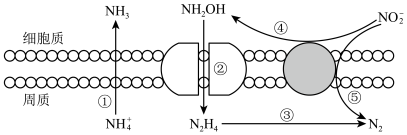
Ⅳ.利用NaOH溶液吸收NO2,避免硝酸生产尾气中的氮氧化物对环境的破坏作用。
(5)已知用NaOH溶液吸收时会生成NaNO2和另一种盐,则吸收NO2的离子方程式为
您最近一年使用:0次
真题
解题方法
2 . 市售的溴(纯度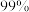 )中含有少量的
)中含有少量的 和
和 ,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:
,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:
(1)装置如图(夹持装置等略),将市售的溴滴入盛有浓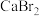 溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为
溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为_______ ;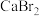 溶液的作用为
溶液的作用为_______ ;D中发生的主要反应的化学方程式为_______ 。_______ (填仪器名称)中,边加热边向其中滴加酸化的 溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成
溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成 的离子方程式为
的离子方程式为_______ 。
(3)利用图示相同装置,将R和 固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓
固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓 ,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为
,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为_______ 和_______ 。
(4)为保证溴的纯度,步骤(3)中 固体的用量按理论所需量的
固体的用量按理论所需量的 计算,若固体R质量为m克(以
计算,若固体R质量为m克(以 计),则需称取
计),则需称取_______ 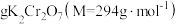 (用含m的代数式表示)。
(用含m的代数式表示)。
(5)本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为漏斗下端管口紧靠烧杯内壁,转移溶液时用_______ ,滤液沿烧杯壁流下。
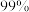 )中含有少量的
)中含有少量的 和
和 ,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:
,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:(1)装置如图(夹持装置等略),将市售的溴滴入盛有浓
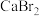 溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为
溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为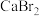 溶液的作用为
溶液的作用为
 溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成
溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成 的离子方程式为
的离子方程式为(3)利用图示相同装置,将R和
 固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓
固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓 ,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为
,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为(4)为保证溴的纯度,步骤(3)中
 固体的用量按理论所需量的
固体的用量按理论所需量的 计算,若固体R质量为m克(以
计算,若固体R质量为m克(以 计),则需称取
计),则需称取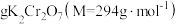 (用含m的代数式表示)。
(用含m的代数式表示)。(5)本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为漏斗下端管口紧靠烧杯内壁,转移溶液时用
您最近一年使用:0次
名校
解题方法
3 . I.有一块镀铜的铁制品,已严重锈蚀[铜锈成分视为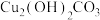 ],铁锈成分视为
],铁锈成分视为 ],实验小组同学将它粉碎后,放入过量的稀硫酸中微热使之充分反应,收集到气体甲,过滤得到固体乙和滤液丙。
],实验小组同学将它粉碎后,放入过量的稀硫酸中微热使之充分反应,收集到气体甲,过滤得到固体乙和滤液丙。
(1)气体甲的成分是___________ (填化学式),固体乙的成分是___________ (填名称)。
(2)铁发生的反应属于四种基本反应类型中的___________ 。
(3)滤液丙的颜色可能是___________(选填编号)。
(4)确认滤液丙中是否含有亚铁离子,适宜的试剂是___________(选填编号)。
Ⅱ.铁与不同浓度硝酸反应时主要还原产物不同。现将过量铁与一定浓度的硝酸充分反应,测得消耗的铁与被还原的硝酸的物质的量之比为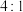 。
。
(5)假若反应生成的还原产物只有一种,则还原产物是___________ 。
(6)所得溶液与碳酸氢铵溶液混合可获得碳酸亚铁沉淀,同时有气体生成。写出反应生成碳酸亚铁的离子方程式___________ 。
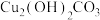 ],铁锈成分视为
],铁锈成分视为 ],实验小组同学将它粉碎后,放入过量的稀硫酸中微热使之充分反应,收集到气体甲,过滤得到固体乙和滤液丙。
],实验小组同学将它粉碎后,放入过量的稀硫酸中微热使之充分反应,收集到气体甲,过滤得到固体乙和滤液丙。(1)气体甲的成分是
(2)铁发生的反应属于四种基本反应类型中的
(3)滤液丙的颜色可能是___________(选填编号)。
| A.棕黄色 | B.蓝色 | C.浅绿色 | D.无色 |
A. 溶液 溶液 | B.NaOH溶液 |
C.KSCN溶液和 溶液 溶液 | D. 淀粉试纸 淀粉试纸 |
Ⅱ.铁与不同浓度硝酸反应时主要还原产物不同。现将过量铁与一定浓度的硝酸充分反应,测得消耗的铁与被还原的硝酸的物质的量之比为
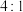 。
。(5)假若反应生成的还原产物只有一种,则还原产物是
(6)所得溶液与碳酸氢铵溶液混合可获得碳酸亚铁沉淀,同时有气体生成。写出反应生成碳酸亚铁的离子方程式
您最近一年使用:0次
名校
解题方法
4 . GaN是一种重要的半导体材料,利用铝土矿(成分为 、
、 、
、 )制备GaN的工艺流程如图所示。已知Ga与Al的化学性质相似,Ga的熔点为29.8℃,沸点为:2403℃。下列说法错误的是
)制备GaN的工艺流程如图所示。已知Ga与Al的化学性质相似,Ga的熔点为29.8℃,沸点为:2403℃。下列说法错误的是
 、
、 、
、 )制备GaN的工艺流程如图所示。已知Ga与Al的化学性质相似,Ga的熔点为29.8℃,沸点为:2403℃。下列说法错误的是
)制备GaN的工艺流程如图所示。已知Ga与Al的化学性质相似,Ga的熔点为29.8℃,沸点为:2403℃。下列说法错误的是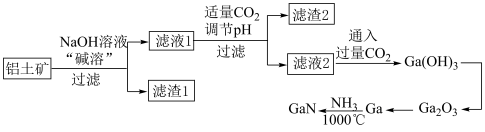
| A.过滤时需用到的硅酸盐材质仪器为烧杯、漏斗、玻璃棒 |
B.滤液1中主要含有的阴离子为 、 、 、 、 |
C.滤液2中得到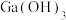 时发生反应的离子方程式为 时发生反应的离子方程式为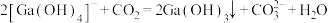 |
D.Ga与 反应生成GaN时,参与反应的氧化剂与还原剂的物质的量之比为1∶1 反应生成GaN时,参与反应的氧化剂与还原剂的物质的量之比为1∶1 |
您最近一年使用:0次
7日内更新
|
116次组卷
|
2卷引用:河南省创新发展联盟2023-2024学年高一下学期5月月考化学试题
5 . 某化学兴趣小组为了探究 的性质,设计了如图所示的实验装置:
的性质,设计了如图所示的实验装置: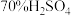 溶液的仪器名称是
溶液的仪器名称是_______ ;
(2)实验观察到装置C中产生淡黄色沉淀,该反应的化学方程式是_______ ;该反应氧化剂与还原剂物质的量之比是_______ ;
(3)实验观察到装置B、D、E中溶液均褪色,其中体现 还原性的是
还原性的是_______ (填标号)装置,体现 漂白性的是
漂白性的是_______ (填标号)装置;
(4)酸性 溶液可用于测定空气中
溶液可用于测定空气中 的含量。化学兴趣小组的同学将空气样品经过管道以
的含量。化学兴趣小组的同学将空气样品经过管道以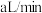 的流速通入密闭容器中的
的流速通入密闭容器中的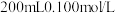 的酸性
的酸性 溶液,经过
溶液,经过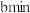 溶液恰好褪色,假定样品中的
溶液恰好褪色,假定样品中的 被
被 溶液充分氧化吸收。
溶液充分氧化吸收。
① 与酸性
与酸性 溶液反应的离子方程式为
溶液反应的离子方程式为_______ ;
②该空气样品中 的含量是
的含量是_______  。
。
 的性质,设计了如图所示的实验装置:
的性质,设计了如图所示的实验装置: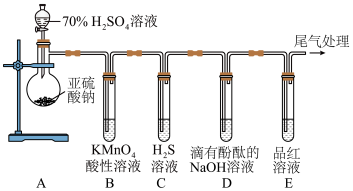
 溶液的仪器名称是
溶液的仪器名称是(2)实验观察到装置C中产生淡黄色沉淀,该反应的化学方程式是
(3)实验观察到装置B、D、E中溶液均褪色,其中体现
 还原性的是
还原性的是 漂白性的是
漂白性的是(4)酸性
 溶液可用于测定空气中
溶液可用于测定空气中 的含量。化学兴趣小组的同学将空气样品经过管道以
的含量。化学兴趣小组的同学将空气样品经过管道以 的流速通入密闭容器中的
的流速通入密闭容器中的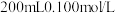 的酸性
的酸性 溶液,经过
溶液,经过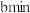 溶液恰好褪色,假定样品中的
溶液恰好褪色,假定样品中的 被
被 溶液充分氧化吸收。
溶液充分氧化吸收。①
 与酸性
与酸性 溶液反应的离子方程式为
溶液反应的离子方程式为②该空气样品中
 的含量是
的含量是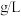 。
。
您最近一年使用:0次
名校
解题方法
6 . A、M、Q、R、T、W、X、Y、Z为前四周期原子序数依次增大的常见元素.A的原子半径在元素周期表中最小;Q的一种核素可用于测定文物年代;W的单质氧化性最强;M与X的价电子数相等,X的价电子数等于周期序数;Y与Q同主族;Z的白色氢氧化物在空气中会迅速变成灰绿色,最后变成红褐色.请回答下列问题:
(1)M的元素名称___________ ;Q可用于测定文物年代的核素是___________ (填核素符号);
(2)Z在元素周期表中的位置___________ ;
(3)T、W、X的简单离子半径从大到小的顺序为___________ (用离子符号表示)
(4)Y的氧化物与AW反应的化学方程式___________ ;
(5)工业上通过还原Y的氧化物制备Y单质的粗品,其化学方程式为:___________ ;
(6)离子化合物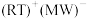 常用于合成有机物,其阴离子的电子式为
常用于合成有机物,其阴离子的电子式为___________ ;
(7)铝热法还原Z的红棕色氧化物制备Z单质的化学方程式为:___________ ;
(8)一定条件下,Z单质与一定量硝酸恰好完全反应,同时生成两种气体,且两种气体的量相同;向反应后的溶液中加入铜片,铜片不溶解.写出该反应的离子方程式:___________ ;
(1)M的元素名称
(2)Z在元素周期表中的位置
(3)T、W、X的简单离子半径从大到小的顺序为
(4)Y的氧化物与AW反应的化学方程式
(5)工业上通过还原Y的氧化物制备Y单质的粗品,其化学方程式为:
(6)离子化合物
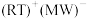 常用于合成有机物,其阴离子的电子式为
常用于合成有机物,其阴离子的电子式为(7)铝热法还原Z的红棕色氧化物制备Z单质的化学方程式为:
(8)一定条件下,Z单质与一定量硝酸恰好完全反应,同时生成两种气体,且两种气体的量相同;向反应后的溶液中加入铜片,铜片不溶解.写出该反应的离子方程式:
您最近一年使用:0次
7 . 某化学自主实验小组利用如图所示装置(K1、K2为止水夹,夹持装置已略去)探究NO2能否被NH3还原。
(1)a仪器名称为_______ 。
(2)甲中盛放的试剂的名称是_______ ,乙中盛放的试剂的化学式为_______ 。
(3)C中铜与浓硝酸反应时,体现的浓硝酸的性质为_______ ,C中实验现象为_______ 。
(4)实验过程中观察到B中红棕色气体逐渐变淡至无色,经检测发现尾气中的有害气体只有未完全反应的反应物,则B中发生反应的化学方程式为_______ ,其中n(还原产物):n(氧化产物)=_______ 。
(5)NaOH溶液可吸收过量的NO2,二者反应生成两种钠盐,则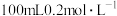 NaOH溶液最多能吸收
NaOH溶液最多能吸收_______ mol NO2.(忽略气体在水中的溶解及气体与水的反应)

(1)a仪器名称为
(2)甲中盛放的试剂的名称是
(3)C中铜与浓硝酸反应时,体现的浓硝酸的性质为
(4)实验过程中观察到B中红棕色气体逐渐变淡至无色,经检测发现尾气中的有害气体只有未完全反应的反应物,则B中发生反应的化学方程式为
(5)NaOH溶液可吸收过量的NO2,二者反应生成两种钠盐,则
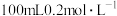 NaOH溶液最多能吸收
NaOH溶液最多能吸收
您最近一年使用:0次
名校
解题方法
8 . 有机化合物A在生产生活中具有重要的价值, 研究其结构及性质具有非常重要的意义。
Ⅰ.测定分子组成
取4.6g有机化合物A在足量氧气中完全燃烧,生成0.3 mol H2O和0.2 mol CO2
(1)该有机化合物的实验式是___________ 。
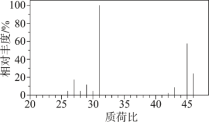
Ⅱ.确定分子式
该有机化合物的质谱信息如图。___________ 。
Ⅲ.确定结构简式
有机化合物A的核磁共振氢谱有3组峰,峰面积之比为1:2:3。
(3)A的结构简式是___ 。
Ⅳ.解释性质
(4)有机化合物A能与水互溶的原因是A与水形成分子间氢键。在方框中画出1个A分子中两个不同的原子分别与H2O形成的氢键________ (氢键用“…”表示)。
① 酸性条件下,向V mL A溶液中加入 V1 mL c1 mol·L-1 K2Cr2O7溶液。A被氧化为B(B比A少2个氢原子,多1个氧原子),Cr2O 被还原为Cr3+
被还原为Cr3+
② 充分反应后,向①中加入过量KI溶液。
( )
)
③ 向②反应后的溶液中滴加c2 mol·L-1 Na2S2O3溶液,达到滴定终点时,消耗的体积为V2 mL( )。
)。
(5)①中参与反应的A与K2Cr2O7的物质的量之比是___________ 。
(6)结合实验数据,得cA =___________ mol·L-1(用代数式表示)。
Ⅰ.测定分子组成
取4.6g有机化合物A在足量氧气中完全燃烧,生成0.3 mol H2O和0.2 mol CO2
(1)该有机化合物的实验式是
Ⅱ.确定分子式
该有机化合物的质谱信息如图。
Ⅲ.确定结构简式
有机化合物A的核磁共振氢谱有3组峰,峰面积之比为1:2:3。
(3)A的结构简式是
Ⅳ.解释性质
(4)有机化合物A能与水互溶的原因是A与水形成分子间氢键。在方框中画出1个A分子中两个不同的原子分别与H2O形成的氢键

① 酸性条件下,向V mL A溶液中加入 V1 mL c1 mol·L-1 K2Cr2O7溶液。A被氧化为B(B比A少2个氢原子,多1个氧原子),Cr2O
 被还原为Cr3+
被还原为Cr3+② 充分反应后,向①中加入过量KI溶液。
(
 )
)③ 向②反应后的溶液中滴加c2 mol·L-1 Na2S2O3溶液,达到滴定终点时,消耗的体积为V2 mL(
 )。
)。(5)①中参与反应的A与K2Cr2O7的物质的量之比是
(6)结合实验数据,得cA =
您最近一年使用:0次
9 . 双氧水常被称为化学反应中的“绿色试剂”。已知,在双氧水中加入少量 溶液,
溶液, 会较快分解,反应如下:
会较快分解,反应如下:
反应①: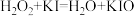 ;
;
反应②: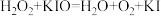 。
。
回答下列问题:
1.上述反应中属于强电解质的是_____。
2.下列离子在溶液中能大量共存的是_____。
3.标出反应②中的电子转移方向和数目_____ 。
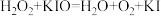
4. 分解过程中,
分解过程中, 的作用是
的作用是_____ 。
5. 是一种二元弱酸,写出第一步电离的电离方程式
是一种二元弱酸,写出第一步电离的电离方程式_____ 。
6.根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是_____ 。
7.油画变黑,可用一定浓度的 溶液擦洗修复,发生的反应为
溶液擦洗修复,发生的反应为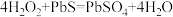 ,下列说法正确的是_____。
,下列说法正确的是_____。
8.向 溶液中通入
溶液中通入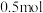 碘单质恰好完全反应生成三种含碘盐:
碘单质恰好完全反应生成三种含碘盐: 和X。则X是_____。
和X。则X是_____。
 溶液,
溶液, 会较快分解,反应如下:
会较快分解,反应如下:反应①:
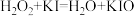 ;
;反应②:
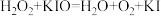 。
。回答下列问题:
1.上述反应中属于强电解质的是_____。
A. | B. | C.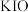 | D. |
A.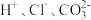 | B.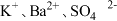 |
C. | D.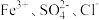 |
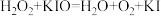
4.
 分解过程中,
分解过程中, 的作用是
的作用是5.
 是一种二元弱酸,写出第一步电离的电离方程式
是一种二元弱酸,写出第一步电离的电离方程式6.根据反应①和反应②,请说明双氧水被称为“绿色试剂”的主要原因是
7.油画变黑,可用一定浓度的
 溶液擦洗修复,发生的反应为
溶液擦洗修复,发生的反应为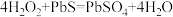 ,下列说法正确的是_____。
,下列说法正确的是_____。A. 是氧化产物 是氧化产物 | B. 被还原 被还原 |
C. 是氧化剂 是氧化剂 | D. 体现还原性 体现还原性 |
 溶液中通入
溶液中通入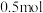 碘单质恰好完全反应生成三种含碘盐:
碘单质恰好完全反应生成三种含碘盐: 和X。则X是_____。
和X。则X是_____。A.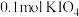 | B.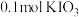 | C.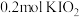 | D.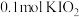 |
您最近一年使用:0次
名校
解题方法
10 . 白合金是铜钴矿冶炼过程的中间产物,主要含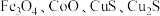 和少量
和少量 .一种从白合金中分离回收各类金属的具体流程及操作如图所示:
.一种从白合金中分离回收各类金属的具体流程及操作如图所示:
(1) 中铁元素的化合价为
中铁元素的化合价为___________ ;
(2)向溶液1中加入 的作用是
的作用是___________ ;
(3)焙烧1中发生反应的化学方程式为___________ ;
(4)固体3的成分为___________ (填化学式);
(5)焙烧2中 发生反应的化学方程式为
发生反应的化学方程式为___________ ;
(6)对18.3g沉钴所得的 固体在空气中进行高温灼烧,最终可以得到一种钴的氧化物.灼烧过程中,固体质量随温度的变化曲线如图:
固体在空气中进行高温灼烧,最终可以得到一种钴的氧化物.灼烧过程中,固体质量随温度的变化曲线如图:___________ (填化学式);
②该过程中CD段发生反应的化学方程式为___________ 。
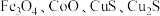 和少量
和少量 .一种从白合金中分离回收各类金属的具体流程及操作如图所示:
.一种从白合金中分离回收各类金属的具体流程及操作如图所示:
| 金属离子 |  |  |  |
| 完全沉淀时的pH | 9.0 | 3.2 | 9.0 |
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)向溶液1中加入
 的作用是
的作用是(3)焙烧1中发生反应的化学方程式为
(4)固体3的成分为
(5)焙烧2中
 发生反应的化学方程式为
发生反应的化学方程式为(6)对18.3g沉钴所得的
 固体在空气中进行高温灼烧,最终可以得到一种钴的氧化物.灼烧过程中,固体质量随温度的变化曲线如图:
固体在空气中进行高温灼烧,最终可以得到一种钴的氧化物.灼烧过程中,固体质量随温度的变化曲线如图:
②该过程中CD段发生反应的化学方程式为
您最近一年使用:0次



