真题
解题方法
1 . 铍用于宇航器件的构筑。一种从其铝硅酸盐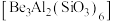 中提取铍的路径为:
中提取铍的路径为: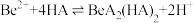
回答下列问题:
(1)基态 的轨道表示式为
的轨道表示式为_______ 。
(2)为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是_______ 。
(3)“萃取分液”的目的是分离 和
和 ,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是
,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是_______ 。
(4)写出反萃取生成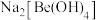 的化学方程式
的化学方程式_______ 。“滤液2”可以进入_______ 步骤再利用。
(5)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是_______ 。
(6) 与醋酸反应得到某含4个
与醋酸反应得到某含4个 的配合物,4个
的配合物,4个 位于以1个O原子为中心的四面体的4个顶点,且每个
位于以1个O原子为中心的四面体的4个顶点,且每个 的配位环境相同,
的配位环境相同, 与
与 间通过
间通过 相连,其化学式为
相连,其化学式为_______ 。
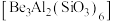 中提取铍的路径为:
中提取铍的路径为: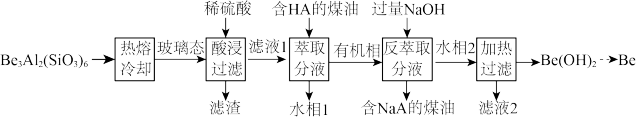
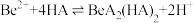
回答下列问题:
(1)基态
 的轨道表示式为
的轨道表示式为(2)为了从“热熔、冷却”步骤得到玻璃态,冷却过程的特点是
(3)“萃取分液”的目的是分离
 和
和 ,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是
,向过量烧碱溶液中逐滴加入少量“水相1”的溶液,观察到的现象是(4)写出反萃取生成
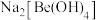 的化学方程式
的化学方程式(5)电解熔融氯化铍制备金属铍时,加入氯化钠的主要作用是
(6)
 与醋酸反应得到某含4个
与醋酸反应得到某含4个 的配合物,4个
的配合物,4个 位于以1个O原子为中心的四面体的4个顶点,且每个
位于以1个O原子为中心的四面体的4个顶点,且每个 的配位环境相同,
的配位环境相同, 与
与 间通过
间通过 相连,其化学式为
相连,其化学式为
您最近一年使用:0次
真题
解题方法
2 . 氢能是理想清洁能源,氢能产业链由制氢、储氢和用氢组成。
(1)利用铁及其氧化物循环制氢,原理如图所示。反应器Ⅰ中化合价发生改变的元素有_______ ;含CO和 各1mol的混合气体通过该方法制氢,理论上可获得
各1mol的混合气体通过该方法制氢,理论上可获得_______ 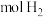 。
。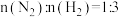 混合匀速通入合成塔,发生反应
混合匀速通入合成塔,发生反应 。海绵状的
。海绵状的 作催化剂,多孔
作催化剂,多孔 作为
作为 的“骨架”和气体吸附剂。
的“骨架”和气体吸附剂。
① 中含有CO会使催化剂中毒。
中含有CO会使催化剂中毒。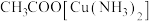 和氨水的混合溶液能吸收CO生成
和氨水的混合溶液能吸收CO生成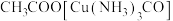 溶液,该反应的化学方程式为
溶液,该反应的化学方程式为_______ 。
② 含量与
含量与 表面积、出口处氨含量关系如图所示。
表面积、出口处氨含量关系如图所示。 含量大于
含量大于 ,出口处氨含量下降的原因是
,出口处氨含量下降的原因是_______ 。 可用于储氢。
可用于储氢。
①密闭容器中,其他条件不变,向含有催化剂的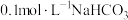 溶液中通入
溶液中通入 ,
, 产率随温度变化如图所示。温度高于
产率随温度变化如图所示。温度高于 ,
, 产率下降的可能原因是
产率下降的可能原因是_______ 。 ,CN是一种碳衍生材料)联合
,CN是一种碳衍生材料)联合 催化剂储氢,可能机理如图所示。氨基能将
催化剂储氢,可能机理如图所示。氨基能将 控制在催化剂表面,其原理是
控制在催化剂表面,其原理是_______ ;用重氢气(D2)代替H2,通过检测是否存在_______ (填化学式)确认反应过程中的加氢方式。
(1)利用铁及其氧化物循环制氢,原理如图所示。反应器Ⅰ中化合价发生改变的元素有
 各1mol的混合气体通过该方法制氢,理论上可获得
各1mol的混合气体通过该方法制氢,理论上可获得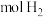 。
。
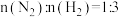 混合匀速通入合成塔,发生反应
混合匀速通入合成塔,发生反应 。海绵状的
。海绵状的 作催化剂,多孔
作催化剂,多孔 作为
作为 的“骨架”和气体吸附剂。
的“骨架”和气体吸附剂。①
 中含有CO会使催化剂中毒。
中含有CO会使催化剂中毒。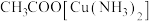 和氨水的混合溶液能吸收CO生成
和氨水的混合溶液能吸收CO生成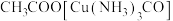 溶液,该反应的化学方程式为
溶液,该反应的化学方程式为②
 含量与
含量与 表面积、出口处氨含量关系如图所示。
表面积、出口处氨含量关系如图所示。 含量大于
含量大于 ,出口处氨含量下降的原因是
,出口处氨含量下降的原因是
 可用于储氢。
可用于储氢。①密闭容器中,其他条件不变,向含有催化剂的
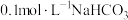 溶液中通入
溶液中通入 ,
, 产率随温度变化如图所示。温度高于
产率随温度变化如图所示。温度高于 ,
, 产率下降的可能原因是
产率下降的可能原因是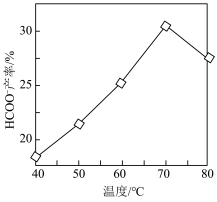
 ,CN是一种碳衍生材料)联合
,CN是一种碳衍生材料)联合 催化剂储氢,可能机理如图所示。氨基能将
催化剂储氢,可能机理如图所示。氨基能将 控制在催化剂表面,其原理是
控制在催化剂表面,其原理是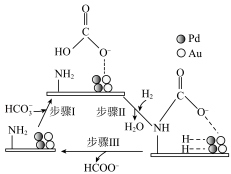
您最近一年使用:0次
名校
解题方法
3 . 从废弃的声光器件( ,含Al、Cu、
,含Al、Cu、 杂质)中提取粗碲的工艺流程如图,已知
杂质)中提取粗碲的工艺流程如图,已知 性质与
性质与 相似,氧化沉碲得
相似,氧化沉碲得 ,下列说法错误的是
,下列说法错误的是
 ,含Al、Cu、
,含Al、Cu、 杂质)中提取粗碲的工艺流程如图,已知
杂质)中提取粗碲的工艺流程如图,已知 性质与
性质与 相似,氧化沉碲得
相似,氧化沉碲得 ,下列说法错误的是
,下列说法错误的是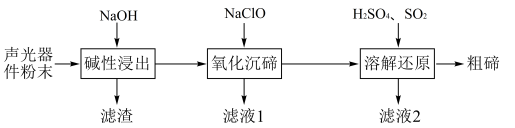
| A.滤渣的主要成分为Cu |
| B.滤液1和滤液2混合可能产生白色沉淀 |
C.“氧化沉碲”中离子方程式为 |
D.“溶解还原”中氧化剂和还原剂的物质的量之比为 |
您最近一年使用:0次
4 .  含量是衡量水质的重要指标之一。一种
含量是衡量水质的重要指标之一。一种 的测定原理是在酸性条件下
的测定原理是在酸性条件下 与I-反应生成I2与NO等。具体反应历程如下:
与I-反应生成I2与NO等。具体反应历程如下:
①NO +2H+=NO++H2O;②……;③2NOI=I2+2NO
+2H+=NO++H2O;②……;③2NOI=I2+2NO
(1)写出反应②的离子方程式_______ 。
(2)反应过程中,观察到溶液的颜色和气体的颜色描述正确的是_______ 。
(3)设计实验检验上述I-是否完全转化为I2(包括实验试剂、步骤、现象、结论)_______ 。
 含量是衡量水质的重要指标之一。一种
含量是衡量水质的重要指标之一。一种 的测定原理是在酸性条件下
的测定原理是在酸性条件下 与I-反应生成I2与NO等。具体反应历程如下:
与I-反应生成I2与NO等。具体反应历程如下:①NO
 +2H+=NO++H2O;②……;③2NOI=I2+2NO
+2H+=NO++H2O;②……;③2NOI=I2+2NO(1)写出反应②的离子方程式
(2)反应过程中,观察到溶液的颜色和气体的颜色描述正确的是
| 选项 | A | B | C | D |
| 溶液颜色 | 棕黄色 | 紫色 | 棕黄色 | 紫色 |
| 气体颜色 | 无色 | 无色 | 无色迅速变为红棕色 | 无色迅速变为红棕色 |
您最近一年使用:0次
5 . 含NO 的废水可用黄铁矿(主要成分为FeS2)处理,在细菌作用下发生以下反应。
的废水可用黄铁矿(主要成分为FeS2)处理,在细菌作用下发生以下反应。
(1)请完成下列离子方程式______ 。
6NO +_______FeS2+_______H+=3N2↑+2Fe3++
+_______FeS2+_______H+=3N2↑+2Fe3++ _______+
_______+ _______
_______
(2)当上述反应生成标准状况6.72L气体时,转移电子数为______ 个。
 的废水可用黄铁矿(主要成分为FeS2)处理,在细菌作用下发生以下反应。
的废水可用黄铁矿(主要成分为FeS2)处理,在细菌作用下发生以下反应。(1)请完成下列离子方程式
6NO
 +_______FeS2+_______H+=3N2↑+2Fe3++
+_______FeS2+_______H+=3N2↑+2Fe3++ _______+
_______+ _______
_______(2)当上述反应生成标准状况6.72L气体时,转移电子数为
您最近一年使用:0次
真题
6 . 贵金属银应用广泛。Ag与稀 制得
制得 ,常用于循环处理高氯废水。
,常用于循环处理高氯废水。
(1)沉淀 。在高氯水样中加入
。在高氯水样中加入 使
使 浓度约为
浓度约为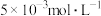 ,当滴加
,当滴加 溶液至开始产生
溶液至开始产生 沉淀(忽略滴加过程的体积增加),此时溶液中
沉淀(忽略滴加过程的体积增加),此时溶液中 浓度约为
浓度约为_______  。[已知:
。[已知: ,
, ]
]
(2)还原 。在
。在 沉淀中埋入铁圈并压实,加入足量
沉淀中埋入铁圈并压实,加入足量 盐酸后静置,充分反应得到Ag。
盐酸后静置,充分反应得到Ag。
①铁将 转化为单质Ag的化学方程式为
转化为单质Ag的化学方程式为_______ 。
②不与铁圈直接接触的 也能转化为Ag的原因是
也能转化为Ag的原因是_______ 。
③为判断 是否完全转化,补充完整实验方案:取出铁圈,搅拌均匀,取少量混合物过滤,
是否完全转化,补充完整实验方案:取出铁圈,搅拌均匀,取少量混合物过滤,_______ [实验中必须使用的试剂和设备:稀 、
、 溶液,通风设备]
溶液,通风设备]
(3)Ag的抗菌性能。纳米Ag表面能产生 杀死细菌(如图所示),其抗菌性能受溶解氧浓度影响。
杀死细菌(如图所示),其抗菌性能受溶解氧浓度影响。 的离子方程式为
的离子方程式为_______ 。
②实验表明溶解氧浓度过高,纳米Ag的抗菌性能下降,主要原因是_______ 。
 制得
制得 ,常用于循环处理高氯废水。
,常用于循环处理高氯废水。(1)沉淀
 。在高氯水样中加入
。在高氯水样中加入 使
使 浓度约为
浓度约为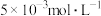 ,当滴加
,当滴加 溶液至开始产生
溶液至开始产生 沉淀(忽略滴加过程的体积增加),此时溶液中
沉淀(忽略滴加过程的体积增加),此时溶液中 浓度约为
浓度约为 。[已知:
。[已知: ,
, ]
](2)还原
 。在
。在 沉淀中埋入铁圈并压实,加入足量
沉淀中埋入铁圈并压实,加入足量 盐酸后静置,充分反应得到Ag。
盐酸后静置,充分反应得到Ag。①铁将
 转化为单质Ag的化学方程式为
转化为单质Ag的化学方程式为②不与铁圈直接接触的
 也能转化为Ag的原因是
也能转化为Ag的原因是③为判断
 是否完全转化,补充完整实验方案:取出铁圈,搅拌均匀,取少量混合物过滤,
是否完全转化,补充完整实验方案:取出铁圈,搅拌均匀,取少量混合物过滤, 、
、 溶液,通风设备]
溶液,通风设备](3)Ag的抗菌性能。纳米Ag表面能产生
 杀死细菌(如图所示),其抗菌性能受溶解氧浓度影响。
杀死细菌(如图所示),其抗菌性能受溶解氧浓度影响。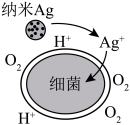
 的离子方程式为
的离子方程式为②实验表明溶解氧浓度过高,纳米Ag的抗菌性能下降,主要原因是
您最近一年使用:0次
名校
7 . 碘酸钾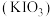 是常用的食盐加碘剂,用
是常用的食盐加碘剂,用 氧化
氧化 得到
得到 溶液,再经一系列步骤得到
溶液,再经一系列步骤得到 产品。
产品。 是一种白色晶体,在水中溶解度随温度升高而增大。
是一种白色晶体,在水中溶解度随温度升高而增大。
下列说法错误的是
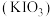 是常用的食盐加碘剂,用
是常用的食盐加碘剂,用 氧化
氧化 得到
得到 溶液,再经一系列步骤得到
溶液,再经一系列步骤得到 产品。
产品。
 是一种白色晶体,在水中溶解度随温度升高而增大。
是一种白色晶体,在水中溶解度随温度升高而增大。下列说法错误的是
A.水浴加热时发生反应的离子方程式为 |
| B.滴入适量乙醇的作用是除去多余的高锰酸钾 |
| C.为提高洗涤效果,可用热水进行洗涤 |
| D.在冷却结晶时,温度过低可能导致产品的纯度降低 |
您最近一年使用:0次
真题
8 . 劳动人民的发明创造是中华优秀传统文化的组成部分。下列化学原理描述错误的是
| 发明 | 关键操作 | 化学原理 | |
| A | 制墨 | 松木在窑内焖烧 | 发生不完全燃烧 |
| B | 陶瓷 | 黏土高温烧结 | 形成新的化学键 |
| C | 造纸 | 草木灰水浸泡树皮 | 促进纤维素溶解 |
| D | 火药 | 硫黄、硝石和木炭混合,点燃 | 发生氧化还原反应 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
名校
解题方法
9 . 焦亚硫酸钠(Na2S2O5)是一种重要的化工原料。工业上,以黄铁矿(主要成分FeS2)生产硫酸的尾气为原料制备焦亚硫酸钠的一种流程如下图所示:
(1)FeS2中铁元素的化合价为_______ 。
(2)“煅烧”时,主要反应的化学方程式为_______ 。
(3)将含有少量SO2的尾气通入烧碱溶液中,反应的离子方程式是_______ 。
(4)因为Na2S2O5具有_______ 性,长期放置Na2S2O5样品会不可避免地存在Na2SO4,检验其中含有SO 的试剂是
的试剂是_______ 。
(5)Na2S2O5可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中Na2S2O5的含量。请配平该反应的化学方程式_______
_______I2+ _______S2O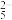 + _______H2O = _______I- + _______SO
+ _______H2O = _______I- + _______SO + _______H+
+ _______H+
在测定某葡萄酒中Na2S2O5的含量时,取100.00mL葡萄酒样品,消耗0.01mol/L 碘标准液20.00mL 。样品中Na2S2O5的含量为_______ g/L。

(1)FeS2中铁元素的化合价为
(2)“煅烧”时,主要反应的化学方程式为
(3)将含有少量SO2的尾气通入烧碱溶液中,反应的离子方程式是
(4)因为Na2S2O5具有
 的试剂是
的试剂是(5)Na2S2O5可用于葡萄酒的抗氧化剂,用碘标准液可以测定葡萄酒中Na2S2O5的含量。请配平该反应的化学方程式
_______I2+ _______S2O
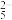 + _______H2O = _______I- + _______SO
+ _______H2O = _______I- + _______SO + _______H+
+ _______H+在测定某葡萄酒中Na2S2O5的含量时,取100.00mL葡萄酒样品,消耗0.01mol/L 碘标准液20.00mL 。样品中Na2S2O5的含量为
您最近一年使用:0次
解题方法
10 . 电子工业常用覆铜板为基础材料制作印刷电路板。现取一定质量的覆铜板,用油性笔画上设计好的图案,浸入盛有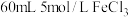 ,溶液的小烧杯中,一段时间后,取出,用水洗净、干燥,经称量覆铜板质量减轻
,溶液的小烧杯中,一段时间后,取出,用水洗净、干燥,经称量覆铜板质量减轻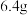 。请计算:
。请计算:
(1) 的物质的量是
的物质的量是_______ mol。
(2)反应过程中,转移电子总数为_______  。
。
(3)为使使用后的“腐蚀液”中金属阳离子完全沉淀,至少需要加入物质的量浓度为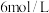 的
的 溶液
溶液_______ mL。
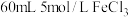 ,溶液的小烧杯中,一段时间后,取出,用水洗净、干燥,经称量覆铜板质量减轻
,溶液的小烧杯中,一段时间后,取出,用水洗净、干燥,经称量覆铜板质量减轻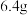 。请计算:
。请计算:(1)
 的物质的量是
的物质的量是(2)反应过程中,转移电子总数为
 。
。(3)为使使用后的“腐蚀液”中金属阳离子完全沉淀,至少需要加入物质的量浓度为
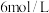 的
的 溶液
溶液
您最近一年使用:0次



