解题方法
1 . 某化学小组探究硫酸铁铵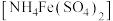 与
与 、
、 的反应。
的反应。
已知: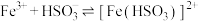 (棕红)
(棕红)
(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为___________ 。
②由实验Ⅰ可得出与 结合的能力:
结合的能力:
___________  (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。
(2)资料显示, 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
①实验Ⅲ中 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为___________ 。
②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因___________ 。
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。
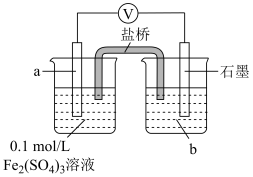
①a、b分别是___________ 。
②结合电极反应解释步骤3中电压表示数减小的原因___________ 。
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因___________ 。
(4)综合以上实验,盐溶液间反应的多样性与___________ 有关。
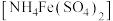 与
与 、
、 的反应。
的反应。| 实验 | 操作 | 现象 |
| Ⅰ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入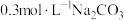 溶液 溶液 | 迅速产生大量红褐色沉淀和大量气泡;继续滴加,当气泡量明显减少时,试管口的湿润红色石蕊试纸开始逐渐变蓝 |
| Ⅱ | 向2mL 溶液(pH=2.03)中逐滴加入 溶液(pH=2.03)中逐滴加入 溶液 溶液 | 溶液立即变棕红(无丁达尔现象),继续滴加 溶液至过量,溶液依然为棕红色,放置两天无明显变化 溶液至过量,溶液依然为棕红色,放置两天无明显变化 |
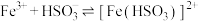 (棕红)
(棕红)(1)①实验Ⅰ中产生红褐色沉淀与气泡的离子方程式为
②由实验Ⅰ可得出与
 结合的能力:
结合的能力:
 (填“>”、“<”、“=”)。
(填“>”、“<”、“=”)。(2)资料显示,
 可以氧化
可以氧化 。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。
。针对实验Ⅱ中的现象,小组同学又设计并实施了如下实验。| 实验 | 操作 | 现象 |
| Ⅲ | 向2mL 溶液(pH=1.78)中加入0.5mL 溶液(pH=1.78)中加入0.5mL 溶液 溶液 | 溶液立即变棕红色,约2小时后,棕红色变为黄色,检测到 |
| Ⅳ | 向2mL 溶液(pH=2.03)中加入0.5mL 溶液(pH=2.03)中加入0.5mL 溶液 溶液 | 溶液立即变棕红色,约5小时后,棕红色变为黄色,检测到 |
 与
与 反应生成
反应生成 的离子方程式为
的离子方程式为②结合化学反应原理解释实验Ⅱ、Ⅳ中现象存在差异的可能原因
(3)针对实验Ⅲ、Ⅳ的现象差异,小组同学提出猜想:pH影响了
 的氧化性或
的氧化性或 的还原性,并实施实验。
的还原性,并实施实验。| 实验 | 实验装置 | 实验步骤及现象 |
| Ⅴ |
| 1.按如图搭好装置,接通电路,电压表读数为0.6V; 2.向a电极附近滴加3滴10%稀硫酸,电压表读数不变; 3.向石墨电极附近滴加3滴10%稀硫酸,电压表读数变为0.5V。 |
②结合电极反应解释步骤3中电压表示数减小的原因
③补充实验Ⅵ:向实验Ⅱ得到的棕红色液体中加入3滴10%稀硫酸,棕红色迅速变黄,检测到
 。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因
。结合化学用语解释实验Ⅵ中氧化还原反应明显加快的可能原因(4)综合以上实验,盐溶液间反应的多样性与
您最近一年使用:0次
解题方法
2 . 铅(Pb)及其化合物广泛用于冶金、蓄电池、印刷、颜料、油漆等领域,常见铅的化合物主要以+2价和+4价的形态存在。经查阅资料:
已知:①Pb与酸反应都得到+2价的化合物。
②PbCl4不稳定,易分解为PbCl2和Cl2。
回答下列问题:
(1)Pb是较活泼金属,但在实验室或化工厂常用Pb作为某些酸(如稀硫酸)的耐酸反应器的衬里和贮存、输送的管道设备。请解释其原因___________ 。
(2)PbSO4可用于制造蓄电池、白色颜料等。写出用钠盐制备PbSO4的化学方程式___________ 。
(3)PbO2在强酸性条件下能与Mn2+反应生成Pb2+和 ,反应的离子方程式为
,反应的离子方程式为 ___________ ,该反应说明PbO2具有 ___________ (填“氧化性”或“还原性”)。
(4)经查阅,PbO2是两性氧化物,设计实验并验证
| 物质 | PbO | PbO2 | PbCl2 | PbCl+4 |
| 在水中的溶解性(常温) | 难溶于水的黄色固体 | 难溶于水的棕黑色固体 | 微溶于水的白色固体 | 易溶于水的黄色油状液体 |
| 物质 | PbSO4 | Pb(NO3)2 | Na2PbO2 | Na2PbO3 |
| 在水中的溶解性(常温) | 难溶于水的白色固体 | 易溶于水形成无色溶液 | 易溶于水形成无色溶液 | 易溶于水形成无色溶液 |
②PbCl4不稳定,易分解为PbCl2和Cl2。
回答下列问题:
(1)Pb是较活泼金属,但在实验室或化工厂常用Pb作为某些酸(如稀硫酸)的耐酸反应器的衬里和贮存、输送的管道设备。请解释其原因
(2)PbSO4可用于制造蓄电池、白色颜料等。写出用钠盐制备PbSO4的化学方程式
(3)PbO2在强酸性条件下能与Mn2+反应生成Pb2+和
 ,反应的离子方程式为
,反应的离子方程式为 (4)经查阅,PbO2是两性氧化物,设计实验并验证
| 实验步骤 | 实验现象 | 反应的化学方程式 |
| ①向盛有PbO2固体的试管中滴加NaOH溶液 | 棕黑色固体逐渐溶解 | |
| ②向盛有PbO2固体的试管中滴加稀盐酸 |
您最近一年使用:0次
解题方法
3 . 某小组探究铜与浓硝酸的反应。
【实验】
(1)铜与浓硝酸反应的化学方程式是_______ ,氢氧化钠溶液的作用是_______ 。
小组同学继续探究溶液呈鲜草绿色的原因。
甲同学提出猜想:因为气体溶解后,溶液颜色和气体颜色叠加形成鲜草绿色,设计实1-1及1-2进行验证。
实验1-1:取 反应后混合液于一支试管内,按一定的气体流速将
反应后混合液于一支试管内,按一定的气体流速将 和
和 混合气体通入,有大量红棕色气体逸出,约
混合气体通入,有大量红棕色气体逸出,约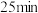 后溶液转为蓝色。
后溶液转为蓝色。
实验1-2:取 反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约
反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约 后溶液转为蓝色
后溶液转为蓝色
(2)乙同学根据以上2个实验的现象证明甲同学的猜想不成立,依据的现象是_______ 。
【查阅资料】
i.铜与浓硝酸反应,开始生成的 溶于水生成
溶于水生成 ,
, 与Cu2+反应生成绿色的化合物;
与Cu2+反应生成绿色的化合物;
ii.一定条件下,Cu2+既可以表现氧化性,又可以表现还原性;
iii.尿素 具有温和的抗氧化性;
具有温和的抗氧化性;
iv.金属和浓硝酸反应过程中有 生成,可大大加快金属与浓硝酸反应的速率。
生成,可大大加快金属与浓硝酸反应的速率。
其原理为:
第一步: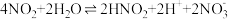
第二步: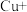 …
…
第三步:
【设计实验】
分别向四支试管内依次加入下列试剂后,同时插入铜丝并记录实验现象。
(3)补全iv中原理的第二步反应:_______ 。
(4)实验2-3中没有绿色出现的原因是_______ 。
(5)因为发生化学反应:_______ 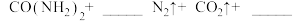 ,因此实验2-4中反应速率较慢。
,因此实验2-4中反应速率较慢。
(6)解释实验1-1和1-2的现象差异原因_______ 。
【实验】
| 实验装置(夹特仪器略) | 实验现象 |
 | 铜片溶解,最初反应较慢,随后加快,有大量红棕色气体放出,反应后试管中溶液呈现鲜草绿色 |
小组同学继续探究溶液呈鲜草绿色的原因。
甲同学提出猜想:因为气体溶解后,溶液颜色和气体颜色叠加形成鲜草绿色,设计实1-1及1-2进行验证。
实验1-1:取
 反应后混合液于一支试管内,按一定的气体流速将
反应后混合液于一支试管内,按一定的气体流速将 和
和 混合气体通入,有大量红棕色气体逸出,约
混合气体通入,有大量红棕色气体逸出,约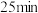 后溶液转为蓝色。
后溶液转为蓝色。实验1-2:取
 反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约
反应后混合液于另一支试管内,按与实验1-1中相同的气体流速将空气通入,有大量红棕色气体逸出,约 后溶液转为蓝色
后溶液转为蓝色(2)乙同学根据以上2个实验的现象证明甲同学的猜想不成立,依据的现象是
【查阅资料】
i.铜与浓硝酸反应,开始生成的
 溶于水生成
溶于水生成 ,
, 与Cu2+反应生成绿色的化合物;
与Cu2+反应生成绿色的化合物;ii.一定条件下,Cu2+既可以表现氧化性,又可以表现还原性;
iii.尿素
 具有温和的抗氧化性;
具有温和的抗氧化性;iv.金属和浓硝酸反应过程中有
 生成,可大大加快金属与浓硝酸反应的速率。
生成,可大大加快金属与浓硝酸反应的速率。其原理为:
第一步:
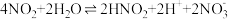
第二步:
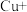 …
…第三步:

【设计实验】
分别向四支试管内依次加入下列试剂后,同时插入铜丝并记录实验现象。
| 编号 | 浓硝酸 | 蒸馏水/滴 | 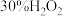 /滴 /滴 |  尿素溶液/滴 尿素溶液/滴 | 现象 |
| 2-1 | 1 | 0 | 0 | 0 | 快速反应,异常剧烈,溶液为鲜草绿色 |
| 2-2 | 1 | 3 | 0 | 0 | 快速反应,异常剧烈,溶液为鲜草绿色 |
| 2-3 | 1 | 0 | 3 | 0 | 反应较慢,溶液为蓝色,没有绿色出现 |
| 2-4 | 1 | 0 | 0 | 3 | 反应较慢,溶液为蓝色,没有绿色出现 |
(4)实验2-3中没有绿色出现的原因是
(5)因为发生化学反应:
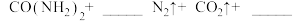 ,因此实验2-4中反应速率较慢。
,因此实验2-4中反应速率较慢。(6)解释实验1-1和1-2的现象差异原因
您最近一年使用:0次
4 . 二价锰离子在一定条件下会被氧化剂氧化成不同价态的化合物,某小组同学探究 与
与 的反应,设计如图装置。
的反应,设计如图装置。

已知:I、 (紫色)、
(紫色)、 (墨绿色)、
(墨绿色)、 (无色)、
(无色)、 (棕黑色)、
(棕黑色)、 (白色)
(白色)
ii. 的氧化性与溶液pH无关
的氧化性与溶液pH无关
(1)仪器a名称为________ ,装置A中发生反应的化学方程式为________ 。
(2)装置B中应盛放的试剂为________ ,装置D的作用为________ 。
(3)操作I中的白色沉淀缓慢变成棕黑色沉淀发生反应的化学方程式为________ 。
(4)查阅资料:在碱性溶液中 可与
可与 反应生成
反应生成 。
。
小组同学对操作II中未出现 的原因提出两种假设,并补充实验操作如下:
的原因提出两种假设,并补充实验操作如下:
假设一:可能是通入 导致溶液的碱性减弱所造成的。
导致溶液的碱性减弱所造成的。
假设二:可能是氧化剂过量,将 氧化为
氧化为 。
。
操作III.取出装置C中溶液,检测pH呈碱性。取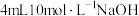 溶液于试管中,用蒸馏水稀释至与装置C中溶液相同pH,再向其中加入少量
溶液于试管中,用蒸馏水稀释至与装置C中溶液相同pH,再向其中加入少量 溶液和
溶液和 粉末,一段时间后溶液由紫色变为墨绿色;
粉末,一段时间后溶液由紫色变为墨绿色;
操作IV.将操作III的试管代替装置C接入实验装置,通入 ,溶液变为紫色。
,溶液变为紫色。
①用离子方程式表示导致溶液碱性减弱的原因为________ 。
②操作III可说明假设一________ (填“成立”或“不成立”),溶液由紫色变为墨绿色过程中发生反应的氧化剂与还原剂的物质的量之比为________ 。
(5)根据所学知识与本实验现象,对 氧化性的认识是
氧化性的认识是________ 。
 与
与 的反应,设计如图装置。
的反应,设计如图装置。
已知:I、
 (紫色)、
(紫色)、 (墨绿色)、
(墨绿色)、 (无色)、
(无色)、 (棕黑色)、
(棕黑色)、 (白色)
(白色)ii.
 的氧化性与溶液pH无关
的氧化性与溶液pH无关操作 | 现象 | |
I | 向装置C中装入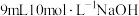 溶液和 溶液和 溶液 溶液 | 装置C中产生白色沉淀,在空气中放置一段时间缓慢变成棕黑色沉淀 |
Ⅱ | 点燃酒精灯,通入 | 装置C中棕黑色沉淀增多,一段时间后溶液变为紫色,仍有沉淀 |
(2)装置B中应盛放的试剂为
(3)操作I中的白色沉淀缓慢变成棕黑色沉淀发生反应的化学方程式为
(4)查阅资料:在碱性溶液中
 可与
可与 反应生成
反应生成 。
。小组同学对操作II中未出现
 的原因提出两种假设,并补充实验操作如下:
的原因提出两种假设,并补充实验操作如下:假设一:可能是通入
 导致溶液的碱性减弱所造成的。
导致溶液的碱性减弱所造成的。假设二:可能是氧化剂过量,将
 氧化为
氧化为 。
。操作III.取出装置C中溶液,检测pH呈碱性。取
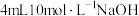 溶液于试管中,用蒸馏水稀释至与装置C中溶液相同pH,再向其中加入少量
溶液于试管中,用蒸馏水稀释至与装置C中溶液相同pH,再向其中加入少量 溶液和
溶液和 粉末,一段时间后溶液由紫色变为墨绿色;
粉末,一段时间后溶液由紫色变为墨绿色;操作IV.将操作III的试管代替装置C接入实验装置,通入
 ,溶液变为紫色。
,溶液变为紫色。①用离子方程式表示导致溶液碱性减弱的原因为
②操作III可说明假设一
(5)根据所学知识与本实验现象,对
 氧化性的认识是
氧化性的认识是
您最近一年使用:0次
2023-06-08更新
|
214次组卷
|
3卷引用:广东省深圳市六校联盟2022-2023学年高三上学期(10月)期中考试化学试题
解题方法
5 . 工业上可用过氧化氢为氧化剂浸取废旧线路板中的铜,某兴趣小组采取不同方案进行实验并研究可行性。
方案1
(1)实验结果表明,双氧水与铜可以缓慢的反应,其电极反应式可表示为
i.还原反应
ii.氧化反应_______
(2)根据电极反应式,有同学设想可以通过以下方式加快反应。
i.增大 ,增强
,增强 的氧化性
的氧化性
ii.降低_______ ,增强Cu的还原性
(3)以此为依据设计了方案2与方案3
方案2与方案3均在一定程度上加快了反应。
①方案2中,生成气体明显更剧烈的原因是_______ 。
②方案3中发生主要反应的离子方程式为_______ 。
③试评价方案2在回收铜过程的优缺点_______ 。
(4)方案3中生成沉淀会降低铜的回收率并会阻碍反应进行,进一步改进方案获得了良好效果。
试分析 的作用
的作用_______ 。
(5)小组同学通过进一步探究发现,含有 和氨水的混合溶液能继续浸取单质铜。资料:
和氨水的混合溶液能继续浸取单质铜。资料: 在水溶液中不稳定,Cu(I)在溶液中能以
在水溶液中不稳定,Cu(I)在溶液中能以 等形式稳定存在。
等形式稳定存在。
①用离子方程式表示上述反应原理_______ 。
②通常条件下,含 的溶液不能与Cu发生反应,请从氧化还原角度分析此反应能够发生的原因
的溶液不能与Cu发生反应,请从氧化还原角度分析此反应能够发生的原因_____ 。
方案1
| 实验装置 | 加入液体试剂 | 反应现象 |
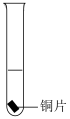 | 10mL 30%  溶液(pH约为4) 溶液(pH约为4) | 开始无明显现象,静置10小时后,溶液变为浅蓝色,铜片上有少量蓝色沉淀,之后不再有明显变化 |
i.还原反应

ii.氧化反应
(2)根据电极反应式,有同学设想可以通过以下方式加快反应。
i.增大
 ,增强
,增强 的氧化性
的氧化性ii.降低
(3)以此为依据设计了方案2与方案3
| 编号 | 加入液体试剂 | 反应现象 |
| 方案2 | 10mL30%  溶液和2mL 5mol/L 溶液和2mL 5mol/L  溶液 溶液 | 开始产生少量气泡,溶液变为蓝色,片刻后,反应越来越剧烈,甚至形成大量泡沫涌出(经检测,生成气体可使带火星木条复燃),反应后剩余铜片表面光亮 |
| 方案3 | 10mL 30%  溶液和2mL 5mol/L 氨水 溶液和2mL 5mol/L 氨水 | 生成较多气泡,溶液变为深蓝色。一段时间后,反应逐渐变慢,此时铜片上覆盖少量蓝色沉淀物。 |
①方案2中,生成气体明显更剧烈的原因是
②方案3中发生主要反应的离子方程式为
③试评价方案2在回收铜过程的优缺点
(4)方案3中生成沉淀会降低铜的回收率并会阻碍反应进行,进一步改进方案获得了良好效果。
| 编号 | 加入液体试剂 | 反应现象 |
| 方案4 | 10mL 30%  溶液 溶液2mL 5mol/L氨水 同时加入少量固体  | 生成较多气泡,溶液变为深蓝色。反应后铜片变薄且表面光亮。 |
 的作用
的作用(5)小组同学通过进一步探究发现,含有
 和氨水的混合溶液能继续浸取单质铜。资料:
和氨水的混合溶液能继续浸取单质铜。资料: 在水溶液中不稳定,Cu(I)在溶液中能以
在水溶液中不稳定,Cu(I)在溶液中能以 等形式稳定存在。
等形式稳定存在。①用离子方程式表示上述反应原理
②通常条件下,含
 的溶液不能与Cu发生反应,请从氧化还原角度分析此反应能够发生的原因
的溶液不能与Cu发生反应,请从氧化还原角度分析此反应能够发生的原因
您最近一年使用:0次
6 . 海淀黄庄某中学化学小组为探究 的性质,进行了下列实验。
的性质,进行了下列实验。
[实验一]探究 的还原性,波波做了下列实验:
的还原性,波波做了下列实验:
(1)对比实验ⅰ与ⅱ,关于盐酸的作用,珊珊提出两个假设:
假设一:c(H+)增大,提高了 的氧化性或
的氧化性或 的还原性;
的还原性;
假设二: c(Cl-)增大,降低了还原产物的浓度,提高了 的氧化性。
的氧化性。
小雨设计实验方案,确认假设一不正确,实验方案是_______ 。
睿睿查阅资料: (白色沉淀)
(白色沉淀)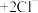 。
。
设计实验方案,确认了假设二正确,实验方案是_______ 。
(2)写出ⅱ中反应的离子方程式_______ 。
(3)对比实验ⅱ与ⅲ,针对反应速率的差异,进行了以下探究:
瑛瑛进行理论预测:依据_______ 反应(写离子方程式),氧化性: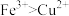 ,ⅲ的反应速率快于ⅱ的。
,ⅲ的反应速率快于ⅱ的。
萌萌查阅资料: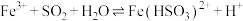 。
。
结合资料,解释实验ⅱ与ⅲ的速率差异_______ 。
[实验二]探究 的氧化性,邹邹做了下列实验:
的氧化性,邹邹做了下列实验:
(4)博博借助仪器检验黑色沉淀是 ,溶液中没有
,溶液中没有 。写出ⅴ中反应的离子方程式
。写出ⅴ中反应的离子方程式_______ 。
(5)反应ⅴ能发生,可能是因为Cu2S的生成提高了Cu的还原性或 的氧化性,
的氧化性, 的生成提高了Cu的还原性。对比实验ⅳ、ⅴ与ⅵ,昊昊得出结论:起主要作用的是
的生成提高了Cu的还原性。对比实验ⅳ、ⅴ与ⅵ,昊昊得出结论:起主要作用的是_______ 。
通过以上实验, 既有氧化性又有还原性,条件改变会影响其性质。
既有氧化性又有还原性,条件改变会影响其性质。
 的性质,进行了下列实验。
的性质,进行了下列实验。[实验一]探究
 的还原性,波波做了下列实验:
的还原性,波波做了下列实验:| 实验 | ⅰ | ⅱ | ⅲ |
| 实验操作 | 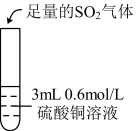 |  | 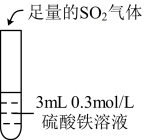 |
| 实验现象 | 无明显现象 | 通入 后溶液迅速变为棕色 后溶液迅速变为棕色 | 溶液迅速变成红棕色。两天后,溶液变浅绿色 |
假设一:c(H+)增大,提高了
 的氧化性或
的氧化性或 的还原性;
的还原性;假设二: c(Cl-)增大,降低了还原产物的浓度,提高了
 的氧化性。
的氧化性。小雨设计实验方案,确认假设一不正确,实验方案是
睿睿查阅资料:
 (白色沉淀)
(白色沉淀)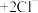 。
。设计实验方案,确认了假设二正确,实验方案是
(2)写出ⅱ中反应的离子方程式
(3)对比实验ⅱ与ⅲ,针对反应速率的差异,进行了以下探究:
瑛瑛进行理论预测:依据
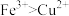 ,ⅲ的反应速率快于ⅱ的。
,ⅲ的反应速率快于ⅱ的。萌萌查阅资料:
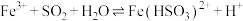 。
。结合资料,解释实验ⅱ与ⅲ的速率差异
[实验二]探究
 的氧化性,邹邹做了下列实验:
的氧化性,邹邹做了下列实验:| 实验 | ⅳ | ⅴ | ⅵ |
| 实验操作 | 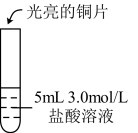 | 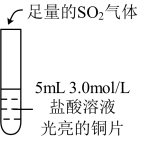 | 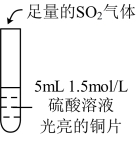 |
| 实验现象 | 无明显现象 | 光亮的紫红色铜片很快变暗,并有黑色沉淀生成,溶液变为棕色 | 无明显现象 |
 ,溶液中没有
,溶液中没有 。写出ⅴ中反应的离子方程式
。写出ⅴ中反应的离子方程式(5)反应ⅴ能发生,可能是因为Cu2S的生成提高了Cu的还原性或
 的氧化性,
的氧化性, 的生成提高了Cu的还原性。对比实验ⅳ、ⅴ与ⅵ,昊昊得出结论:起主要作用的是
的生成提高了Cu的还原性。对比实验ⅳ、ⅴ与ⅵ,昊昊得出结论:起主要作用的是通过以上实验,
 既有氧化性又有还原性,条件改变会影响其性质。
既有氧化性又有还原性,条件改变会影响其性质。
您最近一年使用:0次
2022-05-28更新
|
701次组卷
|
5卷引用:北京市中国人民大学附属中学2022届高三下学期第三次适应性练习化学试题
北京市中国人民大学附属中学2022届高三下学期第三次适应性练习化学试题(已下线)考点10 硫及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)突破超重点 高效突破综合实验 实验4 创新探究实验热点1物质性质探究类实验(已下线)考点10 硫及其化合物(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)
解题方法
7 . 某小组同学探究实验室配制银氨溶液并检验醛基的方法。
资料:i.AgOH是白色难溶于水的物质,常温下极不稳定,分解生成棕色微溶于水的 。
。
ii.向硝酸银溶液中加入氨水,转化为 的
的 占参加反应的
占参加反应的 总量的百分比最大不超过10%。
总量的百分比最大不超过10%。
Ⅰ.在实验室配制银氨溶液的过程中,小组同学发现,所用试剂的配制方式和存放时间不同,实验现象不同。(注:以下试剂若无特殊说明,均为新制)
(1)NH3分子空间构型为_______ 。
(2)结合资料ii,写出实验1中加入少量氨水时发生的主要反应的离子方程式_______ 。
(3)已知,实验2中白色沉淀加硝酸产生能使澄清石灰水变浑浊的无色气体,实验2中白色沉淀的主要成分是_______ 。
(4)对比实验1和3,分析实验3中“溶液始终澄清”的原因是_______ 。
Ⅱ.用实验1配制出的银氨溶液检验醛基。
资料:可从电极反应角度分析物质氧化性和还原性的变化。
(5)银氨溶液与CH3CHO的反应中,电极反应式:
还原反应:Ag++e-=Ag;氧化反应:_______ (碱性条件下)。
在此基础上设计并实施了以下实验。
(6)实验5产生银镜比实验4快的可能原因是_______ 。按照实验5的方法,将乙醛换成丙酮,水浴加热后也能产生银镜。
综合上述实验,实验4是检验醛基的最合理方法。
资料:i.AgOH是白色难溶于水的物质,常温下极不稳定,分解生成棕色微溶于水的
 。
。ii.向硝酸银溶液中加入氨水,转化为
 的
的 占参加反应的
占参加反应的 总量的百分比最大不超过10%。
总量的百分比最大不超过10%。Ⅰ.在实验室配制银氨溶液的过程中,小组同学发现,所用试剂的配制方式和存放时间不同,实验现象不同。(注:以下试剂若无特殊说明,均为新制)
| 序号 | 实验操作 | 实验现象 |
| 1 | 向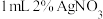 溶液中逐滴加入2%氨水 溶液中逐滴加入2%氨水 | 先产生棕色沉淀,后溶液变澄清 |
| 2 | 向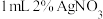 溶液中逐滴加入在空气中存放一段时间的2%氨水 溶液中逐滴加入在空气中存放一段时间的2%氨水 | 先产生白色沉淀,后溶液变澄清 |
| 3 | 向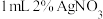 ( ( 酸化)溶液中逐滴加入2%氨水至过量 酸化)溶液中逐滴加入2%氨水至过量 | 溶液始终澄清 |
(2)结合资料ii,写出实验1中加入少量氨水时发生的主要反应的离子方程式
(3)已知,实验2中白色沉淀加硝酸产生能使澄清石灰水变浑浊的无色气体,实验2中白色沉淀的主要成分是
(4)对比实验1和3,分析实验3中“溶液始终澄清”的原因是
Ⅱ.用实验1配制出的银氨溶液检验醛基。
资料:可从电极反应角度分析物质氧化性和还原性的变化。
(5)银氨溶液与CH3CHO的反应中,电极反应式:
还原反应:Ag++e-=Ag;氧化反应:
在此基础上设计并实施了以下实验。
| 序号 | 实验操作 | 实验现象 |
| 4 | 向银氨溶液中加入3滴 ,水浴加热 ,水浴加热 | 产生银镜 |
| 5 | 向银氨溶液中加入1滴10% NaOH溶液后,滴入3滴 | 产生银镜比实验4快 |
综合上述实验,实验4是检验醛基的最合理方法。
您最近一年使用:0次
名校
8 . 下表是元素周期表主族元素的一部分,短周期元素x的最高正化合价是+5价,Y的单质可在空气中燃烧。
探究同主族元素性质的一些共同规律,是学习化学的重要方法之一、参考同主族元素Y,推测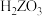 具有各种不同化学性质。
具有各种不同化学性质。
实验小组经查阅资料,发现实验室可以从含Z单质的废料中提取Z的单质,从该实验中能验证所具有的几类性质。提取Z的单质的实验步骤如下:
i.含Z的单质废料用 和硫酸混合溶液溶解,得到大量
和硫酸混合溶液溶解,得到大量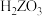 和少量
和少量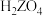 混合溶液;
混合溶液;
ii.控制反应温度为 ,加入浓盐酸使少量
,加入浓盐酸使少量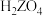 转化为
转化为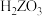 ;
;
iii.调节溶液 ,通入二氧化硫,得到Z的单质沉淀。
,通入二氧化硫,得到Z的单质沉淀。
用如图所示装置进行实验,实验后需要测定产品的纯度。取产品并充分研磨,加适量浓硫酸煮沸生成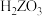 ,再稀释配成稀溶液,用酸性
,再稀释配成稀溶液,用酸性 标准溶液进行测定。
标准溶液进行测定。

请回答下列问题:(用规范化学语言回答问题,不得用英文字母代替)
(1)写出Z的原子结构示意图:_______ 。
(2)Y、Z位于同一主族,下列关系正确的是_______ 。
A.热稳定性: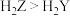 B.原子半径:
B.原子半径:
C.酸性: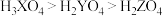 D.还原性:
D.还原性:
(3)类比Y的含氧酸酸性,可以得出结论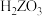 为二元
为二元______ ,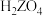 为二元
为二元_______ 。
(4)步骤ⅰ中单质Z大部分生成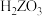 ,生成
,生成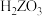 的反应离子方程式为
的反应离子方程式为_______ 。
(5)装置A的加热方法为_______ ,装置B的主要作用为_______ 。
(6)结合以上实验内容,请用下列表格整理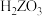 的几种性质(以
的几种性质(以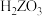 为反应物,其他反应试剂只能从题中出现的试剂中选择)
为反应物,其他反应试剂只能从题中出现的试剂中选择)
| W | X | Y |
| Z |
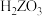 具有各种不同化学性质。
具有各种不同化学性质。实验小组经查阅资料,发现实验室可以从含Z单质的废料中提取Z的单质,从该实验中能验证所具有的几类性质。提取Z的单质的实验步骤如下:
i.含Z的单质废料用
 和硫酸混合溶液溶解,得到大量
和硫酸混合溶液溶解,得到大量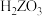 和少量
和少量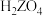 混合溶液;
混合溶液;ii.控制反应温度为
 ,加入浓盐酸使少量
,加入浓盐酸使少量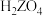 转化为
转化为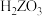 ;
;iii.调节溶液
 ,通入二氧化硫,得到Z的单质沉淀。
,通入二氧化硫,得到Z的单质沉淀。用如图所示装置进行实验,实验后需要测定产品的纯度。取产品并充分研磨,加适量浓硫酸煮沸生成
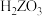 ,再稀释配成稀溶液,用酸性
,再稀释配成稀溶液,用酸性 标准溶液进行测定。
标准溶液进行测定。
请回答下列问题:(用规范化学语言回答问题,不得用英文字母代替)
(1)写出Z的原子结构示意图:
(2)Y、Z位于同一主族,下列关系正确的是
A.热稳定性:
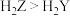 B.原子半径:
B.原子半径:
C.酸性:
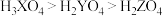 D.还原性:
D.还原性:
(3)类比Y的含氧酸酸性,可以得出结论
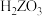 为二元
为二元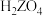 为二元
为二元(4)步骤ⅰ中单质Z大部分生成
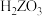 ,生成
,生成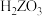 的反应离子方程式为
的反应离子方程式为(5)装置A的加热方法为
(6)结合以上实验内容,请用下列表格整理
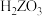 的几种性质(以
的几种性质(以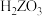 为反应物,其他反应试剂只能从题中出现的试剂中选择)
为反应物,其他反应试剂只能从题中出现的试剂中选择)| 编号 | 性质推测 | 离子反应方程式 |
| 1 |  | |
| 2 | 还原性 | |
| 3 | 氧化性 |
您最近一年使用:0次
9 . 亚硝酸钠(NaNO2)为白色粉末,易溶于水,味微咸,有毒;广泛应用于工业建筑领域,允许限量做食品添加剂,用于防腐和肉制品增色。某化学小组对亚硝酸钠的性质和用途进行了如下探究。
(1)NaNO2中N元素的化合价为__ ,据此推断NaNO2__ (填字母)。
a.只有氧化性 b.只有还原性 c.既有氧化性又有还原性
(2)资料表明:误食NaNO2后,血红蛋白中的亚铁转变成三价铁,失去携氧功能,因此造成人体缺氧中毒。
①预测性质:上述过程中NaNO2作___________ (填“氧化剂”或“还原剂”)。
②实验和结论:取NaNO2固体配成溶液,取少量溶液于试管中,滴入___________ (填“FeSO4溶液、KSCN溶液”或“酸性KMnO4溶液”),观察到的实验现象为___________ ,据此得出预测结论。
(3)该小组查阅资料得知工业制备亚硝酸钠的途径有两种。
途径一:NaNO3加热到380℃分解2NaNO3 2NaNO2+O2↑。
2NaNO2+O2↑。
途径二:NaOH溶液吸收NO、NO2气体。
①写出途径二反应的离子方程式___________ 。
②制备等量的NaNO2途径一与途径二转移电子的物质的量之比为___________ 。
(1)NaNO2中N元素的化合价为
a.只有氧化性 b.只有还原性 c.既有氧化性又有还原性
(2)资料表明:误食NaNO2后,血红蛋白中的亚铁转变成三价铁,失去携氧功能,因此造成人体缺氧中毒。
①预测性质:上述过程中NaNO2作
②实验和结论:取NaNO2固体配成溶液,取少量溶液于试管中,滴入
(3)该小组查阅资料得知工业制备亚硝酸钠的途径有两种。
途径一:NaNO3加热到380℃分解2NaNO3
 2NaNO2+O2↑。
2NaNO2+O2↑。途径二:NaOH溶液吸收NO、NO2气体。
①写出途径二反应的离子方程式
②制备等量的NaNO2途径一与途径二转移电子的物质的量之比为
您最近一年使用:0次
10 . 含氯物质在生产生活中有重要作用。
I.实验室制取氯气的装置如图所示。
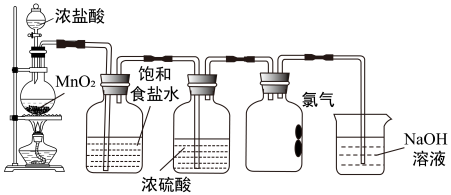
(1)收集氯气的集气瓶中,导管没有画完整,请在答题卡图中补充完整___________ 。
(2)NaOH溶液的作用是(用离子方程式表示)___________
(3)当氯气不再逸出时,圆底烧瓶中的固液混合物中仍存在盐酸和二氧化锰,某合作学习小组分析成因时提出如下猜想:
猜想a;随H+浓度降低,MnO2的氧化性减弱。
猪想b:随Cl-浓度降低,Cl-的还原性___________ (填“增强”、“不变”或“减弱”)。
猜想c:随Mn2+浓度升高,MnO2的氧化性减弱。
①查阅资料:K+、 对体系中各物质的氧化性与还原性均无影响。
对体系中各物质的氧化性与还原性均无影响。
②设计实验验证:将固液混合物均分为三组,保持条件相同,分别向三组固液混合物中加入试剂。
通过三组实验,a、b、c三个猜想都得到了证实,则X为_______ (填化学式),Y为_______ (填化学式)。
II.已知FeCl3固体易升华,其蒸气为黄色。某小组通过下面装置探究MnO2与FeCl3能否反应产生Cl2。
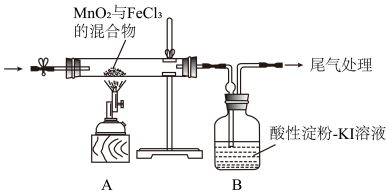
实验操作和现象:
(4)实验前,需要进行的操作为___________ 。
(5)该实验装置从安全角度分析,存在的问题是___________ 。
(6)装置经改进后,继续实验,确认产物有Cl2和MnCl2,则A中发生反应的化学方程式为___________ 。
I.实验室制取氯气的装置如图所示。

(1)收集氯气的集气瓶中,导管没有画完整,请在答题卡图中补充完整
(2)NaOH溶液的作用是(用离子方程式表示)
(3)当氯气不再逸出时,圆底烧瓶中的固液混合物中仍存在盐酸和二氧化锰,某合作学习小组分析成因时提出如下猜想:
猜想a;随H+浓度降低,MnO2的氧化性减弱。
猪想b:随Cl-浓度降低,Cl-的还原性
猜想c:随Mn2+浓度升高,MnO2的氧化性减弱。
①查阅资料:K+、
 对体系中各物质的氧化性与还原性均无影响。
对体系中各物质的氧化性与还原性均无影响。②设计实验验证:将固液混合物均分为三组,保持条件相同,分别向三组固液混合物中加入试剂。
| 组别 | 试剂 | 产物 |
| 1 | 较浓硫酸 | 有Cl2生成 |
| 2 | X | 有Cl2生成 |
| 3 | X和Y | 无Cl2生成 |
II.已知FeCl3固体易升华,其蒸气为黄色。某小组通过下面装置探究MnO2与FeCl3能否反应产生Cl2。

实验操作和现象:
| 实验操作 | 现象 |
| 点燃酒精喷灯,加热 | 加热一段时间后,装置A中产生黄色气体,装置B中溶液变蓝 |
(5)该实验装置从安全角度分析,存在的问题是
(6)装置经改进后,继续实验,确认产物有Cl2和MnCl2,则A中发生反应的化学方程式为
您最近一年使用:0次