名校
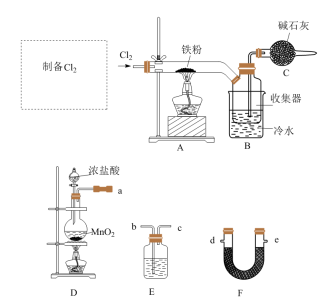
1 . FeCl3是中学常见的试剂,某实验小组用以下装置制备FeCl3固体,并探究FeCl3溶液与Cu的反应。
已知:FeCl3晶体易升华,FeCl3溶液易水解。
Ⅰ.FeCl3的制备___________ 。
(2)F的名称为___________ ,从D、E、F中选择合适的装置制备纯净的 ,正确的接口顺序为a-
,正确的接口顺序为a-___________ (可选试剂:饱和食盐水、NaOH溶液、浓硫酸、碱石灰,仪器可重复使用)。
(3)写出装置D中制备 的离子方程式
的离子方程式___________ 。
Ⅱ.探究FeCl3溶液与Cu的反应
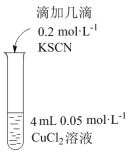
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知: 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
猜想1: 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
猜想2: 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。
针对上述猜想,实验小组同学设计了以下实验:
(4)实验结果说明猜想___________ (填“1”或“2”)不合理。
(5)根据实验2中的现象进一步查阅资料发现:
i. 与
与 可发生如下两种反应:
可发生如下两种反应:
反应A: (淡黄色);
(淡黄色);
反应B: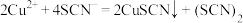 (黄色)。
(黄色)。
ii. 与
与 共存时溶液显绿色。
共存时溶液显绿色。
①由实验2中的现象推测,反应速率:A___________ (填“>”或“<”)B,说明反应B___________ (填“是”或“不是”)产生 的主要原因。
的主要原因。
②进一步查阅资料可知,当反应体系中同时存在 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入 、
、 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式
,写出该反应离子方程式___________ 。
(6)若向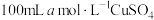 溶液中滴加足量的
溶液中滴加足量的 和
和 的混合溶液,经过一系列操作得到白色沉淀
的混合溶液,经过一系列操作得到白色沉淀 的质量
的质量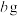 ,则
,则 的产率为
的产率为___________ (写出表达式即可)。
已知:FeCl3晶体易升华,FeCl3溶液易水解。
Ⅰ.FeCl3的制备
(2)F的名称为
 ,正确的接口顺序为a-
,正确的接口顺序为a-(3)写出装置D中制备
 的离子方程式
的离子方程式Ⅱ.探究FeCl3溶液与Cu的反应
向4mL0.1mol/LFeCl3溶液中滴加几滴0.2mol/LKSCN溶液,溶液变红;再加入过量Cu粉,溶液红色褪去,不久有白色沉淀产生。
查阅资料可知:
 和
和 均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:
均为难溶于水的白色固体。针对白色沉淀同学们有以下猜想:猜想1:
 与过量的Cu粉反应生成
与过量的Cu粉反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。猜想2:
 与
与 发生氧化还原反应生成
发生氧化还原反应生成 ,再结合
,再结合 生成白色沉淀
生成白色沉淀 。
。针对上述猜想,实验小组同学设计了以下实验:
| 实验编号 | 操作 | 现象 |
| 实验1 |
| 加入铜粉后无现象 |
| 实验2 |
| 溶液很快由蓝色变为绿色,未观察到白色沉淀; 2h后溶液为绿色,未观察到白色沉淀;24h后, 溶液绿色变浅,试管底部有白色沉淀 |
(5)根据实验2中的现象进一步查阅资料发现:
i.
 与
与 可发生如下两种反应:
可发生如下两种反应:反应A:
 (淡黄色);
(淡黄色);反应B:
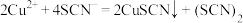 (黄色)。
(黄色)。ii.
 与
与 共存时溶液显绿色。
共存时溶液显绿色。①由实验2中的现象推测,反应速率:A
 的主要原因。
的主要原因。②进一步查阅资料可知,当反应体系中同时存在
 、
、 、
、 时,
时, 氧化性增强,可将
氧化性增强,可将 氧化为
氧化为 。据此将实验2改进,向
。据此将实验2改进,向 溶液中同时加入
溶液中同时加入 、
、 ,立即生成白色沉淀
,立即生成白色沉淀 ,写出该反应离子方程式
,写出该反应离子方程式(6)若向
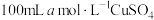 溶液中滴加足量的
溶液中滴加足量的 和
和 的混合溶液,经过一系列操作得到白色沉淀
的混合溶液,经过一系列操作得到白色沉淀 的质量
的质量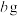 ,则
,则 的产率为
的产率为
您最近一年使用:0次
2023-03-10更新
|
1020次组卷
|
3卷引用:福建省漳州市2023届高三毕业班下学期第三次质量检测化学试卷
2023·全国·模拟预测
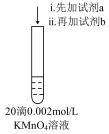
2 . 某学习小组探究 溶液与KI溶液的反应。资料:i.氧化性:
溶液与KI溶液的反应。资料:i.氧化性: ,
, 可以氧化
可以氧化 生成
生成 ;ii.KI溶液暴露在空气中或久置会变为黄色。
;ii.KI溶液暴露在空气中或久置会变为黄色。
Ⅰ.探究反应原理
(1)甲同学对两溶液可能发生的反应提出了下列两种猜想:
猜想a: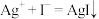
猜想b:
甲同学设计了如下实验进行论证。
甲同学根据实验现象得出猜想a成立,猜想b不成立,依据的实验现象是___________ 。
(2)乙同学认为上述实验结果可以证明猜想a成立,但不足以证明猜想b不成立。猜想b可能成立的理由是___________ 。
Ⅱ. 与
与 是否能发生氧化还原反应
是否能发生氧化还原反应
为探究 与
与 是否能发生氧化还原反应,丙同学设计了如下实验装置(盐桥中装有含
是否能发生氧化还原反应,丙同学设计了如下实验装置(盐桥中装有含 饱和溶液的琼胶):
饱和溶液的琼胶):

(3)若左侧电极为负极,右侧电极为正极,则左、右烧杯中的试剂X和Y分别是___________ 、___________ 。
(4)电池反应一段时间后,KI溶液逐渐变为黄色。为进一步证明 与
与 发生了氧化还原反应,丙同学取少量盛装KI溶液烧杯中的液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出
发生了氧化还原反应,丙同学取少量盛装KI溶液烧杯中的液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出 和
和 发生了氧化还原反应,是否合理?
发生了氧化还原反应,是否合理?___________ ;说明理由:___________ 。
(5)电流表指针发生明显偏转,结合(4)可知, 溶液中发生的电极反应式为
溶液中发生的电极反应式为___________ ,KI溶液中发生的电极反应式为___________ ,因此验证了 与
与 能发生氧化还原反应。
能发生氧化还原反应。
 溶液与KI溶液的反应。资料:i.氧化性:
溶液与KI溶液的反应。资料:i.氧化性: ,
, 可以氧化
可以氧化 生成
生成 ;ii.KI溶液暴露在空气中或久置会变为黄色。
;ii.KI溶液暴露在空气中或久置会变为黄色。Ⅰ.探究反应原理
(1)甲同学对两溶液可能发生的反应提出了下列两种猜想:
猜想a:
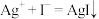
猜想b:

甲同学设计了如下实验进行论证。
| 实验序号 | 实验操作 |
| 1 | 向盛有1mL  溶液的试管中,加入1mL 溶液的试管中,加入1mL KI溶液 KI溶液 |
| 2 | 向实验1的试管中滴加淀粉溶液 |
(2)乙同学认为上述实验结果可以证明猜想a成立,但不足以证明猜想b不成立。猜想b可能成立的理由是
Ⅱ.
 与
与 是否能发生氧化还原反应
是否能发生氧化还原反应为探究
 与
与 是否能发生氧化还原反应,丙同学设计了如下实验装置(盐桥中装有含
是否能发生氧化还原反应,丙同学设计了如下实验装置(盐桥中装有含 饱和溶液的琼胶):
饱和溶液的琼胶):
(3)若左侧电极为负极,右侧电极为正极,则左、右烧杯中的试剂X和Y分别是
(4)电池反应一段时间后,KI溶液逐渐变为黄色。为进一步证明
 与
与 发生了氧化还原反应,丙同学取少量盛装KI溶液烧杯中的液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出
发生了氧化还原反应,丙同学取少量盛装KI溶液烧杯中的液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出 和
和 发生了氧化还原反应,是否合理?
发生了氧化还原反应,是否合理?(5)电流表指针发生明显偏转,结合(4)可知,
 溶液中发生的电极反应式为
溶液中发生的电极反应式为 与
与 能发生氧化还原反应。
能发生氧化还原反应。
您最近一年使用:0次
名校
解题方法
3 . 海带、紫菜等藻类植物中含有丰富的碘元素,海带提碘的实验流程如下:

(1)步骤①中用到的硅酸盐材质的仪器为_______ (写名称)。
(2)步骤③用酸化的H2O2氧化I- 的离子方程式为_______ 。
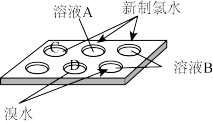
(3)实验小组根据元素周期律研究氧化I- 的氧化剂 (见下图),A、B两种盐溶液分别为_______ 、_______ , 添加C、D两处溶液的作用是_______ 。实验得出结论:氧化性强弱为Cl2>Br2>I2
(4)实验小组还设计了下表实验,对金属阳离子氧化I- 进行研究。
已知:常温下,CuI(白色)、AgI(黄色)的Ksp分别为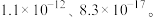
①实验2中a为_______ 溶液。
甲同学根据现象得出结论:Ag+氧化性比Cu2+弱且不能氧化I-。
乙同学对甲同学的结论提出质疑,查阅资料(常温下,反应2Ag+(aq)+2I-(aq)⇌2Ag(s)+I2(aq)的平衡常数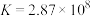 ,当c(Ag+)、c(I-)大于等于1mol·L-1时,Ag+可以氧化I-),借助原电池原理优化实验设计,证实了自己的观点。
,当c(Ag+)、c(I-)大于等于1mol·L-1时,Ag+可以氧化I-),借助原电池原理优化实验设计,证实了自己的观点。
②请你补充画完整原电池装置示意图(如图),并作相应标注_______ 。

③根据以上实验过程,试分析实验2中Ag+ 没能氧化I- 的可能原因是_______ 。

(1)步骤①中用到的硅酸盐材质的仪器为
(2)步骤③用酸化的H2O2氧化I- 的离子方程式为
(3)实验小组根据元素周期律研究氧化I- 的氧化剂 (见下图),A、B两种盐溶液分别为

(4)实验小组还设计了下表实验,对金属阳离子氧化I- 进行研究。
已知:常温下,CuI(白色)、AgI(黄色)的Ksp分别为
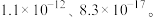
| 序号 | 实验步骤 | 实验现象 | 结论 |
| 1 | 往CuSO4溶液中滴加KI溶液,然后加入少量苯,振荡 | 产生白色沉淀,溶液分层,上层为紫红色 | Cu2+可以氧化I- 为I2 |
| 2 | 往AgNO3中滴加KI溶液,滴加几滴a溶液,振荡 | 产生黄色沉淀,溶液无色 | Ag+与I-只发生沉淀反应 |
甲同学根据现象得出结论:Ag+氧化性比Cu2+弱且不能氧化I-。
乙同学对甲同学的结论提出质疑,查阅资料(常温下,反应2Ag+(aq)+2I-(aq)⇌2Ag(s)+I2(aq)的平衡常数
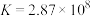 ,当c(Ag+)、c(I-)大于等于1mol·L-1时,Ag+可以氧化I-),借助原电池原理优化实验设计,证实了自己的观点。
,当c(Ag+)、c(I-)大于等于1mol·L-1时,Ag+可以氧化I-),借助原电池原理优化实验设计,证实了自己的观点。②请你补充画完整原电池装置示意图(如图),并作相应标注

③根据以上实验过程,试分析实验2中Ag+ 没能氧化I- 的可能原因是
您最近一年使用:0次
2022高三·全国·专题练习
解题方法
4 . 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂。查阅资料知:酸性条件下NaNO2具有氧化性。利用所供试剂,设计实验方案验证此信息:_______ (供选用的试剂有NaNO2溶液、FeSO4溶液、稀硫酸、KSCN溶液)
您最近一年使用:0次
解题方法
5 . KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。请回答下列问题:
(1)KIO3的化学名称是___________ 。
(2)KIO3具有一定的氧化性,能与H2S反应生成淡黄色沉淀,请配平该离子反应方程式: +H2S=I-+S↓+H2O,
+H2S=I-+S↓+H2O,___________ 。
(3)炒菜使用加碘盐,最好等出锅时再放盐,理由是___________ (请用化学反应方程式表示)。
(4)KIO3可采用“电解法”制备,某同学查阅资料,设计将NO2、O2和熔融盐组成的燃料电池(装置1)与装置2相连,主要原理如图所示。电解前,在a极区先将一定量的碘溶于过量KOH溶液,发生反应3I2+6KOH=5KI+KIO3+3H2O,电解后在该区获得KIO3。

①装置1,熔融盐中NO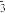 移向
移向___________ (填“石墨I”或“石墨II”);在使用过程中石墨I电极反应生成一种氧化物Y,请写出该氧化物Y的化学式是___________ 。
②请写出装置1中石墨II的电极反应式是___________ 。
③装置2,用惰性电极和不锈钢两种作为电极材料,请写出电极a可采用的材料是___________ (填“石墨”或“不锈钢”或“两者皆可”),该电极上发生的电极反应式是___________ 。
④装置2,电解过程中通过离子交换膜的离子主要是___________ ;电解后,b极区周围的pH会___________ (填“升高”或“降低”)。
(1)KIO3的化学名称是
(2)KIO3具有一定的氧化性,能与H2S反应生成淡黄色沉淀,请配平该离子反应方程式:
 +H2S=I-+S↓+H2O,
+H2S=I-+S↓+H2O,(3)炒菜使用加碘盐,最好等出锅时再放盐,理由是
(4)KIO3可采用“电解法”制备,某同学查阅资料,设计将NO2、O2和熔融盐组成的燃料电池(装置1)与装置2相连,主要原理如图所示。电解前,在a极区先将一定量的碘溶于过量KOH溶液,发生反应3I2+6KOH=5KI+KIO3+3H2O,电解后在该区获得KIO3。

①装置1,熔融盐中NO
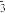 移向
移向②请写出装置1中石墨II的电极反应式是
③装置2,用惰性电极和不锈钢两种作为电极材料,请写出电极a可采用的材料是
④装置2,电解过程中通过离子交换膜的离子主要是
您最近一年使用:0次
名校
6 . 查阅资料可知:Bi位于周期表的第VA族, 是浅黄色固体;溶液中
是浅黄色固体;溶液中 较稳定呈无色。某实验小组依次进行以下实验操作:
较稳定呈无色。某实验小组依次进行以下实验操作:
①向稀硫酸酸化的 溶液中加入适量
溶液中加入适量 ,溶液变为紫红色。
,溶液变为紫红色。
②继续滴加适量草酸 溶液,溶液紫红色褪去,并有
溶液,溶液紫红色褪去,并有 产生。
产生。
下列说法正确的是
 是浅黄色固体;溶液中
是浅黄色固体;溶液中 较稳定呈无色。某实验小组依次进行以下实验操作:
较稳定呈无色。某实验小组依次进行以下实验操作:①向稀硫酸酸化的
 溶液中加入适量
溶液中加入适量 ,溶液变为紫红色。
,溶液变为紫红色。②继续滴加适量草酸
 溶液,溶液紫红色褪去,并有
溶液,溶液紫红色褪去,并有 产生。
产生。下列说法正确的是
| A.Bi的基态原子中只含一个未成对电子 |
B.由操作①现象可知酸性条件下氧化性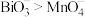 |
C.操作②中每生成标准状况下 ,反应转移1mol电子 ,反应转移1mol电子 |
D.向稀硫酸酸化的 中加入草酸,溶液会变为紫红色 中加入草酸,溶液会变为紫红色 |
您最近一年使用:0次
7日内更新
|
12次组卷
|
2卷引用:江苏省南京市第九中学2023-2024学年高一下学期教学质量调研(二)化学试题
名校
解题方法
7 . 实验小组探究溶液酸碱性对锰化合物和 ,氧化还原反应的影响。
,氧化还原反应的影响。
资料:i. 呈绿色,
呈绿色, 为棕黑色沉淀,
为棕黑色沉淀, 几乎无色。
几乎无色。
ii. 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为 和
和 。
。
iii. 为微溶物。
为微溶物。
(1)用离子方程式解释实验I中出现乳白色浑浊的原因________________________ 。
(2)已知,实验I、II、III中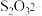 均被氧化为
均被氧化为 ,针对实验I、II、III进行分析:
,针对实验I、II、III进行分析:
①对于 氧化性的认识是
氧化性的认识是____________ 。
②实验Ⅱ所得溶液中 的检验方法为
的检验方法为________________________ 。
(3)针对实验Ⅲ、Ⅳ进行分析:
①实验Ⅲ中“溶液变为绿色”相应反应的离子方程式为____________ 。
②实验IV中“静置5min,有棕黑色沉淀生成”的可能原因:____________ (写出2点)。
(4)针对实验Ⅲ、Ⅳ继续探究:
①实验V:向实验III的试管中继续滴加足量 ,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
②实验VI:向实验IV的试管中继续滴加足量 ,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
对比实验V、VI,结合方程式分析实验VI滴加 后溶液未见紫红色的可能原因
后溶液未见紫红色的可能原因____________ 。
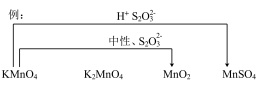
(5)综合上述实验,在下图中用连线的方式补充完善实验I~VI已证实的锰化合物转化关系_____________ 。
 ,氧化还原反应的影响。
,氧化还原反应的影响。资料:i.
 呈绿色,
呈绿色, 为棕黑色沉淀,
为棕黑色沉淀, 几乎无色。
几乎无色。ii.
 在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为
在强碱性溶液中能稳定存在,在酸性、中性或弱碱性溶液中易转化为 和
和 。
。iii.
 为微溶物。
为微溶物。实验 | 序号 | 试剂 | 现象 |
| I | a:10滴 溶液 溶液b:20滴 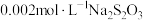 溶液 溶液 | 溶液紫色变浅至接近无色,静置一段时间后出现乳白色浑浊 |
II | a:10滴蒸馏水 b:20滴 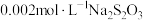 溶液 溶液 | 紫色溶液逐渐褪色,产生棕黑色沉淀 | |
III | a:10滴 溶液 溶液b:2滴 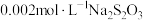 溶液和18滴蒸馏水 溶液和18滴蒸馏水 | 溶液变为绿色,无沉淀生成;静置5min,未见明显变化 | |
IV | a:10滴 溶液 溶液b:20滴 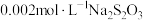 溶液 溶液 | 溶液变为绿色,无沉淀生成;静置5min,绿色变浅,有棕黑色沉淀生成 |
(1)用离子方程式解释实验I中出现乳白色浑浊的原因
(2)已知,实验I、II、III中
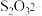 均被氧化为
均被氧化为 ,针对实验I、II、III进行分析:
,针对实验I、II、III进行分析:①对于
 氧化性的认识是
氧化性的认识是②实验Ⅱ所得溶液中
 的检验方法为
的检验方法为(3)针对实验Ⅲ、Ⅳ进行分析:
①实验Ⅲ中“溶液变为绿色”相应反应的离子方程式为
②实验IV中“静置5min,有棕黑色沉淀生成”的可能原因:
(4)针对实验Ⅲ、Ⅳ继续探究:
①实验V:向实验III的试管中继续滴加足量
 ,振荡,溶液立即变为紫红色,产生棕黑色沉淀。
,振荡,溶液立即变为紫红色,产生棕黑色沉淀。②实验VI:向实验IV的试管中继续滴加足量
 ,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。
,振荡,绿色溶液迅速变为无色,棕黑色沉淀逐渐减少直至消失,静置一段时间后,出现乳白色浑浊。对比实验V、VI,结合方程式分析实验VI滴加
 后溶液未见紫红色的可能原因
后溶液未见紫红色的可能原因(5)综合上述实验,在下图中用连线的方式补充完善实验I~VI已证实的锰化合物转化关系
您最近一年使用:0次
2024-02-29更新
|
272次组卷
|
2卷引用:北京市第一七一中学2023-2024学年高三下学期开学考试化学试题
名校
解题方法
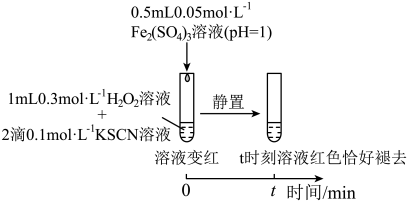
8 . 某小组在验证H2O2氧化Fe2+时发现异常现象,并对其进行深入探究。
实验I:
(1)实验I中溶液变红是因为Fe3+与SCN-发生了反应,其离子方程式是__ 。
(2)探究实验I中红色褪去的原因:取反应后溶液,___ (填实验操作和现象),证明溶液中有Fe3+,而几乎无SCN-。
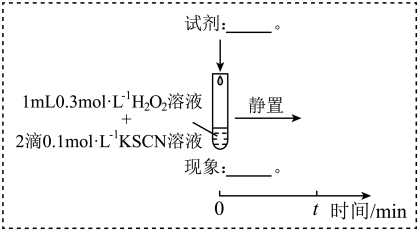
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III:__ 。
实验II:
i.Fe3++H2O2=Fe2++HO2·+H+
ii.Fe2++H2O2=Fe3++·OH+OH-
iii.OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如图:
实验IV:___ 。
②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:____ 。
③实验I~IV中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有___ 。
实验I:
| 装置与操作 | 现象 |
| 溶液立即变红,继续滴加H2O2溶液,红色变浅并逐渐褪去 |
(2)探究实验I中红色褪去的原因:取反应后溶液,
(3)研究发现,酸性溶液中H2O2能氧化SCN-,但反应很慢且无明显现象,而实验I中褪色相对较快,由此推测Fe3+能加快H2O2与SCN-的反应。通过实验II和III得到了证实。参照实验II的图例,在虚线框内补全实验III:
实验II:
i.Fe3++H2O2=Fe2++HO2·+H+
ii.Fe2++H2O2=Fe3++·OH+OH-
iii.OH(羟基自由基)具有强氧化性,能直接氧化SCN-
为探究Fe2+对H2O2与SCN-反应速率的影响,设计实验如图:
实验IV:

②结合资料和(1)~(4)的研究过程,从反应速率和化学平衡的角度解释实验I中溶液先变红后褪色的原因:
③实验I~IV中均有O2生成,小组同学推测可能是HO2·与溶液中其他微粒相互作用生成的,这些微粒有
您最近一年使用:0次
2021-08-13更新
|
642次组卷
|
7卷引用:北京市东城区2021届高三一模化学试题
9 . 高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,同时在化工制备和电池材料等方面具有广泛的应用前景。某实验小组制备高铁酸钾并探究其性质。
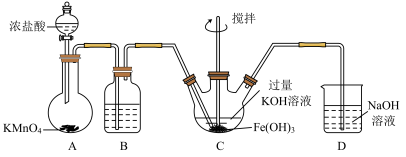
资料:K2FeO4可溶于水、微溶于浓KOH溶液,具有强氧化性,在碱性溶液中较稳定;在酸性或中性溶液中快速产生O2。
(1) K2FeO4中铁元素的化合价_____ 。
(2)装置B中的试剂为_____ ,作用_____ 。
(3)装置C中制备K2FeO4时,发生反应的化学方程式为_____ ,每得到1mol K2FeO4,理论上消耗Cl2的物质的量为_____ mol。
(4)高铁酸钾与水反应其中一种产物为Fe(OH)3 (胶体),则离子方程式为_____ ,高铁酸钾作为水处理剂起到的作用是_____ 。
(5)制备 K2FeO4可以采用干式氧化法,初始反应为
 ,该反应中每消耗6molNa2O2时转移电子数为
,该反应中每消耗6molNa2O2时转移电子数为_____ 。

资料:K2FeO4可溶于水、微溶于浓KOH溶液,具有强氧化性,在碱性溶液中较稳定;在酸性或中性溶液中快速产生O2。
(1) K2FeO4中铁元素的化合价
(2)装置B中的试剂为
(3)装置C中制备K2FeO4时,发生反应的化学方程式为
(4)高铁酸钾与水反应其中一种产物为Fe(OH)3 (胶体),则离子方程式为
(5)制备 K2FeO4可以采用干式氧化法,初始反应为

 ,该反应中每消耗6molNa2O2时转移电子数为
,该反应中每消耗6molNa2O2时转移电子数为
您最近一年使用:0次
名校
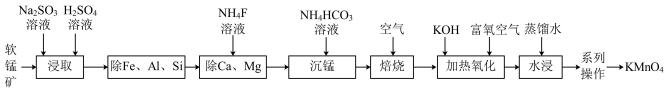
10 . 以软锰矿(主要含有MnO2及少量Fe、Al、Si、Ca、Mg等的氧化物)为原料制备KMnO4的工艺流程如图所示:
查阅资料:① 时, Ksp[(MgF2)]=5.0×10-11,Ksp[(CaF2)]=5.0×10-9,Ksp[(Fe(OH)3]=1.0×10-38
时, Ksp[(MgF2)]=5.0×10-11,Ksp[(CaF2)]=5.0×10-9,Ksp[(Fe(OH)3]=1.0×10-38
②H2CO3的电离常数Ka1=4.4×10-7 Ka2 =4.7×10-11 NH3•H2O的电离常数Kb =1.8×10-5
③当溶液中离子浓度 时,可认为该离子沉淀完全。
时,可认为该离子沉淀完全。
回答下列问题:
(1)“浸取”时Na2SO3将MnO2转化为Mn2+,该反应的离子方程式为___________ ;“浸取”时,提高浸取率的措施是___________ (任写一种)。
(2)“除Fe、Al、Si”时,将Fe2+氧化为Fe3+后,再向该溶液中加入Mn(OH)2调节pH,则使Fe3+沉淀完全的pH的最小值为___________ 。
(3)“除Ca、Mg”时,所得滤液中 =
=___________ 。
(4)“沉锰”时, 溶液做“沉锰”试剂。
溶液做“沉锰”试剂。
① 的水溶液呈
的水溶液呈___________ (填“酸性”或“碱性”或“中性”);其溶液中c( )、c(
)、c( )、c(H+)、c(OH-)从大到小的顺序为:
)、c(H+)、c(OH-)从大到小的顺序为:___________ 。
②“沉锰”时,“锰”转化为MnCO3,反应的离子方程式为:___________ 。
(5)“系列操作”包括___________ ,过滤、洗涤、干燥。
(6)工业上常用铁和石墨做电极材料,电解锰酸钾(K2MnO4)溶液制备高锰酸钾。
①铁为___________ (填“阴极”或“阳极”)。
②阳极的电极反应式为:___________ 。

查阅资料:①
 时, Ksp[(MgF2)]=5.0×10-11,Ksp[(CaF2)]=5.0×10-9,Ksp[(Fe(OH)3]=1.0×10-38
时, Ksp[(MgF2)]=5.0×10-11,Ksp[(CaF2)]=5.0×10-9,Ksp[(Fe(OH)3]=1.0×10-38②H2CO3的电离常数Ka1=4.4×10-7 Ka2 =4.7×10-11 NH3•H2O的电离常数Kb =1.8×10-5
③当溶液中离子浓度
 时,可认为该离子沉淀完全。
时,可认为该离子沉淀完全。回答下列问题:
(1)“浸取”时Na2SO3将MnO2转化为Mn2+,该反应的离子方程式为
(2)“除Fe、Al、Si”时,将Fe2+氧化为Fe3+后,再向该溶液中加入Mn(OH)2调节pH,则使Fe3+沉淀完全的pH的最小值为
(3)“除Ca、Mg”时,所得滤液中
 =
=(4)“沉锰”时,
 溶液做“沉锰”试剂。
溶液做“沉锰”试剂。①
 的水溶液呈
的水溶液呈 )、c(
)、c( )、c(H+)、c(OH-)从大到小的顺序为:
)、c(H+)、c(OH-)从大到小的顺序为:②“沉锰”时,“锰”转化为MnCO3,反应的离子方程式为:
(5)“系列操作”包括
(6)工业上常用铁和石墨做电极材料,电解锰酸钾(K2MnO4)溶液制备高锰酸钾。
①铁为
②阳极的电极反应式为:
您最近一年使用:0次