1 . 工业上以晒盐后的卤水为原料进行提溴,主要流程如下:
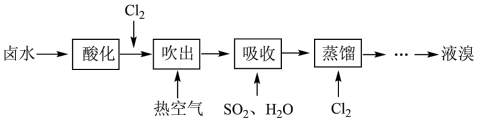
(1)卤水呈碱性,在通入Cl2先需先酸化,原因是___________ 。
(2)向酸化后的卤水中通入Cl2时发生反应的离子方程式为___________ 。
(3)已知吸收反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr
①设立“吸收”步骤的目的是___________ 。
②由该反应可知关于物质氧化性和还原性比较正确的是___________ 。
A.氧化性:Br2>H2SO4 B.还原性:SO2>H2SO4
C.氧化性:Br2>HBr D.还原性:HBr>H2SO4
③有人提出“吸收”步骤也可以用有机溶剂,下列有机溶剂适用的是___________ 。
A.苯 B.四氯化碳 C.植物油 D.酒精
(4)蒸馏时应控制温度不超过100℃,原因是___________ 。
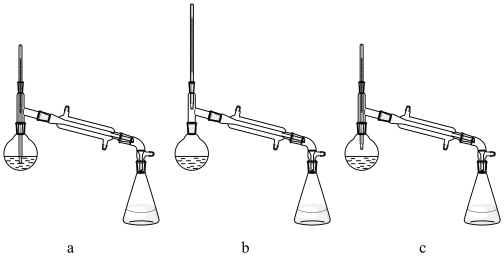
(5)下图的实验室蒸馏操作中,仪器选择及安装都正确的是___________ 。
(6)经该方法处理后,1m3海水最终得到38.4gBr2,若总提取率为60%,则原海水中溴离子的浓度是___________ mmol/L (毫摩尔/L)。

(1)卤水呈碱性,在通入Cl2先需先酸化,原因是
(2)向酸化后的卤水中通入Cl2时发生反应的离子方程式为
(3)已知吸收反应的化学方程式为:SO2+Br2+2H2O=H2SO4+2HBr
①设立“吸收”步骤的目的是
②由该反应可知关于物质氧化性和还原性比较正确的是
A.氧化性:Br2>H2SO4 B.还原性:SO2>H2SO4
C.氧化性:Br2>HBr D.还原性:HBr>H2SO4
③有人提出“吸收”步骤也可以用有机溶剂,下列有机溶剂适用的是
A.苯 B.四氯化碳 C.植物油 D.酒精
(4)蒸馏时应控制温度不超过100℃,原因是
(5)下图的实验室蒸馏操作中,仪器选择及安装都正确的是

(6)经该方法处理后,1m3海水最终得到38.4gBr2,若总提取率为60%,则原海水中溴离子的浓度是
您最近一年使用:0次
名校
2 . 根据所学知识回答下列问题:
(1)H2O2是常见氧化剂,为了验证其氧化性,进行了下列实验:
①取 H2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为
H2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为_______ 。
②有同学认为 2
2 3也有还原性,可以选择其作为试剂验证) H2O2氧化性。该观点是否可行,说明理由:
3也有还原性,可以选择其作为试剂验证) H2O2氧化性。该观点是否可行,说明理由:_______ 。
(2)饮用水中的 对人类健康会产生危害,为了降低饮用水中)
对人类健康会产生危害,为了降低饮用水中) 的浓度,某饮用水研究人员提出两种处理方案:方案一,碱性条件下
的浓度,某饮用水研究人员提出两种处理方案:方案一,碱性条件下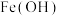 2还原
2还原 生成
生成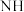 3,反应中氧化剂和还原剂物质的量之比为
3,反应中氧化剂和还原剂物质的量之比为_______ ;方案二,在碱性条件下,用铝粉处理,已知反应时Al与 为5∶3,且Al转化为
为5∶3,且Al转化为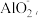 被氧化的元素是
被氧化的元素是_______ ,还原产物是_______ ,请写出反应的离子方程式:_______ 。
(3)已知 3+可以氧化
3+可以氧化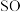 2,则向
2,则向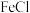 3和
3和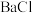 2中通入
2中通入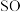 2会产生白色沉淀,该沉淀是
2会产生白色沉淀,该沉淀是_______ (填化学式)。
(1)H2O2是常见氧化剂,为了验证其氧化性,进行了下列实验:
①取
 H2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为
H2O2于试管中,通入H2S气体,溶液变浑浊,反应的化学方程式为②有同学认为
 2
2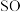 3也有还原性,可以选择其作为试剂验证) H2O2氧化性。该观点是否可行,说明理由:
3也有还原性,可以选择其作为试剂验证) H2O2氧化性。该观点是否可行,说明理由:(2)饮用水中的
 对人类健康会产生危害,为了降低饮用水中)
对人类健康会产生危害,为了降低饮用水中) 的浓度,某饮用水研究人员提出两种处理方案:方案一,碱性条件下
的浓度,某饮用水研究人员提出两种处理方案:方案一,碱性条件下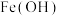 2还原
2还原 生成
生成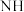 3,反应中氧化剂和还原剂物质的量之比为
3,反应中氧化剂和还原剂物质的量之比为 为5∶3,且Al转化为
为5∶3,且Al转化为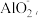 被氧化的元素是
被氧化的元素是(3)已知
 3+可以氧化
3+可以氧化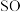 2,则向
2,则向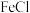 3和
3和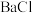 2中通入
2中通入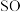 2会产生白色沉淀,该沉淀是
2会产生白色沉淀,该沉淀是
您最近一年使用:0次
名校
解题方法
3 . 高铁酸钾( ,
, g/mol)是一种高效多功能的绿色消毒剂,在新冠疫情期间大显身手。
g/mol)是一种高效多功能的绿色消毒剂,在新冠疫情期间大显身手。
【查阅资料】 为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生
为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生 。
。
I.湿法制备 (夹持装置略)
(夹持装置略)_______ mL浓溶液,量取所用量筒的规格是_______ (填“10mL”“25mL”或“50mL”)。若所配制的稀溶液浓度偏大,则可能的原因是_______ (填字母)。
A.配制前,容量瓶中有少量蒸馏水 B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容 D.定容时,仰视液面
(2)A中发生反应的化学方程式是_______ 。
(3)下列试剂中,装置B的X溶液可以选用的是_______(填字母)。
(4)C中得到紫色固体和溶液,生成 的化学方程式是
的化学方程式是_______ 。
II.干法制备高铁酸钾分两步进行
(5)第一步反应为: ,该反应氧化剂和还原剂的物质的量之比为
,该反应氧化剂和还原剂的物质的量之比为_______ ;
第二步反应为:
(6)实验室用100mL 2.00
 溶液发生上述反应,产品经干燥后得到纯品35.0g,则
溶液发生上述反应,产品经干燥后得到纯品35.0g,则 的产率为
的产率为_______ (保留一位小数)。
 ,
, g/mol)是一种高效多功能的绿色消毒剂,在新冠疫情期间大显身手。
g/mol)是一种高效多功能的绿色消毒剂,在新冠疫情期间大显身手。【查阅资料】
 为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生
为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生 。
。I.湿法制备
 (夹持装置略)
(夹持装置略)
A.配制前,容量瓶中有少量蒸馏水 B.量取浓溶液时,仰视液面
C.未经冷却,立即转移至容量瓶定容 D.定容时,仰视液面
(2)A中发生反应的化学方程式是
(3)下列试剂中,装置B的X溶液可以选用的是_______(填字母)。
| A.饱和食盐水 | B.浓盐酸 | C.氢氧化钠溶液 | D.饱和 溶液 溶液 |
 的化学方程式是
的化学方程式是II.干法制备高铁酸钾分两步进行
(5)第一步反应为:
 ,该反应氧化剂和还原剂的物质的量之比为
,该反应氧化剂和还原剂的物质的量之比为第二步反应为:

(6)实验室用100mL 2.00

 溶液发生上述反应,产品经干燥后得到纯品35.0g,则
溶液发生上述反应,产品经干燥后得到纯品35.0g,则 的产率为
的产率为
您最近一年使用:0次
2023-02-11更新
|
116次组卷
|
2卷引用:湖北省荆州市监利市2022-2023学年高一下学期2月调考化学试题
4 . NaClO是家用消毒液的有效成分,这是利用了NaClO的
| A.碱性 | B.强氧化性 | C.还原性 | D.受热后不稳定性 |
您最近一年使用:0次
名校
5 . 某补铁剂的主要成分是硫酸亚铁( ),说明书中建议“本品与维生素C同服”。小组同学为探究其原理,用放置7天的
),说明书中建议“本品与维生素C同服”。小组同学为探究其原理,用放置7天的 溶液(
溶液(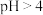 )进行下列实验。
)进行下列实验。
资料:维生素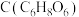 又称抗坏血酸,易溶于水,其溶液呈酸性。
又称抗坏血酸,易溶于水,其溶液呈酸性。
I.检验铁元素的价态
(1)i中观察到_______ ,说明溶液中存在 。将
。将 氧化的物质是
氧化的物质是_______ 。
(2)①小组同学推测,ii中溶液仍为无色是因为维生素 与
与 发生了反应。补全该反应的离子方程式。
发生了反应。补全该反应的离子方程式。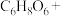 □
□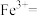 □___
□___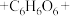 □
□
___
②甲同学认为,可以取ii中溶液加入酸性 溶液验证反应产物。乙同学认为该方法不可行,理由是
溶液验证反应产物。乙同学认为该方法不可行,理由是_______ 。
(3)丙同学认为ii中检验方案不严谨,应考虑pH对反应的影响,依据是_______ 。
II.探究pH对ii中反应的影响
小组同学补充了如下实验,继续探究pH对ii中反应的影响。
(4)判断下列关于实验结论的说法是否正确 (填“对”或“错”)。
①pH对 与
与 的显色反应有影响。
的显色反应有影响。_______
②加维生素 后
后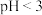 ,导致ii中未末检测出
,导致ii中未末检测出 。
。_______
(5)反思实验i~iii,下列说法合理的是_____ (填序号)。
a.维生素C具有氧化性和酸性
b.同服维生素C可减缓补铁剂中 被氧化
被氧化
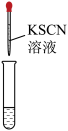
c.使用KSCN检验 时,宜先将溶液酸化
时,宜先将溶液酸化
 ),说明书中建议“本品与维生素C同服”。小组同学为探究其原理,用放置7天的
),说明书中建议“本品与维生素C同服”。小组同学为探究其原理,用放置7天的 溶液(
溶液(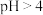 )进行下列实验。
)进行下列实验。资料:维生素
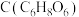 又称抗坏血酸,易溶于水,其溶液呈酸性。
又称抗坏血酸,易溶于水,其溶液呈酸性。I.检验铁元素的价态
 | 实验序号 | 试管中的试剂 | 实验操作及现象 |
| i | 2 mL放置后的 溶液 溶液 | 滴加5滴KSCN溶液后,溶液变为浅红色 | |
| ii | 2 mL放置后的 溶液,0.1 g维生素C 溶液,0.1 g维生素C | 维生素C溶解,溶液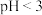 ,滴加5滴KSCN溶液后,溶液 仍呈无色 ,滴加5滴KSCN溶液后,溶液 仍呈无色 |
 。将
。将 氧化的物质是
氧化的物质是(2)①小组同学推测,ii中溶液仍为无色是因为维生素
 与
与 发生了反应。补全该反应的离子方程式。
发生了反应。补全该反应的离子方程式。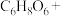 □
□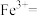 □___
□___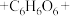 □
□
②甲同学认为,可以取ii中溶液加入酸性
 溶液验证反应产物。乙同学认为该方法不可行,理由是
溶液验证反应产物。乙同学认为该方法不可行,理由是(3)丙同学认为ii中检验方案不严谨,应考虑pH对反应的影响,依据是
II.探究pH对ii中反应的影响
小组同学补充了如下实验,继续探究pH对ii中反应的影响。
| 实验序号 | 试剂 | 实验操作及现象 |
| iii |  | 滴加5滴KSCN溶液后,溶液变为浅红色,浅红色比i中加深 |
①pH对
 与
与 的显色反应有影响。
的显色反应有影响。②加维生素
 后
后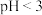 ,导致ii中未末检测出
,导致ii中未末检测出 。
。(5)反思实验i~iii,下列说法合理的是
a.维生素C具有氧化性和酸性
b.同服维生素C可减缓补铁剂中
 被氧化
被氧化c.使用KSCN检验
 时,宜先将溶液酸化
时,宜先将溶液酸化
您最近一年使用:0次
2023-01-05更新
|
499次组卷
|
3卷引用:北京市海淀区2022-2023学年高一上学期期末考试化学试题
6 . 五种短周期主族元素a、b、c、d、e随原子序数的递增,其原子半径的相对大小、最高正化合价或最低负化合价的变化如图所示:

回答下列问题:
(1)元素d在周期表中的位置是_______ ,c、d、e的简单离子半径由大到小的顺序为_______ (用离子符号表示)。
(2)下列可作为比较d和e金属性强弱依据的是_______(填序号)。
(3)已知硒(Se)与c同主族,关于硒及其化合物的说法正确的是_______(填序号)。
(4)化合物 可作环保型阻燃材料,受热时按如下方程式分解:
可作环保型阻燃材料,受热时按如下方程式分解:
 。
。
①该化合物作阻燃剂的两条依据是_______ 、_______ 。
②在25℃、101kPa下,已知12g的单质d在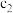 中完全燃烧后恢复至原状态,放热302.4kJ,该反应的热化学方程式是
中完全燃烧后恢复至原状态,放热302.4kJ,该反应的热化学方程式是_______ 。
(5)工业上常用单质e和金属氧化物反应制备金属单质: ;利用上述方法可制取Ba的主要原因是_______(填序号)。
;利用上述方法可制取Ba的主要原因是_______(填序号)。

回答下列问题:
(1)元素d在周期表中的位置是
(2)下列可作为比较d和e金属性强弱依据的是_______(填序号)。
| A.测两种元素单质的硬度和熔、沸点 |
| B.比较单质作为还原剂时失去电子数目的多少 |
| C.比较两种元素最高价氧化物对应水化物的碱性强弱 |
| D.比较单质与同浓度盐酸反应置换出氢气的难易程度 |
A. 既有氧化性又有还原性 既有氧化性又有还原性 | B.气态氢化物的稳定性强于氯化氢 |
| C.硒单质具有强氧化性 | D.最高价氧化物对应水化物的化学式为 |
 可作环保型阻燃材料,受热时按如下方程式分解:
可作环保型阻燃材料,受热时按如下方程式分解: 。
。①该化合物作阻燃剂的两条依据是
②在25℃、101kPa下,已知12g的单质d在
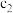 中完全燃烧后恢复至原状态,放热302.4kJ,该反应的热化学方程式是
中完全燃烧后恢复至原状态,放热302.4kJ,该反应的热化学方程式是(5)工业上常用单质e和金属氧化物反应制备金属单质:
 ;利用上述方法可制取Ba的主要原因是_______(填序号)。
;利用上述方法可制取Ba的主要原因是_______(填序号)。| A.高温时e的活泼性大于Ba | B.高温有利于BaO分解 |
C.高温时 比 比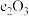 稳定 稳定 | D.Ba的沸点比e的低 |
您最近一年使用:0次
解题方法
7 . 化学与生活紧密相关,下列与化学知识有关的描述正确的是
| A.小苏打可用作食品膨松剂,利用其水溶液呈碱性 |
B. 可用于饮用水消毒,利用了其强氧化性 可用于饮用水消毒,利用了其强氧化性 |
C. 用于制作光导纤维,利用了其半导体的特性 用于制作光导纤维,利用了其半导体的特性 |
| D.镁铝合金用于制作航天器外壳,利用了其强还原性 |
您最近一年使用:0次
名校
解题方法
8 . 高铁酸盐是一种集氧化、絮凝、杀菌、吸附、助凝、除臭为一体的新型高效多功能水处理剂。
I.某实验小组在实验室制备少量高铁酸钾( )。
)。
查阅资料:
a. 为紫色固体。
为紫色固体。
b. 具有强氧化性,在酸性或中性溶液中快速产生
具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。

(1)装置B除去挥发的HCl,目的是_______ 。
(2)装置C中反应的离子方程式:_______ 。
(3)装置D中反应的离子方程式为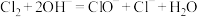 ,用单线桥表示电子转移方向和数目
,用单线桥表示电子转移方向和数目_______ 。在装置D的溶液中还检测出 ,若溶液中个数
,若溶液中个数 ,则个数
,则个数
_______ 。
II.工业上可以用多种制备高铁酸钠( )。
)。
(4) 与
与 生成高铁酸钠和一种可溶于水的碱性氧化物,写出反应的化学方程式
生成高铁酸钠和一种可溶于水的碱性氧化物,写出反应的化学方程式____ 。
(5)高铁酸钠还可以通过如下反应制得: ,反应中的还原剂有
,反应中的还原剂有_____ ,反应中1个 可以还原
可以还原 的数目为
的数目为_____ 个。
I.某实验小组在实验室制备少量高铁酸钾(
 )。
)。查阅资料:
a.
 为紫色固体。
为紫色固体。b.
 具有强氧化性,在酸性或中性溶液中快速产生
具有强氧化性,在酸性或中性溶液中快速产生 ,在碱性溶液中较稳定。
,在碱性溶液中较稳定。
(1)装置B除去挥发的HCl,目的是
(2)装置C中反应的离子方程式:
(3)装置D中反应的离子方程式为
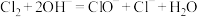 ,用单线桥表示电子转移方向和数目
,用单线桥表示电子转移方向和数目 ,若溶液中个数
,若溶液中个数 ,则个数
,则个数
II.工业上可以用多种制备高铁酸钠(
 )。
)。(4)
 与
与 生成高铁酸钠和一种可溶于水的碱性氧化物,写出反应的化学方程式
生成高铁酸钠和一种可溶于水的碱性氧化物,写出反应的化学方程式(5)高铁酸钠还可以通过如下反应制得:
 ,反应中的还原剂有
,反应中的还原剂有 可以还原
可以还原 的数目为
的数目为
您最近一年使用:0次
2022-10-09更新
|
381次组卷
|
2卷引用:黑龙江省哈尔滨市第九中学校2022一2023学年高一上学期9月份考试化学试题
名校
解题方法
9 . 实验发现,溶液的酸碱性会影响物质的氧化性或者还原性。在化学实验中,经常将一定浓度的 溶液与一定浓度的硫酸混合使用。某实验需要480mL 1mol/L的
溶液与一定浓度的硫酸混合使用。某实验需要480mL 1mol/L的 和100g质量分数为25.2%的
和100g质量分数为25.2%的 溶液。要配制这两种溶液,进行了下列实验。请回答有关问题:
溶液。要配制这两种溶液,进行了下列实验。请回答有关问题:
(1)实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:
该硫酸的物质的量浓度为_______ ,该实验中,应该取该硫酸_______ mL。
(2)要配制所需的两种溶液,下列仪器中需要使用的是烧杯、托盘天平和_______ (请填写仪器名称,下同),还需要的玻璃仪器有_______ 。

(3)下列关于仪器的说法正确的是_______ 。
A.使用前要检查容量瓶是否漏液
B.容量瓶上标有容积、温度和浓度
C.容量瓶和量筒用蒸馏水洗净后,需要烘干后再使用
D.量筒在量取浓硫酸后,需要洗涤,且要将洗涤液转入容量瓶中
E.该实验中多次使用玻璃棒,但是作用不同
(4)在两种溶液的配制过程中,下列操作中能使所配溶液的浓度偏低的有_______ (填代号)。
①用量筒量取浓硫酸时仰视
②未等稀释后的硫酸溶液冷却到室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥称量 固体时托盘天平的左边放置砝码
固体时托盘天平的左边放置砝码
⑦称取25.2g 固体,溶解在74.8mL的水中配制
固体,溶解在74.8mL的水中配制 溶液
溶液
(5)由于 容易氧化水中的有机物,在放置过程中浓度可能会有所变化。在使用之前,可以利用已知浓度的
容易氧化水中的有机物,在放置过程中浓度可能会有所变化。在使用之前,可以利用已知浓度的 来测定
来测定 溶液的浓度。该反应中,氧化剂和还原剂的物质的量之比为
溶液的浓度。该反应中,氧化剂和还原剂的物质的量之比为_______ 。
 溶液与一定浓度的硫酸混合使用。某实验需要480mL 1mol/L的
溶液与一定浓度的硫酸混合使用。某实验需要480mL 1mol/L的 和100g质量分数为25.2%的
和100g质量分数为25.2%的 溶液。要配制这两种溶液,进行了下列实验。请回答有关问题:
溶液。要配制这两种溶液,进行了下列实验。请回答有关问题:(1)实验室有化学纯的浓硫酸,其试剂瓶标签上的部分内容如下图:
| 【品名】硫酸 【化学式】  【纯度】化学纯(CP) 【相对分子质量】98 【规格】500mL 【密度】1.82  【质量分数】98% |
(2)要配制所需的两种溶液,下列仪器中需要使用的是烧杯、托盘天平和

(3)下列关于仪器的说法正确的是
A.使用前要检查容量瓶是否漏液
B.容量瓶上标有容积、温度和浓度
C.容量瓶和量筒用蒸馏水洗净后,需要烘干后再使用
D.量筒在量取浓硫酸后,需要洗涤,且要将洗涤液转入容量瓶中
E.该实验中多次使用玻璃棒,但是作用不同
(4)在两种溶液的配制过程中,下列操作中能使所配溶液的浓度偏低的有
①用量筒量取浓硫酸时仰视
②未等稀释后的硫酸溶液冷却到室温就转移到容量瓶中
③转移前,容量瓶中含有少量蒸馏水
④定容时,加蒸馏水超过标线,又用胶头滴管吸出
⑤定容时,俯视刻度线
⑥称量
 固体时托盘天平的左边放置砝码
固体时托盘天平的左边放置砝码⑦称取25.2g
 固体,溶解在74.8mL的水中配制
固体,溶解在74.8mL的水中配制 溶液
溶液(5)由于
 容易氧化水中的有机物,在放置过程中浓度可能会有所变化。在使用之前,可以利用已知浓度的
容易氧化水中的有机物,在放置过程中浓度可能会有所变化。在使用之前,可以利用已知浓度的 来测定
来测定 溶液的浓度。该反应中,氧化剂和还原剂的物质的量之比为
溶液的浓度。该反应中,氧化剂和还原剂的物质的量之比为
您最近一年使用:0次
名校
解题方法
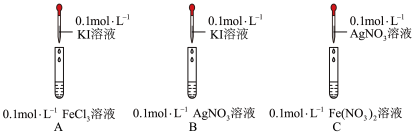
10 . 化学是一门以实验为基础的学科。某学习小组探究 、
、 能否将
能否将 氧化,开展如下活动。
氧化,开展如下活动。
(1)用 固体配制
固体配制 溶液,下列仪器中用到的有
溶液,下列仪器中用到的有_______ (填名称)。
A中反应的离子方程式为_______ ,说明氧化性: 。
。
(3)甲同学依据B中现象得出 不能氧化
不能氧化 ,乙同学表示不同意,依据是
,乙同学表示不同意,依据是_______ 。
(4)已知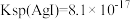 。将
。将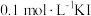 和
和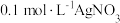 溶液等体积混合,混合后溶液中
溶液等体积混合,混合后溶液中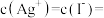
_______  。预测可能是
。预测可能是 、
、 浓度很小,氧化性、还原性很弱,二者直接接触不发生氧化还原反应。
浓度很小,氧化性、还原性很弱,二者直接接触不发生氧化还原反应。
(5)乙同学设计了如图实验:_______ (填“ ”或“
”或“ ”)。
”)。
②K闭合时,指针偏转,“石墨1”电极反应为_______ 。
③丙同学测得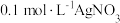 溶液的
溶液的 ,认为可能是
,认为可能是 氧化了
氧化了 。设计实验验证该猜想,将上述
。设计实验验证该猜想,将上述_______ (填“左烧杯”或“右烧杯”)中的溶液换成_______ 指针不偏转,丙同学猜想不成立。
综上所述: 、
、 都能将
都能将 氧化,但
氧化,但 与
与 直接接触时主要发生沉淀反应。
直接接触时主要发生沉淀反应。
 、
、 能否将
能否将 氧化,开展如下活动。
氧化,开展如下活动。(1)用
 固体配制
固体配制 溶液,下列仪器中用到的有
溶液,下列仪器中用到的有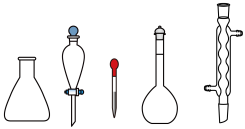
| 实验现象 |
| A中溶液呈棕黄色,滴加淀粉溶液,变蓝 | |
| B中产生黄色沉淀,滴加淀粉溶液,未变蓝 | |
C中产生黑色沉淀,滴加 溶液,变红 溶液,变红 |
 。
。(3)甲同学依据B中现象得出
 不能氧化
不能氧化 ,乙同学表示不同意,依据是
,乙同学表示不同意,依据是(4)已知
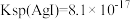 。将
。将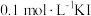 和
和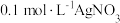 溶液等体积混合,混合后溶液中
溶液等体积混合,混合后溶液中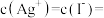
 。预测可能是
。预测可能是 、
、 浓度很小,氧化性、还原性很弱,二者直接接触不发生氧化还原反应。
浓度很小,氧化性、还原性很弱,二者直接接触不发生氧化还原反应。(5)乙同学设计了如图实验:
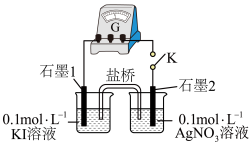
 ”或“
”或“ ”)。
”)。②K闭合时,指针偏转,“石墨1”电极反应为
③丙同学测得
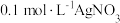 溶液的
溶液的 ,认为可能是
,认为可能是 氧化了
氧化了 。设计实验验证该猜想,将上述
。设计实验验证该猜想,将上述综上所述:
 、
、 都能将
都能将 氧化,但
氧化,但 与
与 直接接触时主要发生沉淀反应。
直接接触时主要发生沉淀反应。
您最近一年使用:0次
2024-03-31更新
|
793次组卷
|
3卷引用:广东省广州市天河区普通高中2023-2024学年高三毕业班综合测试(二)化学试题
广东省广州市天河区普通高中2023-2024学年高三毕业班综合测试(二)化学试题(已下线)题型9 实验综合题(25题)-2024年高考化学常考点必杀300题(新高考通用)广东省佛山市三水区三水中学2024届高三下学期全真模拟考试化学试题