名校
解题方法
1 . 高铁酸盐( )具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物
)具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物 可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
已知: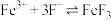
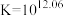

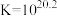
I.制备高铁酸盐
(1)制备 的原理是:
的原理是:

________
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的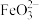 。此过程的反应为
。此过程的反应为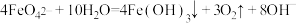 、
、___________ 。
为研究使 稳定的方法,分别做以下4个实验:
稳定的方法,分别做以下4个实验:
资料:吸光度大小与溶液中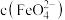 成正比。
成正比。

(3)甲同学预测d试管内的实验现象应与a试管相似,预测依据是___________ 。
(4)但吸光度结果图显示甲同学预测并不正确。结合化学用语,从化学反应速率角度解释d试管内的现象与a试管不同的原因是:___________ 。
(5)“—■—”曲线为___________ (填入“试管c”或“试管d”)的实验结果,理由是___________ 。
(6)综合以上讨论,任意写出一种能稳定 的方法
的方法___________ 。
 )具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物
)具有极强的氧化性和优良的絮凝功能,在水处理方面有一定的发展前景。但是由于存在自催化现象(即分解产物 可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。
可催化高铁酸盐的分解),限制了它的大规模应用,研究使其稳定的方法尤为关键。已知:
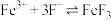
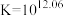

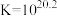
I.制备高铁酸盐
(1)制备
 的原理是:
的原理是:
Ⅱ.高铁酸盐稳定性的研究
(2)碱性环境下,久置的
 溶液中除了产生红褐色
溶液中除了产生红褐色 外,同时还会产生绿色的
外,同时还会产生绿色的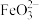 。此过程的反应为
。此过程的反应为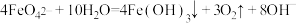 、
、为研究使
 稳定的方法,分别做以下4个实验:
稳定的方法,分别做以下4个实验:| 序号 | X | 现象 | |
 | a | 2滴0.01 mol/L KI | 紫色迅速褪去 |
| b | 2滴蒸馏水 | 分别用紫外可见分光光度计测三支试管内溶液的吸光度,结果如下图所示。 | |
| c | 2滴0.01 mol/L NaF 溶液 | ||
| d | 2滴0.01 mol/L  溶液 溶液 |
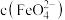 成正比。
成正比。
(3)甲同学预测d试管内的实验现象应与a试管相似,预测依据是
(4)但吸光度结果图显示甲同学预测并不正确。结合化学用语,从化学反应速率角度解释d试管内的现象与a试管不同的原因是:
(5)“—■—”曲线为
(6)综合以上讨论,任意写出一种能稳定
 的方法
的方法
您最近一年使用:0次
2023-05-07更新
|
588次组卷
|
2卷引用:北京市昌平区2023届高三下学期第二次统一练习化学试题
解题方法
2 . 某兴趣小组探究电镀银实验。回答下列问题:
I.实验准备。
(1)用 固体配制
固体配制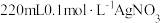 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是___________ (填字母)。___________ 。
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与 浓度有关。
浓度有关。
【查阅资料】
络合反应: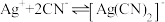 ,
,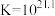 。
。
【设计实验】
【问题讨论】
(3)实验a中,溶液变红色的可能原因是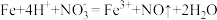 和
和___________ (用离子方程式表示,已知氧化性: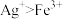 )。
)。
(4)①实验a、b的阴极都伴随有气泡,其原因是___________ (写电极反应式)。
②实验b比实验a产生的镀层光亮、致密,其原理是___________ 。
③一段时间后,实验b中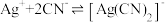 平衡不移动,其原因是
平衡不移动,其原因是___________ 。
【实验结论】
其他条件不变, 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。
Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与
 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。
表2:其他条件不变,温度对镀层外观的影响。
(5)表1中 含量为
含量为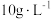 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是___________ ;
表2中温度为 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是___________ 。
Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由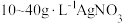 溶液和
溶液和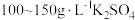 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。
(6)使用新配方可以达到同样的目的,其原理是___________ 。已知: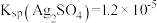 。
。
I.实验准备。
(1)用
 固体配制
固体配制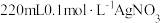 溶液,不需要使用的仪器是
溶液,不需要使用的仪器是A. B.
B. C.
C. D.
D. E.
E.
Ⅱ.探究银离子对镀层的影响。
【提出猜想】
镀层外观与
 浓度有关。
浓度有关。【查阅资料】
络合反应:
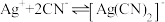 ,
,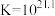 。
。【设计实验】
| 实验 | 装置 | 现象 |
| a |
 的 的 溶液(含少量 溶液(含少量 ) ) | 阴极表面有疏松的黑色物质生成并伴随有无色气泡,一段时间后,取阴极区电解质溶液于试管,滴加 溶液,溶液变为红色。 溶液,溶液变为红色。 |
| b |
 的 的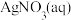 与过量 与过量 混合(含少量 混合(含少量 ) ) | 阴极表面有光亮、致密的银白色物质生成,仍然有少量无色气泡。一段时间后,取少量阴极区溶液于试管,滴加 溶液,溶液不变红。 溶液,溶液不变红。 |
(3)实验a中,溶液变红色的可能原因是
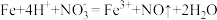 和
和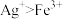 )。
)。(4)①实验a、b的阴极都伴随有气泡,其原因是
②实验b比实验a产生的镀层光亮、致密,其原理是
③一段时间后,实验b中
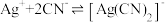 平衡不移动,其原因是
平衡不移动,其原因是【实验结论】
其他条件不变,
 浓度很小时,银镀层光亮、致密。
浓度很小时,银镀层光亮、致密。Ⅲ.探究温度、含量对镀层的影响。
表1:其他条件不变,与

 溶液等体积混合的溶液中含量对镀层外观的影响。
溶液等体积混合的溶液中含量对镀层外观的影响。 含量( 含量(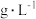 ) ) | 镀层外观表象 |
| 10 | 镀层模糊,无光泽 |
| 25 | 镀层呈雾状,光泽不足 |
| 50 | 镀层光亮、致密 |
温度/ | 镀层外观表象 |
| 25 | 光亮 |
| 35 | 光亮 |
| 40 | 光亮 |
| 55 | 光亮不均匀 |
(5)表1中
 含量为
含量为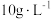 时,镀层模糊、无光泽的原因是
时,镀层模糊、无光泽的原因是表2中温度为
 时镀层光亮不均匀的主要原因是
时镀层光亮不均匀的主要原因是Ⅳ.探究新配方电镀银。
由于电镀液使用氰化钾,在电镀过程中会产生有毒气体,以及废液含剧毒的氰化物,不符合环境要求。由
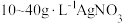 溶液和
溶液和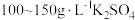 溶液组成电镀液也可以得到光亮、致密的镀层。
溶液组成电镀液也可以得到光亮、致密的镀层。(6)使用新配方可以达到同样的目的,其原理是
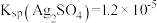 。
。
您最近一年使用:0次
2024-04-16更新
|
345次组卷
|
5卷引用:2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学
2024届陕西省商洛市高三下学期第三次尖子生学情诊断考试理综试题-高中化学2024届青海省西宁市大通县高三下学期第二次模拟考试理科综合试题-高中化学2024届青海省玉树州高三下学期第四次联考理综试题-高中化学2024届河南省TOP二十名校联考高三下学期5月猜题(一)理科综合试卷-高中化学(已下线)压轴题12?化学实验综合题(5大题型+方法总结+压轴题速练)-2024年高考化学压轴题专项训练(新高考通用)
3 . 某学习小组根据双氧水中的化合价探究其性质,查找资料得到以下反应:
反应1:H2O2+2HCl+2FeCl2=2FeCl3+2H2O
反应2:5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O
反应3:H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2
关于这三个反应的描述正确的是
反应1:H2O2+2HCl+2FeCl2=2FeCl3+2H2O
反应2:5H2O2+2KMnO4+3H2SO4=K2SO4+2MnSO4+5O2↑+8H2O
反应3:H2O2+2ClO2+2NaOH=2NaClO2+2H2O+O2
关于这三个反应的描述正确的是
| A.H2O2均做氧化剂 |
| B.H2O2无论做氧化剂还是还原剂都是绿色的 |
| C.每反应1molH2O2,均转移1mol电子 |
| D.H2O2的氧化性在碱性条件下比ClO2强 |
您最近一年使用:0次
名校
4 . 高铁酸钾( ,极易溶于水)是常见的水处理剂,其原理如图所示。
,极易溶于水)是常见的水处理剂,其原理如图所示。
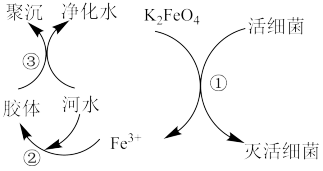
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
请回答下列问题:
(1) 中铁元素的化合价为
中铁元素的化合价为_______ 价。
(2)过程①中活性菌表现了_______ (填“氧化”或“还原”)性,该过程的还原产物是_______ (填离子符号);过程③属于_______ (填“物理”或“化学”)变化。
(3)根据上述原理分析,作水处理剂时, 的作用有
的作用有_______ (填两个)。
(4)制备高铁酸钾常用的反应原理为 (反应未配平)。
(反应未配平)。
①该反应中,Cl元素的化合价由_______ 价变为_______ 价;通过该反应说明:在碱性条件下,氧化性
_______ (填“>”、“=”或“<”) 。
。
②配平该反应的化学方程式,并用双线桥法表示电子转移的方向和数目:_______ ,将该反应改写为离子方程式:_______ 。
 ,极易溶于水)是常见的水处理剂,其原理如图所示。
,极易溶于水)是常见的水处理剂,其原理如图所示。
【查阅资料】向胶体中加入电解质后,胶体因失去稳定性而发生离子的聚集以至沉淀,称为电解质对胶体的聚沉作用,简称胶体的聚沉。
请回答下列问题:
(1)
 中铁元素的化合价为
中铁元素的化合价为(2)过程①中活性菌表现了
(3)根据上述原理分析,作水处理剂时,
 的作用有
的作用有(4)制备高铁酸钾常用的反应原理为
 (反应未配平)。
(反应未配平)。①该反应中,Cl元素的化合价由

 。
。②配平该反应的化学方程式,并用双线桥法表示电子转移的方向和数目:
您最近一年使用:0次
2022-11-03更新
|
270次组卷
|
3卷引用:河南省豫南名校2022-2023学年高一上学期期中联考化学试题
解题方法
5 . 实验室利用下列装置进行氯气的制取并进行相关物质氧化性强弱的探究实验,回答下列问题:
资料:i.C中试剂为10mL40%的NaOH溶液,同时滴入了5滴 的
的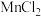 溶液;
溶液;
ii. 的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱;
的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱;
iii. 在溶液中显绿色。
在溶液中显绿色。
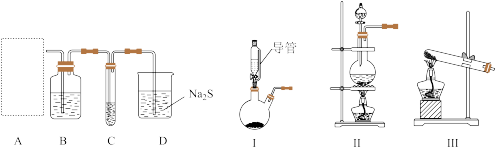
(1)I中导管的作用是_______ ,B中试剂为_______ 。
(2)若实验室用 ,制取
,制取 ,气体发生装置应选择
,气体发生装置应选择_______ (填标号,下同),若用 制取
制取 ,则气体发生装置为
,则气体发生装置为_______ 。由此可判断出氧化性:
_______ (填“>”、“<”或“=”) 。
。
(3)D中的实验现象为_______ ,通过D中现象,得出的结论为_______ 。
(4)实验开始后,C中的实验现象如下:
已知:棕黑色沉淀为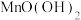 。
。
①通入 前,生成的白色沉淀为
前,生成的白色沉淀为_______ (填化学式)。
②通入少量 后,棕黑色沉淀增多的原因是
后,棕黑色沉淀增多的原因是_______ (用离子方程式表示)。
③取放置后的1ml悬浊液,加入4mL40%NaOH溶液,再通入 ,沉淀迅速消失,绿色加深。原因是
,沉淀迅速消失,绿色加深。原因是_______ (用离子方程式表示)。
资料:i.C中试剂为10mL40%的NaOH溶液,同时滴入了5滴
 的
的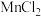 溶液;
溶液;ii.
 的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱;
的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱;iii.
 在溶液中显绿色。
在溶液中显绿色。
(1)I中导管的作用是
(2)若实验室用
 ,制取
,制取 ,气体发生装置应选择
,气体发生装置应选择 制取
制取 ,则气体发生装置为
,则气体发生装置为
 。
。(3)D中的实验现象为
(4)实验开始后,C中的实验现象如下:
| C中实验现象 | |
通入 前 前 | 通入少量 后 后 |
滴入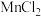 溶液时产生白色沉淀 溶液时产生白色沉淀在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液 变为绿色,仍有沉淀 |
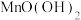 。
。①通入
 前,生成的白色沉淀为
前,生成的白色沉淀为②通入少量
 后,棕黑色沉淀增多的原因是
后,棕黑色沉淀增多的原因是③取放置后的1ml悬浊液,加入4mL40%NaOH溶液,再通入
 ,沉淀迅速消失,绿色加深。原因是
,沉淀迅速消失,绿色加深。原因是
您最近一年使用:0次
2022-10-23更新
|
204次组卷
|
2卷引用:广东省湛江市2023届高中毕业班10月调研测试化学试题
名校
解题方法
6 . 生产芯片的半导体材料有硅、锗、砷化镓等,应用比较广泛的是硅。硅可由石英砂(主要成分是二氧化硅)制得,制备高纯硅的主要工艺流程如图所示:

资料:①SiHCl3能与H2O剧烈反应,在空气中易自燃;②粗SiHCl3 (沸点33.0℃)中含有少量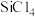 (沸点57.6℃)和HCl(沸点-84.7℃)
(沸点57.6℃)和HCl(沸点-84.7℃)
(1)流程①焦炭体现了___________ (填“氧化性”或“还原性”)。
(2)流程③提纯SiHCl3的操作是___________ 。
(3)流程④的化学反应为置换反应,写出其化学方程式:___________ 。
流程④制备高纯硅的装置如图(热源及夹持装置略去):

(4)若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,需要的是___________ (填选项编号):
a. 分液漏斗 b.烧瓶 c.酒精灯 d.大试管 e.漏斗 f.烧杯 g.导管
装置B中的试剂是___________ (填试剂名称);装置C中的烧瓶需要加热,其目的是___________ 。
(5)反应一段时间后,装置D中观察到的现象是___________ 。
(6)为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及___________ ,该流程中能够循环利用的物质是___________ 。

资料:①SiHCl3能与H2O剧烈反应,在空气中易自燃;②粗SiHCl3 (沸点33.0℃)中含有少量
 (沸点57.6℃)和HCl(沸点-84.7℃)
(沸点57.6℃)和HCl(沸点-84.7℃)(1)流程①焦炭体现了
(2)流程③提纯SiHCl3的操作是
(3)流程④的化学反应为置换反应,写出其化学方程式:
流程④制备高纯硅的装置如图(热源及夹持装置略去):

(4)若要从下列玻璃仪器中选择部分来组装A处的气体发生装置,需要的是
a. 分液漏斗 b.烧瓶 c.酒精灯 d.大试管 e.漏斗 f.烧杯 g.导管
装置B中的试剂是
(5)反应一段时间后,装置D中观察到的现象是
(6)为保证制备高纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及
您最近一年使用:0次
名校
解题方法
7 . 铬的化合物有毒,由于Cr(Ⅵ)的强氧化性,其毒性是Cr(Ⅲ)毒性的100倍,因此必须对排放的含铬废水进行处理。实验小组收集的某500mL废水中含铬元素的质量为28.6g,还含 杂质,查阅资料设计还原法处理含Cr(Ⅵ)的废水实现铬的回收流程如图所示。
杂质,查阅资料设计还原法处理含Cr(Ⅵ)的废水实现铬的回收流程如图所示。

已知:①在酸性环境中, 的氧化性强于
的氧化性强于 。
。
② (焦亚硫酸钠)水溶液呈酸性,与强酸接触则放出二氧化硫并生成相应的盐类。
(焦亚硫酸钠)水溶液呈酸性,与强酸接触则放出二氧化硫并生成相应的盐类。
下列说法错误的是
 杂质,查阅资料设计还原法处理含Cr(Ⅵ)的废水实现铬的回收流程如图所示。
杂质,查阅资料设计还原法处理含Cr(Ⅵ)的废水实现铬的回收流程如图所示。
已知:①在酸性环境中,
 的氧化性强于
的氧化性强于 。
。②
 (焦亚硫酸钠)水溶液呈酸性,与强酸接触则放出二氧化硫并生成相应的盐类。
(焦亚硫酸钠)水溶液呈酸性,与强酸接触则放出二氧化硫并生成相应的盐类。下列说法错误的是
A.若“酸化”时 有 有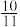 转化为 转化为 ,酸化后所得溶液中 ,酸化后所得溶液中 |
| B.“还原”工序中若加硫酸溶液调pH过低,还原处理含铬(Ⅵ)效果不好 |
C.“沉铬”时会产生 气体 气体 |
D.灼烧 得到产品 得到产品 ,再用铝热法进行冶炼可得到铬单质 ,再用铝热法进行冶炼可得到铬单质 |
您最近一年使用:0次
名校
8 . 1841年美国学者Fremy首次合成了 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。
实验(一)制备 ,装置如图所示:
,装置如图所示:

(1)乙装置的作用是___________ 。
(2)甲装置中副产物为氯化钾,写出生成 的离子方程式:
的离子方程式:___________ 。
(3)实验完毕后,对甲装置中混合液蒸发浓缩、___________ 、过滤、洗涤、低温干燥。
实验(二)探究 性质及应用。
性质及应用。
取10g草酸溶于40mL水中,加入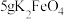 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
(4)根据上述实验现象,可以判断产生的气体中含有___________ ,产生该气体的原因是___________ ,经测定所得气体中还含有 。
。
(5)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分。
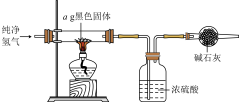
当黑色固体完全反应后,测得浓硫酸质量净增bg,当 等于
等于___________ (用分数表示)时,黑色固体为 。
。
(6)在其他条件相同时,测得一定浓度的 稳定性(用
稳定性(用 浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
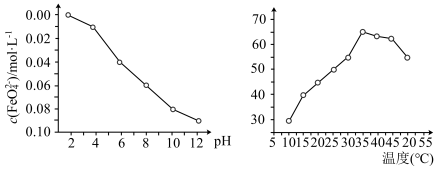
①根据左图得出结论是___________ 。
②在相同条件下, 作消毒剂最佳温度是
作消毒剂最佳温度是___________ 。
(7)查阅资料可知, 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“ ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
方案1:在 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。
方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。

实验___________ (填“1”或“2”)能证明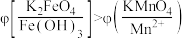 。
。
 ,它是一种“环境友好型氧化剂”。某小组拟制备
,它是一种“环境友好型氧化剂”。某小组拟制备 ,并探究其性质。已知20℃时KCl的溶解度为37.4g,
,并探究其性质。已知20℃时KCl的溶解度为37.4g, 的溶解度为11.1g。
的溶解度为11.1g。实验(一)制备
 ,装置如图所示:
,装置如图所示:
(1)乙装置的作用是
(2)甲装置中副产物为氯化钾,写出生成
 的离子方程式:
的离子方程式:(3)实验完毕后,对甲装置中混合液蒸发浓缩、
实验(二)探究
 性质及应用。
性质及应用。取10g草酸溶于40mL水中,加入
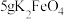 粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。
粉末,充分混合,观察到有大量气泡产生,并产生黑色固体,将所得气体通入足量澄清石灰水中,溶液变浑浊。(4)根据上述实验现象,可以判断产生的气体中含有
 。
。(5)实验完毕后,将混合物经过滤、洗涤、干燥得到黑色固体,利用如图实验装置探究黑色固体的成分。

当黑色固体完全反应后,测得浓硫酸质量净增bg,当
 等于
等于 。
。(6)在其他条件相同时,测得一定浓度的
 稳定性(用
稳定性(用 浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
浓度表示)与pH关系如左图,其消毒效率与温度关系如右图所示:
①根据左图得出结论是
②在相同条件下,
 作消毒剂最佳温度是
作消毒剂最佳温度是(7)查阅资料可知,
 溶液呈紫红色,为探究
溶液呈紫红色,为探究 和
和 的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“
的电位相对大小,设计如下方案。(已知:电位一般指“电势”,用“ ”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)
”表示。氧化剂的电位是衡量其氧化性强度主要参数,电位越高,对应条件下氧化剂的氧化性越强。)方案1:在
 溶液中加过量的
溶液中加过量的 粉末,溶液呈紫红色。
粉末,溶液呈紫红色。方案2:如图所示,关闭K时,观察到电流计指针偏转,铂极产生红褐色物质,石墨极附近无色溶液变紫红色。

实验
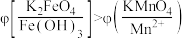 。
。
您最近一年使用:0次
名校
9 . 类比是化学学习的重要方法之一, 与
与 在结构和性质上有很多相似的地方。过氧化钙(
在结构和性质上有很多相似的地方。过氧化钙( )是一种难溶于水、可与水缓慢反应、能溶于酸的白色固体,广泛用于蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法。
)是一种难溶于水、可与水缓慢反应、能溶于酸的白色固体,广泛用于蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法。
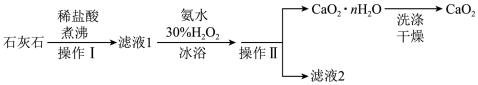
已知: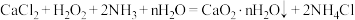 。
。
(1) 中氧元素化合价为
中氧元素化合价为___________ 。
(2) 中阳离子和阴离子的个数之比为
中阳离子和阴离子的个数之比为___________ 。
(3) 可用于长途运输鱼苗,其原因是
可用于长途运输鱼苗,其原因是___________ (用化学方程式解释)。
(4)操作Ⅰ和操作Ⅱ的名称是___________ 。
(5)操作Ⅱ可得到 沉淀,取实验得到的2.76g
沉淀,取实验得到的2.76g  粗品(含有杂质)在密闭容器中加热,其受热脱水过程的热重曲线(140℃时完全脱水,杂质受热不分解)如图所示。
粗品(含有杂质)在密闭容器中加热,其受热脱水过程的热重曲线(140℃时完全脱水,杂质受热不分解)如图所示。
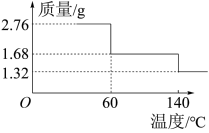
60℃时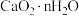 中n=
中n=___________ 。
(6)实验小组同学查阅资料知: 的氧化性强于
的氧化性强于 。设计如下实验进行验证,向
。设计如下实验进行验证,向 溶液中加入
溶液中加入 固体,振荡,向反应后的溶液中
固体,振荡,向反应后的溶液中___________ (填实验操作与现象),则证明 的氧化性强于
的氧化性强于 。
。
 与
与 在结构和性质上有很多相似的地方。过氧化钙(
在结构和性质上有很多相似的地方。过氧化钙( )是一种难溶于水、可与水缓慢反应、能溶于酸的白色固体,广泛用于蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法。
)是一种难溶于水、可与水缓慢反应、能溶于酸的白色固体,广泛用于蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法。
已知:
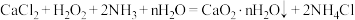 。
。(1)
 中氧元素化合价为
中氧元素化合价为(2)
 中阳离子和阴离子的个数之比为
中阳离子和阴离子的个数之比为(3)
 可用于长途运输鱼苗,其原因是
可用于长途运输鱼苗,其原因是(4)操作Ⅰ和操作Ⅱ的名称是
(5)操作Ⅱ可得到
 沉淀,取实验得到的2.76g
沉淀,取实验得到的2.76g  粗品(含有杂质)在密闭容器中加热,其受热脱水过程的热重曲线(140℃时完全脱水,杂质受热不分解)如图所示。
粗品(含有杂质)在密闭容器中加热,其受热脱水过程的热重曲线(140℃时完全脱水,杂质受热不分解)如图所示。
60℃时
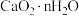 中n=
中n=(6)实验小组同学查阅资料知:
 的氧化性强于
的氧化性强于 。设计如下实验进行验证,向
。设计如下实验进行验证,向 溶液中加入
溶液中加入 固体,振荡,向反应后的溶液中
固体,振荡,向反应后的溶液中 的氧化性强于
的氧化性强于 。
。
您最近一年使用:0次
2023·全国·模拟预测
10 . 某学习小组探究 溶液与KI溶液的反应。资料:i.氧化性:
溶液与KI溶液的反应。资料:i.氧化性: ,
, 可以氧化
可以氧化 生成
生成 ;ii.KI溶液暴露在空气中或久置会变为黄色。
;ii.KI溶液暴露在空气中或久置会变为黄色。
Ⅰ.探究反应原理
(1)甲同学对两溶液可能发生的反应提出了下列两种猜想:
猜想a: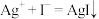
猜想b:
甲同学设计了如下实验进行论证。
甲同学根据实验现象得出猜想a成立,猜想b不成立,依据的实验现象是___________ 。
(2)乙同学认为上述实验结果可以证明猜想a成立,但不足以证明猜想b不成立。猜想b可能成立的理由是___________ 。
Ⅱ. 与
与 是否能发生氧化还原反应
是否能发生氧化还原反应
为探究 与
与 是否能发生氧化还原反应,丙同学设计了如下实验装置(盐桥中装有含
是否能发生氧化还原反应,丙同学设计了如下实验装置(盐桥中装有含 饱和溶液的琼胶):
饱和溶液的琼胶):

(3)若左侧电极为负极,右侧电极为正极,则左、右烧杯中的试剂X和Y分别是___________ 、___________ 。
(4)电池反应一段时间后,KI溶液逐渐变为黄色。为进一步证明 与
与 发生了氧化还原反应,丙同学取少量盛装KI溶液烧杯中的液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出
发生了氧化还原反应,丙同学取少量盛装KI溶液烧杯中的液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出 和
和 发生了氧化还原反应,是否合理?
发生了氧化还原反应,是否合理?___________ ;说明理由:___________ 。
(5)电流表指针发生明显偏转,结合(4)可知, 溶液中发生的电极反应式为
溶液中发生的电极反应式为___________ ,KI溶液中发生的电极反应式为___________ ,因此验证了 与
与 能发生氧化还原反应。
能发生氧化还原反应。
 溶液与KI溶液的反应。资料:i.氧化性:
溶液与KI溶液的反应。资料:i.氧化性: ,
, 可以氧化
可以氧化 生成
生成 ;ii.KI溶液暴露在空气中或久置会变为黄色。
;ii.KI溶液暴露在空气中或久置会变为黄色。Ⅰ.探究反应原理
(1)甲同学对两溶液可能发生的反应提出了下列两种猜想:
猜想a:
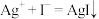
猜想b:

甲同学设计了如下实验进行论证。
| 实验序号 | 实验操作 |
| 1 | 向盛有1mL  溶液的试管中,加入1mL 溶液的试管中,加入1mL KI溶液 KI溶液 |
| 2 | 向实验1的试管中滴加淀粉溶液 |
(2)乙同学认为上述实验结果可以证明猜想a成立,但不足以证明猜想b不成立。猜想b可能成立的理由是
Ⅱ.
 与
与 是否能发生氧化还原反应
是否能发生氧化还原反应为探究
 与
与 是否能发生氧化还原反应,丙同学设计了如下实验装置(盐桥中装有含
是否能发生氧化还原反应,丙同学设计了如下实验装置(盐桥中装有含 饱和溶液的琼胶):
饱和溶液的琼胶):
(3)若左侧电极为负极,右侧电极为正极,则左、右烧杯中的试剂X和Y分别是
(4)电池反应一段时间后,KI溶液逐渐变为黄色。为进一步证明
 与
与 发生了氧化还原反应,丙同学取少量盛装KI溶液烧杯中的液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出
发生了氧化还原反应,丙同学取少量盛装KI溶液烧杯中的液体,向其中加入淀粉溶液,淀粉变蓝。丙同学由此得出 和
和 发生了氧化还原反应,是否合理?
发生了氧化还原反应,是否合理?(5)电流表指针发生明显偏转,结合(4)可知,
 溶液中发生的电极反应式为
溶液中发生的电极反应式为 与
与 能发生氧化还原反应。
能发生氧化还原反应。
您最近一年使用:0次