1 . 某实验小组制备高铁酸钾(K2FeO4),并探究其性质。
已知:K2FeO4为紫色固体,微溶于KOH溶液中呈紫色溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)

(1)装置A为氯气发生装置,装置C中得到紫色固体和溶液。请写出C中由Cl2参加反应生成高铁酸钾的化学方程式___ 。
(2)将装置C中所得混合物进行抽滤,请选择合适的操作并排序___ 。
a.倾析法转移溶液
b.转移固体至漏斗
c.使用玻璃砂漏斗
d.开大抽气装置水龙头
e.关闭抽气装置水龙头
f.断开抽气泵和吸滤瓶之间的橡皮管
g.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸
h.用蒸馏水润湿滤纸,微开水龙头,使滤纸与漏斗瓷板紧贴
Ⅱ.探究K2FeO4的性质
(3)取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
①用KOH溶液充分洗涤装置C中所得固体
②再用KOH溶液将固体K2FeO4溶出,得到紫色溶液a取少量a,滴加盐酸,有Cl2产生。该方案可证明K2FeO4氧化了Cl-,①中用KOH溶液洗涤的目的是___ 。
(4)资料表明,酸性溶液中的氧化性FeO >MnO
>MnO 。验证实验如下:将溶液a滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象可证明氧化性FeO
。验证实验如下:将溶液a滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象可证明氧化性FeO >MnO
>MnO 。请说明理由
。请说明理由___ 。
Ⅲ.K2FeO4产品纯度的测定
(5)准确称取3.00gK2FeO4样品于锥形瓶中,加入足量KOH溶液和50.00mL0.4200mol•L-1Na3AsO3溶液,充分反应后加入稀硫酸酸化,用0.1000mol•L-1KBrO3标准溶液滴定剩余的Na3AsO3溶液,恰好完全反应时消耗KBrO3标准溶液的体积为20.00mL。(K2FeO4摩尔质量为198gmol•L-1)
已知测定过程中发生的反应有:
FeO +AsO
+AsO +H2O→Fe(OH)3+AsO
+H2O→Fe(OH)3+AsO +OH-(未配平)
+OH-(未配平)
AsO +BrO
+BrO →AsO
→AsO +Br-(未配平)
+Br-(未配平)
样品中K2FeO4的质量分数为___ (保留三位有效数字,杂质不参与化学反应)。
已知:K2FeO4为紫色固体,微溶于KOH溶液中呈紫色溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
Ⅰ.制备K2FeO4(夹持装置略)

(1)装置A为氯气发生装置,装置C中得到紫色固体和溶液。请写出C中由Cl2参加反应生成高铁酸钾的化学方程式
(2)将装置C中所得混合物进行抽滤,请选择合适的操作并排序
a.倾析法转移溶液
b.转移固体至漏斗
c.使用玻璃砂漏斗
d.开大抽气装置水龙头
e.关闭抽气装置水龙头
f.断开抽气泵和吸滤瓶之间的橡皮管
g.选择比布氏漏斗内径略小又能将全部小孔盖住的滤纸
h.用蒸馏水润湿滤纸,微开水龙头,使滤纸与漏斗瓷板紧贴
Ⅱ.探究K2FeO4的性质
(3)取装置C中紫色溶液,加入稀硫酸,产生黄绿色气体,经检验气体中含有Cl2。为证明是否K2FeO4氧化了Cl-而产生Cl2,设计以下方案:
①用KOH溶液充分洗涤装置C中所得固体
②再用KOH溶液将固体K2FeO4溶出,得到紫色溶液a取少量a,滴加盐酸,有Cl2产生。该方案可证明K2FeO4氧化了Cl-,①中用KOH溶液洗涤的目的是
(4)资料表明,酸性溶液中的氧化性FeO
 >MnO
>MnO 。验证实验如下:将溶液a滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象可证明氧化性FeO
。验证实验如下:将溶液a滴入MnSO4和足量H2SO4的混合溶液中,振荡后溶液呈浅紫色,该现象可证明氧化性FeO >MnO
>MnO 。请说明理由
。请说明理由Ⅲ.K2FeO4产品纯度的测定
(5)准确称取3.00gK2FeO4样品于锥形瓶中,加入足量KOH溶液和50.00mL0.4200mol•L-1Na3AsO3溶液,充分反应后加入稀硫酸酸化,用0.1000mol•L-1KBrO3标准溶液滴定剩余的Na3AsO3溶液,恰好完全反应时消耗KBrO3标准溶液的体积为20.00mL。(K2FeO4摩尔质量为198gmol•L-1)
已知测定过程中发生的反应有:
FeO
 +AsO
+AsO +H2O→Fe(OH)3+AsO
+H2O→Fe(OH)3+AsO +OH-(未配平)
+OH-(未配平)AsO
 +BrO
+BrO →AsO
→AsO +Br-(未配平)
+Br-(未配平)样品中K2FeO4的质量分数为
您最近一年使用:0次
2 . 中秋节吃月饼的时候,月饼包装内有一小包标注了“脱氧剂”的物质,从标注可以看出该物质具有
| A.还原性 | B.氧化性 | C.碱性 | D.酸性 |
您最近一年使用:0次
真题
名校
3 . 不同条件下,当KMnO4与KI按照反应①②的化学计量比恰好反应,结果如下。
已知: 的氧化性随酸性减弱而减弱。
的氧化性随酸性减弱而减弱。
下列说法正确的是
| 反应序号 | 起始酸碱性 | KI | KMnO4 | 还原产物 | 氧化产物 |
| 物质的量/mol | 物质的量/mol | ||||
| ① | 酸性 | 0.001 | n | Mn2+ | I2 |
| ② | 中性 | 0.001 | 10n | MnO2 | 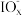 |
 的氧化性随酸性减弱而减弱。
的氧化性随酸性减弱而减弱。下列说法正确的是
A.反应①, |
B.对比反应①和②,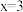 |
C.对比反应①和②, 的还原性随酸性减弱而减弱 的还原性随酸性减弱而减弱 |
D.随反应进行,体系 变化:①增大,②不变 变化:①增大,②不变 |
您最近一年使用:0次
2024-06-27更新
|
2716次组卷
|
8卷引用:2024年北京高考真题化学试题
名校
4 . 探究 的还原性
的还原性
实验I粉红色的 溶液或
溶液或 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。
实验Ⅱ向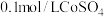 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。
实验Ⅲ按下图装置进行实验,观察到电压表指针偏转。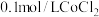 溶液替换为0.2mol/LNaCl溶液,电压表指针偏转幅度与实验Ⅲ相同。
溶液替换为0.2mol/LNaCl溶液,电压表指针偏转幅度与实验Ⅲ相同。
 的还原性
的还原性实验I粉红色的
 溶液或
溶液或 溶液在空气中久置,无明显变化。
溶液在空气中久置,无明显变化。实验Ⅱ向
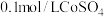 溶液中滴入2滴酸性
溶液中滴入2滴酸性 溶液,无明显变化。
溶液,无明显变化。实验Ⅲ按下图装置进行实验,观察到电压表指针偏转。
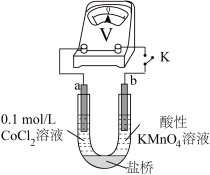
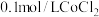 溶液替换为0.2mol/LNaCl溶液,电压表指针偏转幅度与实验Ⅲ相同。
溶液替换为0.2mol/LNaCl溶液,电压表指针偏转幅度与实验Ⅲ相同。实验V: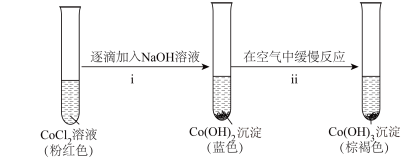
A.根据实验Ⅲ得出结论: 可以被酸性 可以被酸性 溶液氧化 溶液氧化 |
B.根据实验Ⅱ、Ⅲ和Ⅳ得出结论: 不能被酸性 不能被酸性 溶液氧化 溶液氧化 |
C.产生实验I和V的实验现象原因: 在碱性条件下, 在碱性条件下, 与 与 , , 反应,使 反应,使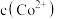 和 和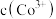 均降低,但 均降低,但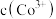 降低的程度更大,导致还原性 降低的程度更大,导致还原性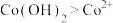 |
D.由实验I和V可知:氧化性 |
您最近一年使用:0次
名校
5 . 注水法是指石油开采时向地底注入水,以将石油挤出地表的技术。除去水中的氧气能有效防止地下管道被氧化腐蚀。
1.对于注水法可以将石油挤出地表的原理,下列说法正确的是:_______。
2.注入地底采用的水要预先进行除氧操作,化学除氧法一般会在水中加入 溶液,在碱性条件下除氧效果出色。书写发生的氧化半反应的方程式:
溶液,在碱性条件下除氧效果出色。书写发生的氧化半反应的方程式:_______ 。实验发现在水中加入微量的 能大大加快除氧效率,推测
能大大加快除氧效率,推测 的作用是
的作用是_______ 。
3. 在酸性和高温条件下除氧效果不佳,尝试从平衡移动的角度解释原因:
在酸性和高温条件下除氧效果不佳,尝试从平衡移动的角度解释原因:_______ 。(已知:还原性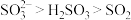 )
)
经过科学家不断研究,已经找到了许多效果更好的除氧剂,如联氨、抗坏血酸、纳米铁等。
4.联氨化学式为 ,在除氧的同时,还能将铜质管道内壁因氧化形成的
,在除氧的同时,还能将铜质管道内壁因氧化形成的 转化为
转化为 ,配平发生该反应的化学方程式
,配平发生该反应的化学方程式_______ 。
_______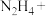 _______
_______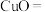 _______
_______ _______
_______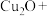 _______
_______
5. 是一层致密的钝化层,能保护输送管道,
是一层致密的钝化层,能保护输送管道, 形成钝化层体现了其_______的性质。
形成钝化层体现了其_______的性质。
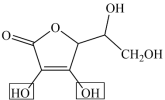
6.抗坏血酸结构简式如图,其中含氧官能团的名称是_______ ,抗坏血酸结构中有_______ 个手性碳原子。 。从结构的角度说明该基团具有酸性的原因:
。从结构的角度说明该基团具有酸性的原因:_______ 。
8.纳米铁是粒径达到纳米级别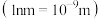 的单质铁,将水通过负载有纳米铁的树脂后可以有效除去水中的氧气,下列说法正确的是 。
的单质铁,将水通过负载有纳米铁的树脂后可以有效除去水中的氧气,下列说法正确的是 。
1.对于注水法可以将石油挤出地表的原理,下列说法正确的是:_______。
| A.石油能溶于水 | B.石油的密度比水大 |
| C.石油的密度比水小 | D.石油的沸点比水高 |
 溶液,在碱性条件下除氧效果出色。书写发生的氧化半反应的方程式:
溶液,在碱性条件下除氧效果出色。书写发生的氧化半反应的方程式: 能大大加快除氧效率,推测
能大大加快除氧效率,推测 的作用是
的作用是3.
 在酸性和高温条件下除氧效果不佳,尝试从平衡移动的角度解释原因:
在酸性和高温条件下除氧效果不佳,尝试从平衡移动的角度解释原因: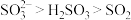 )
)经过科学家不断研究,已经找到了许多效果更好的除氧剂,如联氨、抗坏血酸、纳米铁等。
4.联氨化学式为
 ,在除氧的同时,还能将铜质管道内壁因氧化形成的
,在除氧的同时,还能将铜质管道内壁因氧化形成的 转化为
转化为 ,配平发生该反应的化学方程式
,配平发生该反应的化学方程式_______
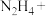 _______
_______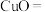 _______
_______ _______
_______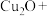 _______
_______5.
 是一层致密的钝化层,能保护输送管道,
是一层致密的钝化层,能保护输送管道, 形成钝化层体现了其_______的性质。
形成钝化层体现了其_______的性质。| A.强氧化性 | B.强还原性 | C.强酸性 | D.强碱性 |
 。从结构的角度说明该基团具有酸性的原因:
。从结构的角度说明该基团具有酸性的原因:8.纳米铁是粒径达到纳米级别
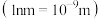 的单质铁,将水通过负载有纳米铁的树脂后可以有效除去水中的氧气,下列说法正确的是 。
的单质铁,将水通过负载有纳米铁的树脂后可以有效除去水中的氧气,下列说法正确的是 。| A.使用铁片不能有效除去水中的氧气,因为纳米铁和铁片的化学性质不同 |
| B.纳米铁属于胶体 |
| C.纳米铁保存时可以放置在空气中 |
| D.纳米铁能快速除去氧气与其高效的吸附能力有关 |
您最近一年使用:0次
解题方法
6 . 在包装糕点盒中会附有食品保鲜剂,里边的主要成分是铁粉,它可以预防食物变质,这说明铁粉具有
| A.酸性 | B.碱性 | C.氧化性 | D.还原性 |
您最近一年使用:0次
2021高三·全国·专题练习
7 . 实验小组制备高铁酸钾(K2FeO4)并探究其性质。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)_______ 。
(2)为证明K2FeO4能氧化Cl-产生Cl2,设计以下方案,用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b.取少量b,滴加盐酸,产生黄绿色气体Cl2。用KOH溶液洗涤的目的是_______ 。
资料:K2FeO4为紫色固体,微溶于KOH溶液;具有强氧化性,在酸性或中性溶液中快速产生O2,在碱性溶液中较稳定。
(1)制备K2FeO4(夹持装置略)

(2)为证明K2FeO4能氧化Cl-产生Cl2,设计以下方案,用KOH溶液充分洗涤C中所得固体,再用KOH溶液将K2FeO4溶出,得到紫色溶液b.取少量b,滴加盐酸,产生黄绿色气体Cl2。用KOH溶液洗涤的目的是
您最近一年使用:0次
名校
解题方法
8 . 高铁酸钾(K2FeO4)是兼具杀菌消毒和吸附絮凝功能的高效水处理剂。
(1) K2FeO4在处理污水时,与水体中的___________ 物质反应生成 。
。
A.氧化性 B.还原性
(2) 再水解生成
再水解生成 胶体,起到吸附絮凝作用,这与胶体的
胶体,起到吸附絮凝作用,这与胶体的___________ 有关。
A.丁达尔现象 B.电泳 C.聚沉
(一)电解法制备K2FeO4:
装置如图所示,原理为 。
。
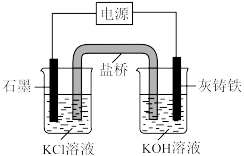
(3)灰铸铁材料作___________极。
(4)电解时,左侧烧杯中溶液的
___________ 。
A.升高 B.降低 C.不变
(5)写出电解时石墨电极反应式___________ 。
(二)水相法制备K2FeO4:
实验流程如下所示。
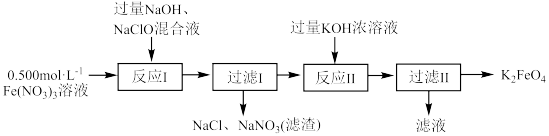
(6)实验室配制 溶液,不需要使用的玻璃仪器是___________。
溶液,不需要使用的玻璃仪器是___________。
(7)实验室制取 所需的两种原料为
所需的两种原料为___________ 、___________ 。
(8)写出反应I的化学方程式___________ 。
(9)简述反应Ⅱ能生成K2FeO4的原因___________ 。
(三) K2FeO4的纯度分析
水相法制备的K2FeO4产品纯度测定步骤如下:称取 产品配成
产品配成 溶液。取
溶液。取 置于锥形瓶,再加入足量
置于锥形瓶,再加入足量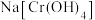 溶液,再加适量稀硫酸;最后用
溶液,再加适量稀硫酸;最后用 标准溶液滴定,终点时消耗标准溶液
标准溶液滴定,终点时消耗标准溶液 。主要反应如下:
。主要反应如下:



(10) 溶液通常用红色手柄的滴定管盛放,主要是由于其溶液显
溶液通常用红色手柄的滴定管盛放,主要是由于其溶液显___________ 。
A.酸性 B.碱性
(11)计算该K2FeO4产品纯度为___________ 。
(12)下列操作会使测定结果偏大的是___________。
(1) K2FeO4在处理污水时,与水体中的
 。
。A.氧化性 B.还原性
(2)
 再水解生成
再水解生成 胶体,起到吸附絮凝作用,这与胶体的
胶体,起到吸附絮凝作用,这与胶体的A.丁达尔现象 B.电泳 C.聚沉
(一)电解法制备K2FeO4:
装置如图所示,原理为
 。
。
(3)灰铸铁材料作___________极。
| A.正 | B.负 | C.阴 | D.阳 |
(4)电解时,左侧烧杯中溶液的

A.升高 B.降低 C.不变
(5)写出电解时石墨电极反应式
(二)水相法制备K2FeO4:
实验流程如下所示。

(6)实验室配制
 溶液,不需要使用的玻璃仪器是___________。
溶液,不需要使用的玻璃仪器是___________。| A.容量瓶 | B.玻璃棒 | C.胶头滴管 | D.量筒 |
(7)实验室制取
 所需的两种原料为
所需的两种原料为(8)写出反应I的化学方程式
(9)简述反应Ⅱ能生成K2FeO4的原因
(三) K2FeO4的纯度分析
水相法制备的K2FeO4产品纯度测定步骤如下:称取
 产品配成
产品配成 溶液。取
溶液。取 置于锥形瓶,再加入足量
置于锥形瓶,再加入足量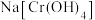 溶液,再加适量稀硫酸;最后用
溶液,再加适量稀硫酸;最后用 标准溶液滴定,终点时消耗标准溶液
标准溶液滴定,终点时消耗标准溶液 。主要反应如下:
。主要反应如下:


(10)
 溶液通常用红色手柄的滴定管盛放,主要是由于其溶液显
溶液通常用红色手柄的滴定管盛放,主要是由于其溶液显A.酸性 B.碱性
(11)计算该K2FeO4产品纯度为
(12)下列操作会使测定结果偏大的是___________。
| A.配制 K2FeO4溶液定容时,仰视容量瓶刻度线 |
| B.盛放K2FeO4溶液的锥形瓶未干燥 |
C.盛放 标准溶液的滴定管未润洗 标准溶液的滴定管未润洗 |
| D.终点读数时,俯视滴定管刻度线 |
您最近一年使用:0次
名校
9 . 钠及其化合物在生活和生产中有重要用途。
(1) 因外观和食盐相似,有咸味,容易使人误食中毒。已知
因外观和食盐相似,有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: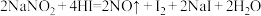 。请回答:
。请回答:
①上述反应中,氧化产物是___________ (填化学式),其中HI在反应中体现出的性质为___________ (填字母)。
A.酸性 B.氧化性 C.碱性 D.还原性
②某厂废液中含有3%~6%的 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是
的是___________ (填字母)。
A.NaClO B. C.
C. D.
D.
(2) 是实验室常用的试剂,也常作呼吸面具和潜水艇里的供氧剂。
是实验室常用的试剂,也常作呼吸面具和潜水艇里的供氧剂。
①写出 与
与 反应的化学方程式
反应的化学方程式___________ 。
②将二氧化碳和水蒸气组成的混合气体8.0g通过足量的 粉末,完全吸收后固体质量增重3.2g,则该混合气体中水蒸气的质量为
粉末,完全吸收后固体质量增重3.2g,则该混合气体中水蒸气的质量为___________ 。
③将一定量的 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,完全反应后,溶液中上述离子数目几乎不变的是
,完全反应后,溶液中上述离子数目几乎不变的是___________ (填离子符号)。
(3) 是实验室中常用的物质。侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。
是实验室中常用的物质。侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。
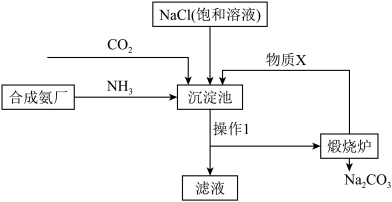
①上述流程中,物质X是___________ (填化学式)。
②写出沉淀池的化学反应方程式___________ 。
③下列关于侯德榜“联合制碱法”说法错误的是___________ (填字母)。
A.上述流程中滤液中可分离得到一种氮肥
B.上述流程应在饱和NaCl溶液中先通 ,再通
,再通
C.沉淀池中析出晶体利用了相同条件下物质溶解度的差异
D.该工艺的碳原子利用率理论上为100%
(1)
 因外观和食盐相似,有咸味,容易使人误食中毒。已知
因外观和食盐相似,有咸味,容易使人误食中毒。已知 能发生如下反应:
能发生如下反应: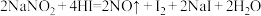 。请回答:
。请回答:①上述反应中,氧化产物是
A.酸性 B.氧化性 C.碱性 D.还原性
②某厂废液中含有3%~6%的
 ,直接排放会造成污染,下列试剂能使
,直接排放会造成污染,下列试剂能使 转化为不引起二次污染的
转化为不引起二次污染的 的是
的是A.NaClO B.
 C.
C. D.
D.
(2)
 是实验室常用的试剂,也常作呼吸面具和潜水艇里的供氧剂。
是实验室常用的试剂,也常作呼吸面具和潜水艇里的供氧剂。①写出
 与
与 反应的化学方程式
反应的化学方程式②将二氧化碳和水蒸气组成的混合气体8.0g通过足量的
 粉末,完全吸收后固体质量增重3.2g,则该混合气体中水蒸气的质量为
粉末,完全吸收后固体质量增重3.2g,则该混合气体中水蒸气的质量为③将一定量的
 固体投入到含有下列离子的溶液中:
固体投入到含有下列离子的溶液中: 、
、 、
、 、
、 ,完全反应后,溶液中上述离子数目几乎不变的是
,完全反应后,溶液中上述离子数目几乎不变的是(3)
 是实验室中常用的物质。侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。
是实验室中常用的物质。侯德榜“联合制碱法”将制碱技术发展到一个新的水平。该工艺以氯化钠为原料制取纯碱,主要流程如图所示(部分物质已略去)。
①上述流程中,物质X是
②写出沉淀池的化学反应方程式
③下列关于侯德榜“联合制碱法”说法错误的是
A.上述流程中滤液中可分离得到一种氮肥
B.上述流程应在饱和NaCl溶液中先通
 ,再通
,再通
C.沉淀池中析出晶体利用了相同条件下物质溶解度的差异
D.该工艺的碳原子利用率理论上为100%
您最近一年使用:0次
10 . 氯的化合物在生活中有着广泛的用途。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生 和少量的
和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为
转化为 除去。
除去。
①关于二氧化氯的说法不正确 的是______ 。
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去 的离子方程式为
的离子方程式为______ 。
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为: (未配平)。
(未配平)。
①ClO2的氧化性______ H2O2的氧化性(填“大于”或“小于”)。
②当消耗标准状况下2.24 L ClO2时,生成O2的质量为___________ 。
(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收SO2的过程如下图。

①该过程的总反应的离子方程式是___________ 。
②整个吸收SO2过程中作氧化剂的微粒有___________ 。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生
 和少量的
和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为
转化为 除去。
除去。①关于二氧化氯的说法
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去
 的离子方程式为
的离子方程式为(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:
 (未配平)。
(未配平)。①ClO2的氧化性
②当消耗标准状况下2.24 L ClO2时,生成O2的质量为
(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收SO2的过程如下图。

①该过程的总反应的离子方程式是
②整个吸收SO2过程中作氧化剂的微粒有
您最近一年使用:0次



