名校
1 . 羟基氧化铁 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
 .产品制备及产率计算
.产品制备及产率计算
①制备晶种:称取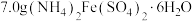 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至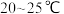 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加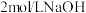 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
②氧化过程:称取足量 ,加入上述溶液,于
,加入上述溶液,于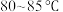 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。
③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用 试纸检验溶液
试纸检验溶液 的操作为
的操作为___________ 。
(2)①中观察到沉淀的颜色变为___________ 色时,证明已经成功制备晶种。
(3)②氧化过程中,发生反应的离子方程式为___________ 。
(4)抽滤装置如图,仪器c的作用为___________ ,和普通过滤相比,抽滤的优点有过滤速度更快和___________ 。 .产品纯度测定
.产品纯度测定
铁黄纯度可以通过产品的耗酸量确定。 ,
,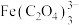 不与稀
不与稀 溶液反应。
溶液反应。
(5)铁黄溶于 标准液的离子方程式为
标准液的离子方程式为___________ 。
(6) 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为___________ (列出计算式,不需化简)。
(7)若 溶液过量,会使测定结果
溶液过量,会使测定结果___________ (填“偏大”、“偏小”或“无影响”)。(已知草酸的电离平衡常数: )
)
 为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下:
为淡黄色固体,简称铁黄,可作颜料。制备铁黄的关键是先制备铁黄晶种,否则只能得到稀薄的、颜色暗淡的色浆,不具备颜料性能。实验室以硫酸亚铁铵为主要原料制备铁黄的实验步骤如下: .产品制备及产率计算
.产品制备及产率计算①制备晶种:称取
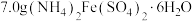 放入三颈烧瓶中,加入
放入三颈烧瓶中,加入 去离子水,恒温水浴加热至
去离子水,恒温水浴加热至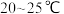 ,搅拌溶解,慢慢滴加
,搅拌溶解,慢慢滴加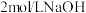 溶液,用
溶液,用 试纸检验至溶液
试纸检验至溶液 为
为 ,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。
,停止加碱,观察到出现沉淀并伴随沉淀颜色变化。②氧化过程:称取足量
 ,加入上述溶液,于
,加入上述溶液,于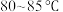 恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加
恒温水浴中进行氧化。氧化过程中,边搅拌边不断滴加 溶液至
溶液至 为
为 时,停止加热。
时,停止加热。③洗涤、干燥:用去离子水洗涤生成的固体,抽滤,弃去母液,得到淡黄色固体。将其转入蒸发皿中,在水浴加热条件下烘干,称量,计算产率。
回答下列问题:
(1)用
 试纸检验溶液
试纸检验溶液 的操作为
的操作为(2)①中观察到沉淀的颜色变为
(3)②氧化过程中,发生反应的离子方程式为
(4)抽滤装置如图,仪器c的作用为
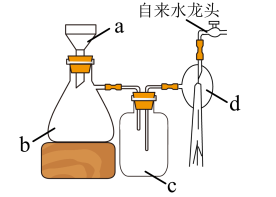
 .产品纯度测定
.产品纯度测定铁黄纯度可以通过产品的耗酸量确定。

 ,
,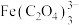 不与稀
不与稀 溶液反应。
溶液反应。(5)铁黄溶于
 标准液的离子方程式为
标准液的离子方程式为(6)
 标准液和
标准液和 标准液浓度均为
标准液浓度均为 ,消耗两溶液的体积依次为
,消耗两溶液的体积依次为 ,计算铁黄的纯度为
,计算铁黄的纯度为(7)若
 溶液过量,会使测定结果
溶液过量,会使测定结果 )
)
您最近一年使用:0次
2024-05-26更新
|
391次组卷
|
3卷引用:2024届黑龙江省哈尔滨师范大学附属中学高三下学期三模化学试题
名校
2 . 为探究氯气的性质,某实验小组设计了如图所示的微型实验装置。①~③是浸有相应溶液的滤纸条,该实验制备氯气的原理为: (已知:
(已知: 和KSCN溶液反应会生成红色物质)。下列说法正确的是
和KSCN溶液反应会生成红色物质)。下列说法正确的是

 (已知:
(已知: 和KSCN溶液反应会生成红色物质)。下列说法正确的是
和KSCN溶液反应会生成红色物质)。下列说法正确的是
| A.①处红色褪去,证明氯气具有漂白性 |
B.②处变蓝,证明还原性: |
C.③处变红,证明氧化性: |
D.在浓盐酸和 的反应中浓盐酸只体现了还原性 的反应中浓盐酸只体现了还原性 |
您最近一年使用:0次
名校
解题方法
3 . 下列实验操作、现象和结论都正确的是
| 选项 | 目的 | 实验操作 | 现象和结论 |
| A | 探究胶体和溶液性质的不同 | 在暗处用激光笔照射盛有硫酸铜溶液和氢氧化铁胶体的小烧杯 | 当光束通过胶体时,在垂直于光线的方向可以看到一条光亮的通路,溶液无明显现象。丁达尔效应可以区分溶液和胶体 |
| B | 鉴别某白色固体含有钠元素 | 取一根铜丝,在酒精灯外焰上灼烧,蘸取待检测样品,置于火焰上灼烧,观察火焰颜色 | 火焰颜色呈黄色,证明原样品中含有钠元素 |
| C | 比较 和 和 的氧化性 的氧化性 | 向酸性 溶液中滴入 溶液中滴入 溶液 溶液 | 紫红色溶液变浅,氧化性强弱: |
| D | 探究 是否有漂白性 是否有漂白性 | 将干燥的有色布条和湿润的有色布条分别放入两瓶盛有干燥 的试剂瓶中 的试剂瓶中 | 湿润的有色布条明显褪色,证明干燥的氯气具有漂白性 |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2024-04-13更新
|
232次组卷
|
2卷引用:2024届河北省雄安新区雄安部分高中高三下学期一模化学试题
解题方法
4 . Fe/Fe3O4复合物是一种高密度磁记录材料,磁记录材料有记录和存储信息的功能。制备该材料的一种流程如下:
Ⅰ、相关反应原理:
①Fe2++2OH-=Fe(OH)2
②3Fe(OH)2=Fe+2Fe(OH)3
③Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O
Ⅱ、25℃时Fe(OH)2的Ksp=8.0×10-16
1.用FeCl2溶液和KOH溶液制备Fe/Fe3O4反应的离子方程式为_____ 。该“反应”中通入氩气的原因_____ 。
2.取少量反应后溶液于试管中,选择试剂_____,可证明FeCl2溶液已反应完全。
3.已知参加反应的FeCl2溶液浓度为lmol·L−1。由题给信息分析,25℃时,当pH<2时,Fe/Fe3O4产率极低的原因_____ 。
下图1为回流时间与Fe/Fe3O4产率的关系图,图2为回流1h所得产品的X射线衍射图。_____ 。
通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。
6.从绿色化学角度评价该循环过程(说一点)。_____

Ⅰ、相关反应原理:
①Fe2++2OH-=Fe(OH)2
②3Fe(OH)2=Fe+2Fe(OH)3
③Fe(OH)2+2Fe(OH)3=Fe3O4+4H2O
Ⅱ、25℃时Fe(OH)2的Ksp=8.0×10-16
1.用FeCl2溶液和KOH溶液制备Fe/Fe3O4反应的离子方程式为
2.取少量反应后溶液于试管中,选择试剂_____,可证明FeCl2溶液已反应完全。
| A.SO2 | B.铁粉 |
| C.KSCN溶液 | D.KSCN溶液新制氯水 |
下图1为回流时间与Fe/Fe3O4产率的关系图,图2为回流1h所得产品的X射线衍射图。

通过Fe3O4和FeO的热化学循环可以利用太阳能,其转化关系如图所示。
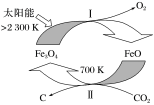
| A.反应物 | B.中间产物 | C.催化剂 | D.产物 |
您最近一年使用:0次
解题方法
5 . 处理废旧铅酸电池中的含铅浆液(主要含 、
、 )的一种流程示意图如下。
)的一种流程示意图如下。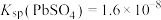 ,
,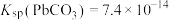 ,
,
ii. 和
和 均为可溶于水的强电解质。
均为可溶于水的强电解质。
(1)向含铅浆液中加入过量的 实现转化脱硫。
实现转化脱硫。
①结合离子方程式说明 溶液显碱性的原因:
溶液显碱性的原因:________ 。
②转化脱硫反应的离子方程式是________ 。
③检验 ,证明固体a已洗涤干净,操作和现象是
,证明固体a已洗涤干净,操作和现象是________ 。
(2)受热时, 分解产生
分解产生 ,最终生成PbO。
,最终生成PbO。
将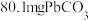 样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中
样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中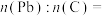
________ 。[ 、
、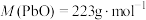 ]
]
(3)“还原”时加入 溶液,反应的化学方程式是
溶液,反应的化学方程式是________ 。
(4)“浸出”反应的离子方程式是________ 。
(5)以惰性电极电解 溶液制得Pb,溶液b中可循环利用的物质是
溶液制得Pb,溶液b中可循环利用的物质是________ 。
 、
、 )的一种流程示意图如下。
)的一种流程示意图如下。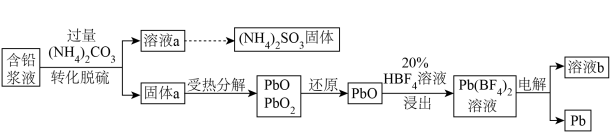
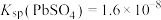 ,
,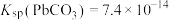 ,
,ii.
 和
和 均为可溶于水的强电解质。
均为可溶于水的强电解质。(1)向含铅浆液中加入过量的
 实现转化脱硫。
实现转化脱硫。①结合离子方程式说明
 溶液显碱性的原因:
溶液显碱性的原因:②转化脱硫反应的离子方程式是
③检验
 ,证明固体a已洗涤干净,操作和现象是
,证明固体a已洗涤干净,操作和现象是(2)受热时,
 分解产生
分解产生 ,最终生成PbO。
,最终生成PbO。将
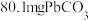 样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中
样品置于氩气中加热,316℃时,剩余固体的质量为713mg,此时固体中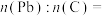
 、
、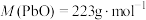 ]
](3)“还原”时加入
 溶液,反应的化学方程式是
溶液,反应的化学方程式是(4)“浸出”反应的离子方程式是
(5)以惰性电极电解
 溶液制得Pb,溶液b中可循环利用的物质是
溶液制得Pb,溶液b中可循环利用的物质是
您最近一年使用:0次
名校
解题方法
6 . 某实验小组在研究物质的分解实验,回答下列问题。
Ⅰ、查阅资料显示,大多数硝酸盐受热能分解。已知Cu(NO3)2受热分解产生黑色固体和两种气体,其中一种气体呈红棕色(NO2),另一种为单质。Cu2O为红色固体。
(1)写出Cu(NO3)2受热分解的化学反应方程式_____ 。
(2)有同学将带火星木条深入集气瓶中,木条复燃,从而说明NO2具有助燃性,请说明你的观点并阐述理由:_____ (填“有”、“无”或“不确定”)助燃性,理由是_____ 。
Ⅱ、将Cu(NO3)2受热分解产生的黑色固体用氢气还原,将看到黑色固体变为红色。
(3)探究红色固体成分时得到以下猜想:①红色固体为Cu;②红色固体为_____ ;③红色固体为Cu2O和Cu的混合物。
(4)验证猜想时,某同学将红色固体溶于稀硫酸,发现固体部分溶解,溶液变成蓝色,经过计算从而证明红色固体中含有Cu2O。请写出Cu2O在稀硫酸中发生歧化反应反应的离子方程式:_____ 。
Ⅰ、查阅资料显示,大多数硝酸盐受热能分解。已知Cu(NO3)2受热分解产生黑色固体和两种气体,其中一种气体呈红棕色(NO2),另一种为单质。Cu2O为红色固体。
(1)写出Cu(NO3)2受热分解的化学反应方程式
(2)有同学将带火星木条深入集气瓶中,木条复燃,从而说明NO2具有助燃性,请说明你的观点并阐述理由:
Ⅱ、将Cu(NO3)2受热分解产生的黑色固体用氢气还原,将看到黑色固体变为红色。
(3)探究红色固体成分时得到以下猜想:①红色固体为Cu;②红色固体为
(4)验证猜想时,某同学将红色固体溶于稀硫酸,发现固体部分溶解,溶液变成蓝色,经过计算从而证明红色固体中含有Cu2O。请写出Cu2O在稀硫酸中发生歧化反应反应的离子方程式:
您最近一年使用:0次
名校
解题方法
7 . 含SO2和H2S废气的治理可以变废为宝,使硫资源得以利用。
(1)一种处理SO2废气的工艺流程如图所示。_______ ;SO2吸收塔中发生反应化学方程式为_______ 。
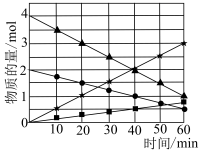
(2)CO与SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图所示,写出该反应的化学方程式:_______ 。_______ 。
②亚硫酸钠粗品中含有少量Na2SO4,设计实验证明亚硫酸钠粗品中含有少量Na2SO4的方案:_______ 。(必须使用 的试剂有:蒸馏水、稀盐酸、BaCl2溶液)
(4)我国科学家研究在活性炭催化条件下将煤气中的H2S协同脱除,部分反应过程如图所示(·H2S表示H2S气体被吸附在催化剂表面)。_______ 。
②从物质转化与资源综合利用角度分析,该过程初步达到的目的为_______ 。
(1)一种处理SO2废气的工艺流程如图所示。
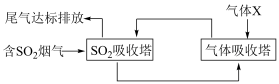
(2)CO与SO2在铝矾土作催化剂、773K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图所示,写出该反应的化学方程式:
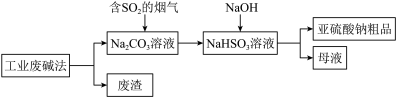
②亚硫酸钠粗品中含有少量Na2SO4,设计实验证明亚硫酸钠粗品中含有少量Na2SO4的方案:
(4)我国科学家研究在活性炭催化条件下将煤气中的H2S协同脱除,部分反应过程如图所示(·H2S表示H2S气体被吸附在催化剂表面)。
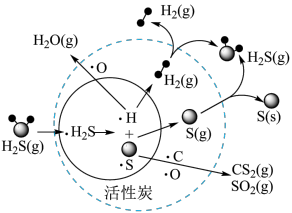
②从物质转化与资源综合利用角度分析,该过程初步达到的目的为
您最近一年使用:0次
2024-02-13更新
|
425次组卷
|
2卷引用:江苏省盐城市盐城一中、射阳中学、滨海中学2023-2024学年高一上学期期末联考化学试卷
名校
解题方法
8 .  是一种大气污染物,但它在化工和食品工业上却有广泛应用.某兴趣小组同学对
是一种大气污染物,但它在化工和食品工业上却有广泛应用.某兴趣小组同学对 的实验室制备(加热装置省略)和性质实验进行研究.
的实验室制备(加热装置省略)和性质实验进行研究.

(1)实验中铜与浓硫酸反应的化学方程式是___________ .在该反应中浓硫酸体现了___________ 性。
(2)从物质类别分析 是酸性氧化物,可以使装置
是酸性氧化物,可以使装置 中的澄清石灰水变浑浊,写出
中的澄清石灰水变浑浊,写出 使澄清石灰水变浑浊的离子方程式
使澄清石灰水变浑浊的离子方程式___________ 。
(3)从化合价角度分析 既有氧化性又有还原性:
既有氧化性又有还原性:
①若C中盛有 溶液,当溶液由黄色变成浅绿色则证明
溶液,当溶液由黄色变成浅绿色则证明 具有还原性,写出该过程的离子方程式
具有还原性,写出该过程的离子方程式___________ 。
②若 中盛有
中盛有 溶液,当溶液有黄色沉淀产生,则证明
溶液,当溶液有黄色沉淀产生,则证明 具有氧化性,写出该过程的化学方程式
具有氧化性,写出该过程的化学方程式___________
(4) 还具有漂白性,则
还具有漂白性,则 中盛放的是
中盛放的是___________ 溶液。
(5)装置 的作用为
的作用为___________ 。
 是一种大气污染物,但它在化工和食品工业上却有广泛应用.某兴趣小组同学对
是一种大气污染物,但它在化工和食品工业上却有广泛应用.某兴趣小组同学对 的实验室制备(加热装置省略)和性质实验进行研究.
的实验室制备(加热装置省略)和性质实验进行研究.
(1)实验中铜与浓硫酸反应的化学方程式是
(2)从物质类别分析
 是酸性氧化物,可以使装置
是酸性氧化物,可以使装置 中的澄清石灰水变浑浊,写出
中的澄清石灰水变浑浊,写出 使澄清石灰水变浑浊的离子方程式
使澄清石灰水变浑浊的离子方程式(3)从化合价角度分析
 既有氧化性又有还原性:
既有氧化性又有还原性:①若C中盛有
 溶液,当溶液由黄色变成浅绿色则证明
溶液,当溶液由黄色变成浅绿色则证明 具有还原性,写出该过程的离子方程式
具有还原性,写出该过程的离子方程式②若
 中盛有
中盛有 溶液,当溶液有黄色沉淀产生,则证明
溶液,当溶液有黄色沉淀产生,则证明 具有氧化性,写出该过程的化学方程式
具有氧化性,写出该过程的化学方程式(4)
 还具有漂白性,则
还具有漂白性,则 中盛放的是
中盛放的是(5)装置
 的作用为
的作用为
您最近一年使用:0次
9 . 连四硫酸钠( )能延长血液凝结时间,是生物酶、生物键的修复剂。某研究小组设计实验探究连四硫酸钠的性质,装置如图所示,回答下列问题:
)能延长血液凝结时间,是生物酶、生物键的修复剂。某研究小组设计实验探究连四硫酸钠的性质,装置如图所示,回答下列问题:
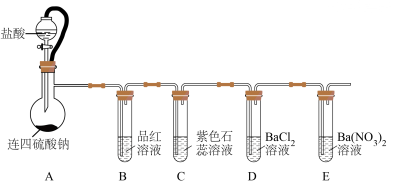
实验中,发现A中产生气体和浅黄色固体。B中溶液褪色,C中溶液变红色,D中不产生沉淀,E中产生白色沉淀。
(1)工业上用双氧水和 反应制备连四硫酸钠。写出该反应的化学方程式
反应制备连四硫酸钠。写出该反应的化学方程式___________ 。
(2)B中现象说明A中产生了___________ (填化学式),用文字解释C中现象___________ 。
(3)分析D和E中现象说明E中产生的白色沉淀是___________ (填化学式)。从环保角度分析,本实验需要改进之处是___________ 。
(4)实验完毕后,取E中上层清液于试管中,加入铜片,片刻后,溶液变为蓝绿色,并产生气泡,由此推知,E中主要发生的反应是___________ (填序号)。
①
②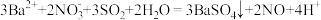
(5)写出A中发生反应的离子方程式___________ 。
(6)连四硫酸钠保存不善会变质,设计简单实验证明连四硫酸钠已变质:___________ 。
 )能延长血液凝结时间,是生物酶、生物键的修复剂。某研究小组设计实验探究连四硫酸钠的性质,装置如图所示,回答下列问题:
)能延长血液凝结时间,是生物酶、生物键的修复剂。某研究小组设计实验探究连四硫酸钠的性质,装置如图所示,回答下列问题:
实验中,发现A中产生气体和浅黄色固体。B中溶液褪色,C中溶液变红色,D中不产生沉淀,E中产生白色沉淀。
(1)工业上用双氧水和
 反应制备连四硫酸钠。写出该反应的化学方程式
反应制备连四硫酸钠。写出该反应的化学方程式(2)B中现象说明A中产生了
(3)分析D和E中现象说明E中产生的白色沉淀是
(4)实验完毕后,取E中上层清液于试管中,加入铜片,片刻后,溶液变为蓝绿色,并产生气泡,由此推知,E中主要发生的反应是
①

②
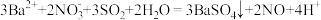
(5)写出A中发生反应的离子方程式
(6)连四硫酸钠保存不善会变质,设计简单实验证明连四硫酸钠已变质:
您最近一年使用:0次
解题方法
10 . 某实验小组为探究 与
与 的反应,设计如下实验:将
的反应,设计如下实验:将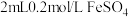 溶液和
溶液和
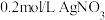 溶液混合,观察到溶液变黑,静置后试管底部有灰色沉淀,上层清液呈黄色。
溶液混合,观察到溶液变黑,静置后试管底部有灰色沉淀,上层清液呈黄色。
回答下列问题:
(1)甲同学根据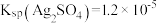 ,推测试管底部的灰色沉淀中有
,推测试管底部的灰色沉淀中有 ,写出生成
,写出生成 的离子方程式
的离子方程式___________ 。
(2)乙同学依据“上层清液呈黄色”,推测上层清液中含有 。
。
①将 氧化成
氧化成 的物质可能是:
的物质可能是: 、
、 或
或__________ (填化学式)。
②实验证明, 氧化
氧化 是主因,通过计算作出分析
是主因,通过计算作出分析_________ ,写出该反应的离子方程式____________ 。
(已知:以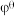 表示标准态(
表示标准态( )时的电极电势,当
)时的电极电势,当 ,反应可以自发进行;
,反应可以自发进行;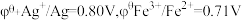 )
)
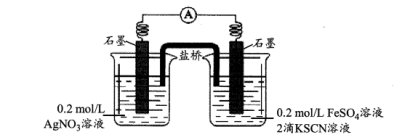
③乙同学又通过设计如图所示的原电池装置进行探究,当观察到__________ 现象时,证明 氧化了
氧化了 。
。
(3)丙同学为了定量研究试管底部灰色固体( 和
和 )的组成,设计了如下操作流程。
)的组成,设计了如下操作流程。
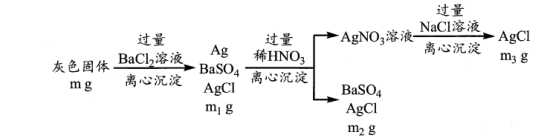
①离心沉淀相比于传统沉淀的优点是____________________ 。
②计算 的质量分数
的质量分数____________________ 。(用流程中的字母表示,列出一个计算式即可)
 与
与 的反应,设计如下实验:将
的反应,设计如下实验:将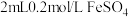 溶液和
溶液和
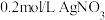 溶液混合,观察到溶液变黑,静置后试管底部有灰色沉淀,上层清液呈黄色。
溶液混合,观察到溶液变黑,静置后试管底部有灰色沉淀,上层清液呈黄色。回答下列问题:
(1)甲同学根据
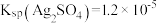 ,推测试管底部的灰色沉淀中有
,推测试管底部的灰色沉淀中有 ,写出生成
,写出生成 的离子方程式
的离子方程式(2)乙同学依据“上层清液呈黄色”,推测上层清液中含有
 。
。①将
 氧化成
氧化成 的物质可能是:
的物质可能是: 、
、 或
或②实验证明,
 氧化
氧化 是主因,通过计算作出分析
是主因,通过计算作出分析(已知:以
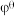 表示标准态(
表示标准态( )时的电极电势,当
)时的电极电势,当 ,反应可以自发进行;
,反应可以自发进行;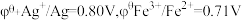 )
)③乙同学又通过设计如图所示的原电池装置进行探究,当观察到
 氧化了
氧化了 。
。
(3)丙同学为了定量研究试管底部灰色固体(
 和
和 )的组成,设计了如下操作流程。
)的组成,设计了如下操作流程。
①离心沉淀相比于传统沉淀的优点是
②计算
 的质量分数
的质量分数
您最近一年使用:0次



