解题方法
1 . 化学技术在铁材料研发改进方面发挥着重要作用。
I.纳米 是一种多功能磁性材料,在高科技领域有特殊的用途,工业上可通过如下过程制得:
是一种多功能磁性材料,在高科技领域有特殊的用途,工业上可通过如下过程制得:
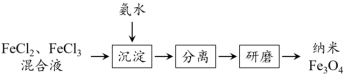
(1)在实验室中,同学们做了如下实验:
①将红热铁丝伸到盛有氯气的集气瓶中制 ,反应的化学方程式为
,反应的化学方程式为___________ 。
②将 通入
通入 溶液制
溶液制 ,观察到的实验现象为
,观察到的实验现象为___________ 。
③将 溶液滴入
溶液滴入 溶液中,观察到产生白色絮状沉淀迅速变为灰绿色,最后转成红褐色。白色和红褐色沉淀的成分分别是
溶液中,观察到产生白色絮状沉淀迅速变为灰绿色,最后转成红褐色。白色和红褐色沉淀的成分分别是___________ 、___________ (填化学式)。
(2)流程中,产生“沉淀”的离子方程式为:___________
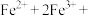 ___________
___________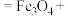 ___________
___________ ___________
___________
(3)同学们认为 和
和 的混合溶液中
的混合溶液中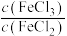 应略小于2,原因是
应略小于2,原因是___________ 。
Ⅱ.某同学查阅资料得知还可以用纳米铁粉与水蒸气反应制得纳米 。
。
(4)纳米铁粉___________ (填“属于”或“不属于”)胶体。
(5)该同学设计了以下方案证明产物为 。
。
①完善表格:ii___________ ;iii___________ 。
②有同学认为该方案不能证明产物为 ,其理由是
,其理由是___________ 。
I.纳米
 是一种多功能磁性材料,在高科技领域有特殊的用途,工业上可通过如下过程制得:
是一种多功能磁性材料,在高科技领域有特殊的用途,工业上可通过如下过程制得:
(1)在实验室中,同学们做了如下实验:
①将红热铁丝伸到盛有氯气的集气瓶中制
 ,反应的化学方程式为
,反应的化学方程式为②将
 通入
通入 溶液制
溶液制 ,观察到的实验现象为
,观察到的实验现象为③将
 溶液滴入
溶液滴入 溶液中,观察到产生白色絮状沉淀迅速变为灰绿色,最后转成红褐色。白色和红褐色沉淀的成分分别是
溶液中,观察到产生白色絮状沉淀迅速变为灰绿色,最后转成红褐色。白色和红褐色沉淀的成分分别是(2)流程中,产生“沉淀”的离子方程式为:
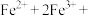 ___________
___________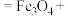 ___________
___________ ___________
___________
(3)同学们认为
 和
和 的混合溶液中
的混合溶液中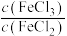 应略小于2,原因是
应略小于2,原因是Ⅱ.某同学查阅资料得知还可以用纳米铁粉与水蒸气反应制得纳米
 。
。(4)纳米铁粉
(5)该同学设计了以下方案证明产物为
 。
。| 编号 | 实验方案 | 实验现象 | 实验结论 | |
| ⅰ | 取反应后的固体,加稀硫酸充分振荡溶解 | / | / | |
| ⅱ | 向 溶液中滴加 溶液中滴加 所得溶液 所得溶液 | ___________ | 溶液中含 | 产物为 |
| ⅲ | 取i所得溶液,滴加___________溶液 | 溶液变血红色 | 溶液中含 | |
②有同学认为该方案不能证明产物为
 ,其理由是
,其理由是
您最近一年使用:0次
名校
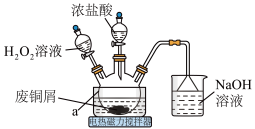
2 . CuCl2是常见的化学试剂,某小组利用废铜屑“湿法”制备CuCl2·2H2O并开展相关探究。
回答下列问题:
(1)仪器a的名称为___________ 。
(2)上述方法制备CuCl2的离子方程式为___________ 。
(3)为得到纯净的CuCl2·2H2O晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入 气体,加热蒸发浓缩,
气体,加热蒸发浓缩,___________ ,过滤,洗涤,低温干燥。持续通入 气体的目的是
气体的目的是___________ 。
(4)实验中,H2O2的实际用量要大于理论用量,可能因素为:原因1:___________ ;原因2:生成的CuCl2催化了H2O2的分解。
(5)该小组对“原因2”进行拓展探究。为验证CuCl2对H2O2分解的催化作用,该小组向5支盛有10mL5%H2O2的试管中滴加不同溶液,实验记录如下表(忽略溶液体积的微小变化;已知一定条件下,还原产物的浓度越小,氧化剂的氧化性越强):
①实验Ⅳ过程中观察到有白色沉淀(经检验为CuCl)生成,反应的机理表示为
第一步:H2O2+2Cu2++2Cl-=O2↑+2CuCl+2H+;
第二步:___________ (写离子方程式)。
②已知化学反应速率第一步<第二步,则气泡产生速率实验Ⅳ比实验Ⅲ加快的原因:___________ 。
③分析上述实验,下列说法正确的是___________ (填字母)。
A.实验Ⅰ的目的是证明仅有NaCl对H2O2分解没有催化作用
B. 对H2O2分解有显著催化作用
对H2O2分解有显著催化作用
C.Cl-增强了Cu2+对H2O2分解的催化效果,且Cl-浓度越大催化效果越强
④写出一种H2O2的用途___________ 。
| 温度 | 15℃以下 | 15~25.7℃ | 26~42℃ | 42℃以上 |
| 结晶水合物 | CuCl2·4H2O | CuCl2·3H2O | CuCl2·2H2O | CuCl2·H2O |
(1)仪器a的名称为
(2)上述方法制备CuCl2的离子方程式为
(3)为得到纯净的CuCl2·2H2O晶体,反应完全后要进行的操作是:除去其他可能的金属离子后,过滤,向滤液中持续通入
 气体,加热蒸发浓缩,
气体,加热蒸发浓缩, 气体的目的是
气体的目的是(4)实验中,H2O2的实际用量要大于理论用量,可能因素为:原因1:
(5)该小组对“原因2”进行拓展探究。为验证CuCl2对H2O2分解的催化作用,该小组向5支盛有10mL5%H2O2的试管中滴加不同溶液,实验记录如下表(忽略溶液体积的微小变化;已知一定条件下,还原产物的浓度越小,氧化剂的氧化性越强):
| 实验 | Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ |
| 滴加试剂 | 2滴1mol/LNaCl | 2滴1mol/LNa2SO4 | 2滴1mol/LCuSO4 | 2滴1mol/LCuSO4和2滴1mol/LNaCl | 2滴1mol/LCuSO4和4滴1mol/LNaCl |
| 现象 | 无气泡产生 | 无气泡产生 | 均产生气泡,且气泡速率从Ⅲ到Ⅴ依次加快 | ||
第一步:H2O2+2Cu2++2Cl-=O2↑+2CuCl+2H+;
第二步:
②已知化学反应速率第一步<第二步,则气泡产生速率实验Ⅳ比实验Ⅲ加快的原因:
③分析上述实验,下列说法正确的是
A.实验Ⅰ的目的是证明仅有NaCl对H2O2分解没有催化作用
B.
 对H2O2分解有显著催化作用
对H2O2分解有显著催化作用C.Cl-增强了Cu2+对H2O2分解的催化效果,且Cl-浓度越大催化效果越强
④写出一种H2O2的用途
您最近一年使用:0次
名校
解题方法
3 . 下列方案设计、现象和结论都正确的是
| 目的 | 方案设计 | 现象和结论 | |
| A | 探究钠在氧气中燃烧所得固体成分 | 取少量加热后的固体粉末,加入少量蒸馏水 | 若有气泡产生,则证明燃烧后的固体粉末为Na2O2 |
| B | 比较KMnO4、Cl2 和Fe3+的氧化性 | 向酸性 KMnO4 溶液中滴入 FeCl2溶液,紫红色溶液变浅并伴有黄绿色气体产生 | 氧化性强弱:KMnO4>Cl2>Fe3+ |
| C | 制备 Fe(OH)3胶体 | 向沸水中滴加5~6滴FeCl3饱和溶液,继续煮沸至液体呈红褐色,停止加热。用红色激光笔照射液体 | 若产生一条光亮的“通路”,则得到Fe(OH)3 胶体 |
| D | 检验某溶液中是否存在K+ | 用玻璃棒蘸取待测液放在酒精灯外焰上灼烧,观察火焰的颜色 | 若看到火焰为黄色,则一定不存在 K+ |
| A.A | B.B | C.C | D.D |
您最近一年使用:0次
2023-11-27更新
|
212次组卷
|
2卷引用:山东省淄博实验中学2023-2024学年高一上学期期中考试化学试卷
解题方法
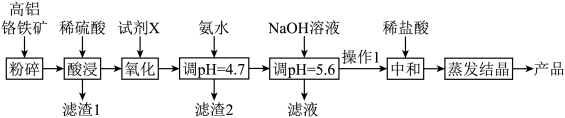
4 . CrCl3是重要的化工试剂,用高铝铬铁矿(主要含Cr2O3和Al2O3,还含Fe2O3、FeO、MgO、SiO2)制取CrCl3的流程如下:
已知:①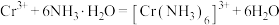
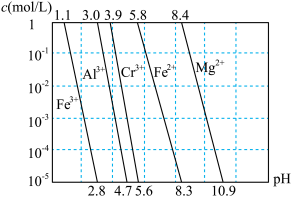
②相关金属离子在不同浓度下生成氢氧化物沉淀的 如图:
如图:
回答下列问题
(1)滤渣1主要成分是___________ ,滤渣2主要成分是___________ 。
(2)试剂X可选用___________ ,简述该流程设计添加X的好处与不好之处,好处是___________ ,不好之处是___________ 。
(3)“操作I”为过滤、洗涤,则证明沉淀洗涤干净的操作方法是___________ 。
(4)蒸发结晶操作应在___________ 条件下进行
(5)硼化铬(CrB)可用作耐磨、抗高温氧化涂层和核反应堆中的中子吸收涂层,硼化铬是在650℃时由金属镁与硼、氯化铬的混合物制得的,写出该反应的化学方程式:___________ 。

已知:①
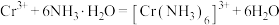
②相关金属离子在不同浓度下生成氢氧化物沉淀的
 如图:
如图:
回答下列问题
(1)滤渣1主要成分是
(2)试剂X可选用
(3)“操作I”为过滤、洗涤,则证明沉淀洗涤干净的操作方法是
(4)蒸发结晶操作应在
(5)硼化铬(CrB)可用作耐磨、抗高温氧化涂层和核反应堆中的中子吸收涂层,硼化铬是在650℃时由金属镁与硼、氯化铬的混合物制得的,写出该反应的化学方程式:
您最近一年使用:0次
名校
解题方法
5 . 回答下列问题。
(1)为探究 与
与 的还原性强弱,取适量制得的
的还原性强弱,取适量制得的 晶体,进行如下实验:
晶体,进行如下实验:
将适量 加入
加入 溶液中,若观察到
溶液中,若观察到___________ ,则可证明还原性 ;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:
;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:___________ 。
(2)为了证明 可以氧化
可以氧化 溶液中的
溶液中的 ,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:___________

(1)为探究
 与
与 的还原性强弱,取适量制得的
的还原性强弱,取适量制得的 晶体,进行如下实验:
晶体,进行如下实验:将适量
 加入
加入 溶液中,若观察到
溶液中,若观察到 ;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:
;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:(2)为了证明
 可以氧化
可以氧化 溶液中的
溶液中的 ,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
您最近一年使用:0次
名校
6 . 向多硫化钠固体中滴加稀硫酸,产生臭鸡蛋气味的气体,试管A中产生浅黄色固体,试管B中产生黑色沉淀,试管C中溶液变为浅绿色并产生浅黄色固体,试管D中溶液褪色,生成一种常见的最高价含氧酸和一种无氧强酸(省略尾气处理装置)。下列叙述错误的是


| A.试管B中黑色沉淀为CuS |
B.试管D中现象可证明还原性: |
| C.若反应一直持续,试管C中可能会有黑色沉淀生成 |
D.试管A中发生反应的化学方程式: |
您最近一年使用:0次
2023-10-09更新
|
161次组卷
|
2卷引用:江西省大余中学2023-2024学年高三上学期10月月考化学试题
7 . 碘元素是人体必需的微量元素之一。某学习小组在实验室进行海带提碘的探究,实验过程如下:
Ⅰ.海带中碘元素的确定
(1)同学们称取一定量干海带,将海带先剪碎,然后用水浸泡、洗净、晾干,放入_______ (填仪器名称)中灼烧至海带完全成灰烬,然后继续进行下列流程。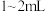 ,加入
,加入 稀硫酸、
稀硫酸、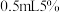 的
的 溶液,然后再加入
溶液,然后再加入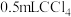 ,振荡后静置,若观察到
,振荡后静置,若观察到_______ (填实验现象),则证明海带中含有碘元素,上述过程中涉及的离子反应方程式为_______ 。
Ⅱ.海带提碘 中,可采取的操作是
中,可采取的操作是_______ 。
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需经过蒸馏,指出图实验装置中存在的错误之处_______ 。
Ⅲ.人体碘的重要来源之一是食用加碘食盐(含 )。为测定加碘食盐中的碘含量,学习小组设计如下实验:
)。为测定加碘食盐中的碘含量,学习小组设计如下实验: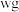 食盐样品,加适量蒸馏水使其完全溶解;
食盐样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得溶液,加入足量 溶液,使
溶液,使 与
与 反应完全生成
反应完全生成 ;
;
③向②中混合液逐滴加入浓度为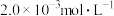 的
的 溶液,恰好反应完全时,消耗
溶液,恰好反应完全时,消耗 溶液
溶液 。(已知:
。(已知: )
)
(5)写出步骤②中发生反应的离子方程式_______ 。
(6)上述实验样品中碘元素的含量为_______ 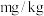 (用含w的代数式表示)。
(用含w的代数式表示)。
Ⅰ.海带中碘元素的确定
(1)同学们称取一定量干海带,将海带先剪碎,然后用水浸泡、洗净、晾干,放入

 ,加入
,加入 稀硫酸、
稀硫酸、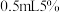 的
的 溶液,然后再加入
溶液,然后再加入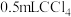 ,振荡后静置,若观察到
,振荡后静置,若观察到Ⅱ.海带提碘

 中,可采取的操作是
中,可采取的操作是(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需经过蒸馏,指出图实验装置中存在的错误之处
Ⅲ.人体碘的重要来源之一是食用加碘食盐(含
 )。为测定加碘食盐中的碘含量,学习小组设计如下实验:
)。为测定加碘食盐中的碘含量,学习小组设计如下实验:
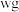 食盐样品,加适量蒸馏水使其完全溶解;
食盐样品,加适量蒸馏水使其完全溶解;②用稀硫酸酸化所得溶液,加入足量
 溶液,使
溶液,使 与
与 反应完全生成
反应完全生成 ;
;③向②中混合液逐滴加入浓度为
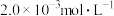 的
的 溶液,恰好反应完全时,消耗
溶液,恰好反应完全时,消耗 溶液
溶液 。(已知:
。(已知: )
)(5)写出步骤②中发生反应的离子方程式
(6)上述实验样品中碘元素的含量为
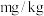 (用含w的代数式表示)。
(用含w的代数式表示)。
您最近一年使用:0次
2024-02-20更新
|
211次组卷
|
2卷引用:陕西省咸阳市实验中学2021-2022学年高一下学期阶段性检测(一)化学试题
名校
解题方法
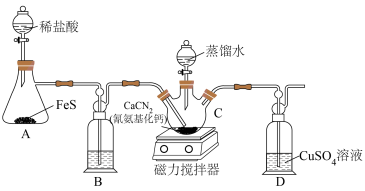
8 . 硫代尿素[(NH2)2CS]在工业上常用作还原剂,该物质易溶于水,温度较高时易发生异构化,实验室合成少量硫代尿素如图所示。回答下列问题:
(1)工业上制备硫代尿素时,常利用碳将 高温下还原为CaS,然后再利用CaS进一步合成硫代尿素,试写出碳与
高温下还原为CaS,然后再利用CaS进一步合成硫代尿素,试写出碳与 发生反应的化学方程式
发生反应的化学方程式___________ 。
(2)装置B中盛放的是___________ (填写试剂名称),其作用是___________ 。
(3)实验开始时,先让A中反应一段时间,以便排出装置中的空气。当D中___________ (填写实验现象),则证明装置中的空气被排出。
(4)将蒸馏水滴入___________ 中(填写仪器C的名称),同时开启磁力搅拌器, 与
与 的水溶液反应生成硫代尿素。
的水溶液反应生成硫代尿素。
(5)C中反应结束后,将混合物过滤,将滤液减压蒸发浓缩、___________ (填写操作名称)、过滤、洗涤、低温烘干得到产品。蒸发浓缩时需要在减压条件下进行,其目的是___________ 。
(6)取2.0g制得的产品溶于水配成100mL溶液,量取25.00mL溶液,用0.50mol/L的酸性高锰酸钾溶液滴定,滴定至终点消耗酸性高锰酸钾溶液28.00mL,则产品的纯度为___________ %。已知滴定反应: 。
。

(1)工业上制备硫代尿素时,常利用碳将
 高温下还原为CaS,然后再利用CaS进一步合成硫代尿素,试写出碳与
高温下还原为CaS,然后再利用CaS进一步合成硫代尿素,试写出碳与 发生反应的化学方程式
发生反应的化学方程式(2)装置B中盛放的是
(3)实验开始时,先让A中反应一段时间,以便排出装置中的空气。当D中
(4)将蒸馏水滴入
 与
与 的水溶液反应生成硫代尿素。
的水溶液反应生成硫代尿素。(5)C中反应结束后,将混合物过滤,将滤液减压蒸发浓缩、
(6)取2.0g制得的产品溶于水配成100mL溶液,量取25.00mL溶液,用0.50mol/L的酸性高锰酸钾溶液滴定,滴定至终点消耗酸性高锰酸钾溶液28.00mL,则产品的纯度为
 。
。
您最近一年使用:0次
2023-11-15更新
|
206次组卷
|
3卷引用:湖北省名校联考2023-2024学年高三上学期11月期中考试化学试题
名校
9 . 草酸( )为无色晶体,是一种二元弱酸,在实验研究和化学工业上有着广泛的应用。某化学实验小组设计实验探究
)为无色晶体,是一种二元弱酸,在实验研究和化学工业上有着广泛的应用。某化学实验小组设计实验探究 ,的制备及有关性质实验。
,的制备及有关性质实验。
回答下列问题:
I.制备
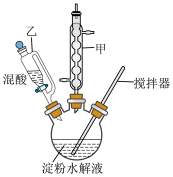
查阅资料,利用淀粉的水解液,在浓硫酸催化作用下用硝酸氧化可得 (装置如图,加热及夹持仪器已省略)。
(装置如图,加热及夹持仪器已省略)。
(1)实验时___________ (填“必需”或“无需”)打开仪器乙的玻璃塞,仪器甲冷凝水必须从下口通入,原因是_________________________________ 。
(2)反应温度控制不超过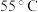 ,可采用的方法是
,可采用的方法是_________________________________ 。
(3)下列可以证明 是弱电解质的是___________(填字母)。
是弱电解质的是___________(填字母)。
Ⅱ.有关性质实验
小组同学拟用溶液与 溶液的反应(用作指示剂)来探究“外界条件对化学反应速率的影响”,实验记录如下:
溶液的反应(用作指示剂)来探究“外界条件对化学反应速率的影响”,实验记录如下:
(4) 溶液与
溶液与 反应,溶液立即呈紫红色,写出该反应的离子方程式:
反应,溶液立即呈紫红色,写出该反应的离子方程式:____________________ 。
(5)表格中a、b的数值分别为___________ 、___________ , 、
、 、
、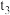 数值最大的是
数值最大的是___________ 。
(6)实验编号①④的目的是探究___________ 对化学反应速率的影响。
 )为无色晶体,是一种二元弱酸,在实验研究和化学工业上有着广泛的应用。某化学实验小组设计实验探究
)为无色晶体,是一种二元弱酸,在实验研究和化学工业上有着广泛的应用。某化学实验小组设计实验探究 ,的制备及有关性质实验。
,的制备及有关性质实验。
回答下列问题:
I.制备

查阅资料,利用淀粉的水解液,在浓硫酸催化作用下用硝酸氧化可得
 (装置如图,加热及夹持仪器已省略)。
(装置如图,加热及夹持仪器已省略)。(1)实验时
(2)反应温度控制不超过
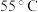 ,可采用的方法是
,可采用的方法是(3)下列可以证明
 是弱电解质的是___________(填字母)。
是弱电解质的是___________(填字母)。| A.向草酸溶液中滴加石蕊,溶液呈红色 |
B.室温下,测得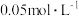 的 的 溶液的 溶液的 约为3 约为3 |
C.室温下,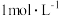 的 的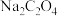 溶液的 溶液的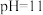 |
D.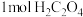 完全反应消耗 完全反应消耗 |
Ⅱ.有关性质实验
小组同学拟用溶液与
 溶液的反应(用作指示剂)来探究“外界条件对化学反应速率的影响”,实验记录如下:
溶液的反应(用作指示剂)来探究“外界条件对化学反应速率的影响”,实验记录如下:编号 |
| V( | V( | V(蒸馏水)/ | 变色时间/s |
① | 25 | 2.0 | 8.0 | 0 |
|
② | 25 | 2.0 | 5.0 | a |
|
③ | 25 | 2.0 | b | 2 |
|
④ | 30 | 2.0 | 8.0 | 0 |
|
(4)
 溶液与
溶液与 反应,溶液立即呈紫红色,写出该反应的离子方程式:
反应,溶液立即呈紫红色,写出该反应的离子方程式:(5)表格中a、b的数值分别为
 、
、 、
、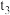 数值最大的是
数值最大的是(6)实验编号①④的目的是探究
您最近一年使用:0次
名校
10 . 瑞典化学家舍勒最先用软锰矿和浓盐酸制出了一种黄绿色气体,并且知道了这种气体的某些性质,但他却认为,该气体是一种化合物。直到1810年,英国化学家戴维才确认这种气体是一种单质——氯气。
(1)下列关于氯气的叙述错误的是___________。
(2)下列氯化物中,既能由金属和氯气直接制取,又能由金属和盐酸直接制取的是___________。
(3)氯气可以用来给自来水消毒。某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是___________。
(4)今有 、
、 混合气560mL(标准状况),其中一种气体体积为224mL。光照使两种气体发生反应后恢复到标况,气体体积为
混合气560mL(标准状况),其中一种气体体积为224mL。光照使两种气体发生反应后恢复到标况,气体体积为___________ mL。为了确认剩余的气体是 还是
还是 ,使气体通过水洗气,并使剩余气体干燥后恢复到标况,可能的情况有以下两种:
,使气体通过水洗气,并使剩余气体干燥后恢复到标况,可能的情况有以下两种:
①测量剩佘气体的体积,如果剩余112mL,证明有 剩余;理由是
剩余;理由是___________ 。测量过程进行到末读数环节,忘记调节左右液面相平了,液面左高右低(具体如图所示),测得的气体体积___________ (填“偏大”、“偏小”或“不变”)。
②如果上述水洗液有漂白性,证明有 剩余;理由是
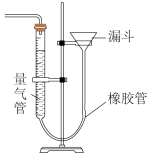
剩余;理由是___________ 。干燥的 没有漂白性,具体验证如下:剩余气体连续通过A、B、C、D装置。B瓶中的现象是
没有漂白性,具体验证如下:剩余气体连续通过A、B、C、D装置。B瓶中的现象是___________ 。不过这一装置设计有缺陷,体现在___________ 。
(5)①一定量的氢气在氯气中燃烧,火焰为___________ 色。
②所得混合物用100mL 的NaOH溶液(密度为
的NaOH溶液(密度为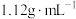 )恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。原NaOH溶液中溶质的物质的量是
)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。原NaOH溶液中溶质的物质的量是___________ mol;
③把NaCl和NaClO统一为通式 (
(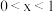 )。根据元素守恒,可知所得溶液中
)。根据元素守恒,可知所得溶液中 的物质的量为
的物质的量为___________ mol。
(1)下列关于氯气的叙述错误的是___________。
| A.氯气能溶于水 | B.氯气是黄绿色气体 |
| C.液氯是氯气的水溶液 | D.单质氯有气、液、固三种状态 |
(2)下列氯化物中,既能由金属和氯气直接制取,又能由金属和盐酸直接制取的是___________。
A. | B.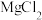 | C. | D. |
(3)氯气可以用来给自来水消毒。某学生用自来水配制下列物质的溶液,不会产生明显药品变质的是___________。
| A.石蕊 | B. | C.NaOH | D.NaCl |
(4)今有
 、
、 混合气560mL(标准状况),其中一种气体体积为224mL。光照使两种气体发生反应后恢复到标况,气体体积为
混合气560mL(标准状况),其中一种气体体积为224mL。光照使两种气体发生反应后恢复到标况,气体体积为 还是
还是 ,使气体通过水洗气,并使剩余气体干燥后恢复到标况,可能的情况有以下两种:
,使气体通过水洗气,并使剩余气体干燥后恢复到标况,可能的情况有以下两种:①测量剩佘气体的体积,如果剩余112mL,证明有
 剩余;理由是
剩余;理由是
②如果上述水洗液有漂白性,证明有
 剩余;理由是
剩余;理由是 没有漂白性,具体验证如下:剩余气体连续通过A、B、C、D装置。B瓶中的现象是
没有漂白性,具体验证如下:剩余气体连续通过A、B、C、D装置。B瓶中的现象是
(5)①一定量的氢气在氯气中燃烧,火焰为
②所得混合物用100mL
 的NaOH溶液(密度为
的NaOH溶液(密度为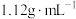 )恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。原NaOH溶液中溶质的物质的量是
)恰好完全吸收,测得溶液中含有NaClO的物质的量为0.0500mol。原NaOH溶液中溶质的物质的量是③把NaCl和NaClO统一为通式
 (
(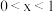 )。根据元素守恒,可知所得溶液中
)。根据元素守恒,可知所得溶液中 的物质的量为
的物质的量为
您最近一年使用:0次

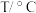
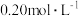 的
的
 的
的