名校
解题方法
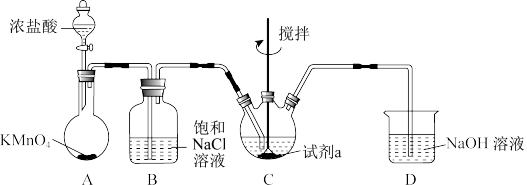
1 . 硫代尿素[(NH2)2CS]在工业上常用作还原剂,该物质易溶于水,温度较高时易发生异构化,实验室合成少量硫代尿素如图所示。回答下列问题:
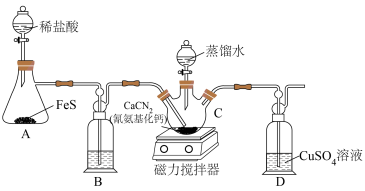
(1)工业上制备硫代尿素时,常利用碳将 高温下还原为CaS,然后再利用CaS进一步合成硫代尿素,试写出碳与
高温下还原为CaS,然后再利用CaS进一步合成硫代尿素,试写出碳与 发生反应的化学方程式
发生反应的化学方程式___________ 。
(2)装置B中盛放的是___________ (填写试剂名称),其作用是___________ 。
(3)实验开始时,先让A中反应一段时间,以便排出装置中的空气。当D中___________ (填写实验现象),则证明装置中的空气被排出。
(4)将蒸馏水滴入___________ 中(填写仪器C的名称),同时开启磁力搅拌器, 与
与 的水溶液反应生成硫代尿素。
的水溶液反应生成硫代尿素。
(5)C中反应结束后,将混合物过滤,将滤液减压蒸发浓缩、___________ (填写操作名称)、过滤、洗涤、低温烘干得到产品。蒸发浓缩时需要在减压条件下进行,其目的是___________ 。
(6)取2.0g制得的产品溶于水配成100mL溶液,量取25.00mL溶液,用0.50mol/L的酸性高锰酸钾溶液滴定,滴定至终点消耗酸性高锰酸钾溶液28.00mL,则产品的纯度为___________ %。已知滴定反应: 。
。

(1)工业上制备硫代尿素时,常利用碳将
 高温下还原为CaS,然后再利用CaS进一步合成硫代尿素,试写出碳与
高温下还原为CaS,然后再利用CaS进一步合成硫代尿素,试写出碳与 发生反应的化学方程式
发生反应的化学方程式(2)装置B中盛放的是
(3)实验开始时,先让A中反应一段时间,以便排出装置中的空气。当D中
(4)将蒸馏水滴入
 与
与 的水溶液反应生成硫代尿素。
的水溶液反应生成硫代尿素。(5)C中反应结束后,将混合物过滤,将滤液减压蒸发浓缩、
(6)取2.0g制得的产品溶于水配成100mL溶液,量取25.00mL溶液,用0.50mol/L的酸性高锰酸钾溶液滴定,滴定至终点消耗酸性高锰酸钾溶液28.00mL,则产品的纯度为
 。
。
您最近一年使用:0次
2023-11-15更新
|
206次组卷
|
3卷引用:湖北省名校联考2023-2024学年高三上学期11月期中考试化学试题
名校
解题方法
2 . 资料显示, 能还原
能还原 、
、 ,某小组对此进行探究。
,某小组对此进行探究。
实验:将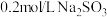 溶液滴入到物质a中,记录如下:
溶液滴入到物质a中,记录如下:
(1)用化学用语解释 溶液呈碱性的原因
溶液呈碱性的原因___________ 。
(2)经检验,I中白色沉淀是 。用酸性
。用酸性 溶液证实白色沉淀中含有
溶液证实白色沉淀中含有 ,现象是
,现象是___________ 。
(3)重新设计实验(III),证实了: 能还原
能还原 ,装置如下图所示。
,装置如下图所示。
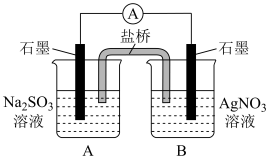
现象:i.电流表指针偏转。
ii.B中石墨电极上析出白色固体。
取出少量白色固体,洗涤后,___________ (填操作和现象),证明白色固体中含有Ag。
(4)经检验,II中的棕黄色沉淀不含 ,含有
,含有 、
、 和
和 。
。
资料: ,
, 。
。
①用稀 溶解沉淀,析出红色固体,说明棕黄色沉淀中含有
溶解沉淀,析出红色固体,说明棕黄色沉淀中含有___________ 。
②通过下列实验证实,沉淀中含有 和上层清液中仍检出了
和上层清液中仍检出了 (忽略空气的影响)。
(忽略空气的影响)。
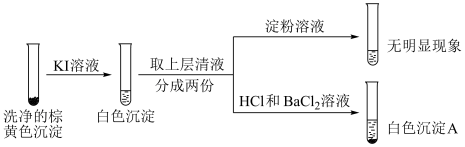
i.白色沉淀A是 。
。
ii.根据资料,上层清液加入淀粉后应该变蓝。分析现象与资料不符的原因:
原因一:KI未被氧化。则将 氧化的微粒是
氧化的微粒是___________ 。
原因二:KI被氧化,由于___________ (用离子方程式表示),所以无明显现象。
③当加入的KI过量且反应充分时,白色沉淀中不含Cu单质,上层清液中仍检出了 。结合物质组成、化学反应等解释上层清液中检出
。结合物质组成、化学反应等解释上层清液中检出 的原因
的原因___________ 。
小结:I中: 未能还原
未能还原 的原因与反应速率、离子浓度变化等因素有关。
的原因与反应速率、离子浓度变化等因素有关。
 能还原
能还原 、
、 ,某小组对此进行探究。
,某小组对此进行探究。实验:将
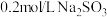 溶液滴入到物质a中,记录如下:
溶液滴入到物质a中,记录如下:| 序号 | 装置 | 物质a | 现象 |
| I | 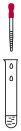 2 mL 物质a | 饱和 溶液 溶液 | 产生白色沉淀 |
| II | 0.2 mol/L  溶液 溶液 | 溶液变绿,继续滴加产生棕黄色沉淀 |
(1)用化学用语解释
 溶液呈碱性的原因
溶液呈碱性的原因(2)经检验,I中白色沉淀是
 。用酸性
。用酸性 溶液证实白色沉淀中含有
溶液证实白色沉淀中含有 ,现象是
,现象是(3)重新设计实验(III),证实了:
 能还原
能还原 ,装置如下图所示。
,装置如下图所示。
现象:i.电流表指针偏转。
ii.B中石墨电极上析出白色固体。
取出少量白色固体,洗涤后,
(4)经检验,II中的棕黄色沉淀不含
 ,含有
,含有 、
、 和
和 。
。资料:
 ,
, 。
。①用稀
 溶解沉淀,析出红色固体,说明棕黄色沉淀中含有
溶解沉淀,析出红色固体,说明棕黄色沉淀中含有②通过下列实验证实,沉淀中含有
 和上层清液中仍检出了
和上层清液中仍检出了 (忽略空气的影响)。
(忽略空气的影响)。
i.白色沉淀A是
 。
。ii.根据资料,上层清液加入淀粉后应该变蓝。分析现象与资料不符的原因:
原因一:KI未被氧化。则将
 氧化的微粒是
氧化的微粒是原因二:KI被氧化,由于
③当加入的KI过量且反应充分时,白色沉淀中不含Cu单质,上层清液中仍检出了
 。结合物质组成、化学反应等解释上层清液中检出
。结合物质组成、化学反应等解释上层清液中检出 的原因
的原因小结:I中:
 未能还原
未能还原 的原因与反应速率、离子浓度变化等因素有关。
的原因与反应速率、离子浓度变化等因素有关。
您最近一年使用:0次
名校
解题方法
3 . 回答下列问题。
(1)为探究 与
与 的还原性强弱,取适量制得的
的还原性强弱,取适量制得的 晶体,进行如下实验:
晶体,进行如下实验:
将适量 加入
加入 溶液中,若观察到
溶液中,若观察到___________ ,则可证明还原性 ;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:
;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:___________ 。
(2)为了证明 可以氧化
可以氧化 溶液中的
溶液中的 ,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:___________

(1)为探究
 与
与 的还原性强弱,取适量制得的
的还原性强弱,取适量制得的 晶体,进行如下实验:
晶体,进行如下实验:将适量
 加入
加入 溶液中,若观察到
溶液中,若观察到 ;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:
;实际发现溶液产生红褐色沉淀,并闻到臭鸡蛋气味气体,请从平衡移动的角度解释上述现象:(2)为了证明
 可以氧化
可以氧化 溶液中的
溶液中的 ,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
,某同学设计了一个原电池装置,并正确绘制了其工作原理示意图,但不慎被污渍遮住了部分内容(如下图),请“复原”该示意图:
您最近一年使用:0次
4 . 碘元素是人体必需的微量元素之一。某学习小组在实验室进行海带提碘的探究,实验过程如下:
Ⅰ.海带中碘元素的确定
(1)同学们称取一定量干海带,将海带先剪碎,然后用水浸泡、洗净、晾干,放入_______ (填仪器名称)中灼烧至海带完全成灰烬,然后继续进行下列流程。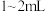 ,加入
,加入 稀硫酸、
稀硫酸、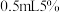 的
的 溶液,然后再加入
溶液,然后再加入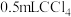 ,振荡后静置,若观察到
,振荡后静置,若观察到_______ (填实验现象),则证明海带中含有碘元素,上述过程中涉及的离子反应方程式为_______ 。
Ⅱ.海带提碘 中,可采取的操作是
中,可采取的操作是_______ 。
(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需经过蒸馏,指出图实验装置中存在的错误之处_______ 。
Ⅲ.人体碘的重要来源之一是食用加碘食盐(含 )。为测定加碘食盐中的碘含量,学习小组设计如下实验:
)。为测定加碘食盐中的碘含量,学习小组设计如下实验: 食盐样品,加适量蒸馏水使其完全溶解;
食盐样品,加适量蒸馏水使其完全溶解;
②用稀硫酸酸化所得溶液,加入足量 溶液,使
溶液,使 与
与 反应完全生成
反应完全生成 ;
;
③向②中混合液逐滴加入浓度为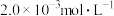 的
的 溶液,恰好反应完全时,消耗
溶液,恰好反应完全时,消耗 溶液
溶液 。(已知:
。(已知: )
)
(5)写出步骤②中发生反应的离子方程式_______ 。
(6)上述实验样品中碘元素的含量为_______ 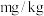 (用含w的代数式表示)。
(用含w的代数式表示)。
Ⅰ.海带中碘元素的确定
(1)同学们称取一定量干海带,将海带先剪碎,然后用水浸泡、洗净、晾干,放入

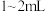 ,加入
,加入 稀硫酸、
稀硫酸、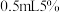 的
的 溶液,然后再加入
溶液,然后再加入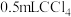 ,振荡后静置,若观察到
,振荡后静置,若观察到Ⅱ.海带提碘

 中,可采取的操作是
中,可采取的操作是(4)从含碘的有机溶剂中提取碘和回收有机溶剂,还需经过蒸馏,指出图实验装置中存在的错误之处
Ⅲ.人体碘的重要来源之一是食用加碘食盐(含
 )。为测定加碘食盐中的碘含量,学习小组设计如下实验:
)。为测定加碘食盐中的碘含量,学习小组设计如下实验: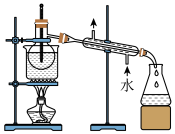
 食盐样品,加适量蒸馏水使其完全溶解;
食盐样品,加适量蒸馏水使其完全溶解;②用稀硫酸酸化所得溶液,加入足量
 溶液,使
溶液,使 与
与 反应完全生成
反应完全生成 ;
;③向②中混合液逐滴加入浓度为
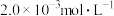 的
的 溶液,恰好反应完全时,消耗
溶液,恰好反应完全时,消耗 溶液
溶液 。(已知:
。(已知: )
)(5)写出步骤②中发生反应的离子方程式
(6)上述实验样品中碘元素的含量为
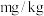 (用含w的代数式表示)。
(用含w的代数式表示)。
您最近一年使用:0次
2024-02-20更新
|
211次组卷
|
2卷引用:陕西省咸阳市实验中学2021-2022学年高一下学期阶段性检测(一)化学试题
5 . 某化学兴趣小组在研究“铁及其化合物性质”时,发现向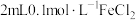 溶液中滴加2滴
溶液中滴加2滴 溶液,无明显现象,再滴加
溶液,无明显现象,再滴加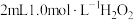 溶液(pH约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
溶液(pH约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
(1)溶液先变红的原因是___________ (用两个离子方程式表示)。
(2)同学们对溶液褪色的原因提出了不同的看法并进行实验:
I.甲同学认为是 被
被 还原。
还原。
取褪色后溶液,滴加___________ ,无明显现象,证明甲同学观点不正确。
II.乙同学认为是 被氧化。
被氧化。
取褪色后溶液,滴加KSCN溶液,出现红色。
根据上述实验现象,同学们认为溶液褪色的原因可能有两种:
乙同学认为 被
被 氧化。
氧化。
丙同学认为___________ 。
为了探究溶液褪色的原因究竟是上述的哪一种,该兴趣小组进行了如下实验。
向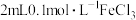 溶液中滴加2滴
溶液中滴加2滴 溶液,后通入
溶液,后通入 。发现溶液
。发现溶液___________ ,证明溶液褪色的原因不是乙同学认为的原因,而是丙同学认为的原因。
(3)该兴趣小组通过查阅资料,发现 可以被氧化成
可以被氧化成 和两种可直接排放到空气中的气体。设计实验方案验证褪色后的溶液中存在
和两种可直接排放到空气中的气体。设计实验方案验证褪色后的溶液中存在 :
:___________ 。
(4)写出上述实验中 被氧化的离子方程式:
被氧化的离子方程式:___________ 。
(5)根据题目所给信息及实验现象推断物质还原性强弱:
___________  (填“>”或“<”),理由:
(填“>”或“<”),理由:___________ 。
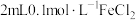 溶液中滴加2滴
溶液中滴加2滴 溶液,无明显现象,再滴加
溶液,无明显现象,再滴加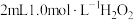 溶液(pH约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:
溶液(pH约为5),溶液先变红,后褪色,并有气泡产生。为了弄清楚产生这种异常现象的原因,他们进行了如下探究:(1)溶液先变红的原因是
(2)同学们对溶液褪色的原因提出了不同的看法并进行实验:
I.甲同学认为是
 被
被 还原。
还原。取褪色后溶液,滴加
II.乙同学认为是
 被氧化。
被氧化。取褪色后溶液,滴加KSCN溶液,出现红色。
根据上述实验现象,同学们认为溶液褪色的原因可能有两种:
乙同学认为
 被
被 氧化。
氧化。丙同学认为
为了探究溶液褪色的原因究竟是上述的哪一种,该兴趣小组进行了如下实验。
向
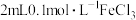 溶液中滴加2滴
溶液中滴加2滴 溶液,后通入
溶液,后通入 。发现溶液
。发现溶液(3)该兴趣小组通过查阅资料,发现
 可以被氧化成
可以被氧化成 和两种可直接排放到空气中的气体。设计实验方案验证褪色后的溶液中存在
和两种可直接排放到空气中的气体。设计实验方案验证褪色后的溶液中存在 :
:(4)写出上述实验中
 被氧化的离子方程式:
被氧化的离子方程式:(5)根据题目所给信息及实验现象推断物质还原性强弱:

 (填“>”或“<”),理由:
(填“>”或“<”),理由:
您最近一年使用:0次
2023-12-23更新
|
155次组卷
|
2卷引用:湖南省长沙市南雅中学2023-2024学年高一上学期第三次12月月考化学试卷
解题方法
6 . 某小组同学设计如下实验装置制备高铁酸钾 (夹持装置略),同时探究制备的适宜条件,已知:常温下,
(夹持装置略),同时探究制备的适宜条件,已知:常温下, 为紫色固体,微溶于KOH溶液。
为紫色固体,微溶于KOH溶液。
(1)装置A反应中的氧化剂为___________ 。
(2)进一步设计如下对比实验,探究在不同试剂a对 产率的影响。已知实验中,溶液总体积、
产率的影响。已知实验中,溶液总体积、 和
和 的物质的量、
的物质的量、 的通入量均相同。
的通入量均相同。
①对比实验i与ii现象,提出假设;“实验ii溶液碱性较强,、增强+3价铁的还原性”验证此假设的实验装置如图所示:

当通入 ,电压表示数为
,电压表示数为 ;再向右侧烧杯中加入的试剂为
;再向右侧烧杯中加入的试剂为___________ ,电压表示数为 ;且观察
;且观察
___________  (填“>”“<”或“=”)证明上述假设成立。
(填“>”“<”或“=”)证明上述假设成立。
②配平实验iii中反应的离子方程式:_________
□ □
□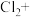 □
□ □
□ □
□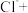 □
□
③实验ii中 的产率比实验iii的低,其原因可能是
的产率比实验iii的低,其原因可能是___________ 。
(3)随着反应的发生,装置B中不断有白色片状固体产生。
①结合化学用语解释该现象:___________ ;
②若拆除装置B,而使 的产率降低的原因是
的产率降低的原因是___________ 。
(4)向实验ii所得紫色溶液中继续通入 ,溶液紫色变浅,
,溶液紫色变浅, 的产率降低。可能原因是通入的
的产率降低。可能原因是通入的 消耗了KOH,写出该反应的离子方程式:
消耗了KOH,写出该反应的离子方程式:___________ 。
(5)综上可知制备 ,所需的适宜条件是
,所需的适宜条件是___________ 。
 (夹持装置略),同时探究制备的适宜条件,已知:常温下,
(夹持装置略),同时探究制备的适宜条件,已知:常温下, 为紫色固体,微溶于KOH溶液。
为紫色固体,微溶于KOH溶液。
(1)装置A反应中的氧化剂为
(2)进一步设计如下对比实验,探究在不同试剂a对
 产率的影响。已知实验中,溶液总体积、
产率的影响。已知实验中,溶液总体积、 和
和 的物质的量、
的物质的量、 的通入量均相同。
的通入量均相同。| 实验编号 | 试剂a | 实验现象 |
| i |  溶液和少量KOH 溶液和少量KOH | 无明显现象 |
| ii |  溶液和过量KOH 溶液和过量KOH | 得到紫色溶液,无紫色固体 |
| iii |  溶液和过量KOH 溶液和过量KOH | 得到深紫色溶液,有紫色固体 |

当通入
 ,电压表示数为
,电压表示数为 ;再向右侧烧杯中加入的试剂为
;再向右侧烧杯中加入的试剂为 ;且观察
;且观察
 (填“>”“<”或“=”)证明上述假设成立。
(填“>”“<”或“=”)证明上述假设成立。②配平实验iii中反应的离子方程式:
□
 □
□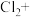 □
□ □
□ □
□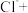 □
□③实验ii中
 的产率比实验iii的低,其原因可能是
的产率比实验iii的低,其原因可能是(3)随着反应的发生,装置B中不断有白色片状固体产生。
①结合化学用语解释该现象:
②若拆除装置B,而使
 的产率降低的原因是
的产率降低的原因是(4)向实验ii所得紫色溶液中继续通入
 ,溶液紫色变浅,
,溶液紫色变浅, 的产率降低。可能原因是通入的
的产率降低。可能原因是通入的 消耗了KOH,写出该反应的离子方程式:
消耗了KOH,写出该反应的离子方程式:(5)综上可知制备
 ,所需的适宜条件是
,所需的适宜条件是
您最近一年使用:0次
21-22高一下·上海浦东新·期中
名校
解题方法
7 . 铁元素在化合物中有多种化合价,常见的有+2,+3价。
Ⅰ.某溶液中有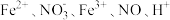 和
和 六种粒子,分别属于同一氧化还原反应中的反应物和生成物。
六种粒子,分别属于同一氧化还原反应中的反应物和生成物。
(1)请写出该反应的离子方程式___________ 。
(2)该反应中氧化剂与还原剂的物质的量之比为___________ ;产生2mol还原产物时转移电子的总数为___________ 。
Ⅱ.磁铁矿的主要成分是 。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。步骤如下:
。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。步骤如下:
①取少量磁铁矿石样品,加入过量的试剂A溶解。
②验证:
取溶解后的液体少许,加入少量试剂B,观察现象。
③验证:
取溶解后的液体少许,加入少量试剂C,观察现象。
(3)试剂A为___________ ,发生反应的离子方程式为___________ 。
(4)试剂B为___________ ,观察到___________ ,则证明有 。
。
(5)试剂C为___________ ,观察到___________ ,则证明有 。
。
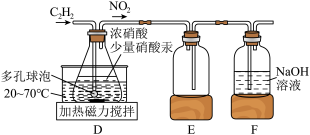
Ⅰ.某溶液中有
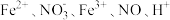 和
和 六种粒子,分别属于同一氧化还原反应中的反应物和生成物。
六种粒子,分别属于同一氧化还原反应中的反应物和生成物。(1)请写出该反应的离子方程式
(2)该反应中氧化剂与还原剂的物质的量之比为
Ⅱ.磁铁矿的主要成分是
 。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。步骤如下:
。某同学设计实验证明磁铁矿石中存在+2、+3价的铁元素。步骤如下:①取少量磁铁矿石样品,加入过量的试剂A溶解。
②验证:

取溶解后的液体少许,加入少量试剂B,观察现象。
③验证:

取溶解后的液体少许,加入少量试剂C,观察现象。
(3)试剂A为
(4)试剂B为
 。
。(5)试剂C为
 。
。
您最近一年使用:0次
8 . 草酸与草酸钠在生产、科研中应用广泛。
(1)草酸(H2C2O4)又名乙二酸,为无色透明晶体,是二元有机酸,是化学分析中常用的还原剂,也是一种重要的有机化工原料。
某小组同学通过查阅文献资料得知:用Hg(NO3)2作催化剂时,浓硝酸氧化乙炔制取H2C2O4,实验装置如下图所示:
①装置D不能用明火加热的原因是___________ 。
②写出装置D中制备H2C2O4的化学方程式___________ 。
③下列实验设计不能证明草酸是弱酸的是________________ 。
A.室温下,用pH计测定0.1mol•L-1H2C2O4水溶液pH,pH=1.3
B.室温下,取pH广泛试纸测定Na2C2O4溶液pH,pH>7
C.室温下,取pH=1的H2C2O4溶液稀释100倍后,测其pH<3
D.标准状况下,取0.10mol∙L-1的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL
(2)草酸钠(Na2C2O4)为白色结晶性粉末,是一种还原剂,也常作为双齿配体,可以被酸性高锰酸钾溶液氧化。某小组利用配制的草酸钠溶液测定高锰酸钾(M=158g/mol)产品纯度,步骤如下:
I.称取4.0g高锰酸钾产品,配成100mL溶液。
Ⅱ.准确量取0.10mol/LNa2C2O4溶液100mL,置于锥形瓶中
Ⅲ .将瓶中溶液加热到75~80℃,再加入少量硫酸酸化,趁热用I中配制的高锰酸钾溶液滴定,滴定终点消耗高锰酸钾溶液20.00mL。
①步骤I中用到的玻璃仪器除了小烧杯、玻璃棒、胶头滴管外,还有___________ 。
②滴定过程中反应的离子方程式为___________ 。
③在室温下,该反应的速率缓慢,因此常将溶液加热至343~358K进行滴定。但温度不宜过高,加热温度高于363K,会使部分H2C2O4发生分解,会导致测得的高锰酸钾产品纯度___________ 。(填“偏高”、“偏低”或“无影响”)
④实验测得高锰酸钾的纯度为___________ 。
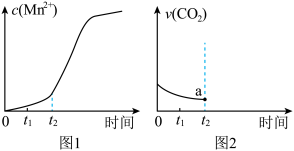
⑤若该实验中测得反应液中Mn2+的浓度随反应时间t的变化如图1所示,结合图1信息,请在图2画出t2后生成CO2的速率图像___________ (从a点开始作图)。
(1)草酸(H2C2O4)又名乙二酸,为无色透明晶体,是二元有机酸,是化学分析中常用的还原剂,也是一种重要的有机化工原料。
某小组同学通过查阅文献资料得知:用Hg(NO3)2作催化剂时,浓硝酸氧化乙炔制取H2C2O4,实验装置如下图所示:

①装置D不能用明火加热的原因是
②写出装置D中制备H2C2O4的化学方程式
③下列实验设计不能证明草酸是弱酸的是
A.室温下,用pH计测定0.1mol•L-1H2C2O4水溶液pH,pH=1.3
B.室温下,取pH广泛试纸测定Na2C2O4溶液pH,pH>7
C.室温下,取pH=1的H2C2O4溶液稀释100倍后,测其pH<3
D.标准状况下,取0.10mol∙L-1的H2C2O4溶液100mL与足量锌粉反应,收集到H2体积为224mL
(2)草酸钠(Na2C2O4)为白色结晶性粉末,是一种还原剂,也常作为双齿配体,可以被酸性高锰酸钾溶液氧化。某小组利用配制的草酸钠溶液测定高锰酸钾(M=158g/mol)产品纯度,步骤如下:
I.称取4.0g高锰酸钾产品,配成100mL溶液。
Ⅱ.准确量取0.10mol/LNa2C2O4溶液100mL,置于锥形瓶中
Ⅲ .将瓶中溶液加热到75~80℃,再加入少量硫酸酸化,趁热用I中配制的高锰酸钾溶液滴定,滴定终点消耗高锰酸钾溶液20.00mL。
①步骤I中用到的玻璃仪器除了小烧杯、玻璃棒、胶头滴管外,还有
②滴定过程中反应的离子方程式为
③在室温下,该反应的速率缓慢,因此常将溶液加热至343~358K进行滴定。但温度不宜过高,加热温度高于363K,会使部分H2C2O4发生分解,会导致测得的高锰酸钾产品纯度
④实验测得高锰酸钾的纯度为
⑤若该实验中测得反应液中Mn2+的浓度随反应时间t的变化如图1所示,结合图1信息,请在图2画出t2后生成CO2的速率图像

您最近一年使用:0次
9 . 铅及其化合物用途多样。查资料得知 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:
(1)铅是碳的同族元索,铅原子基态价电子排布式为___________ ,常见价态为_____ 和_____ 。
(2) 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为___________ 。
(3) 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为___________ ; 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为___________ 。
(4) 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即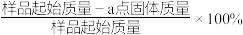 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为___________ 。 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:
①
②
上述过程中 的作用是
的作用是___________ ,请设计实验方案证明 的作用
的作用___________ 。
 是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此
是不溶于水的固体,受热会发生分解反应。其晶体内部有空穴,使得电子可以在空穴中跳跃,就像在跳棋中那样,因此 可以导电,用作铅酸蓄电池的电极。请回答下列问题:
可以导电,用作铅酸蓄电池的电极。请回答下列问题:(1)铅是碳的同族元索,铅原子基态价电子排布式为
(2)
 与浓盐酸共热生成黄绿色气体,反应的离子方程式为
与浓盐酸共热生成黄绿色气体,反应的离子方程式为(3)
 可由
可由 与次氯酸钠溶液反应制得,反应的离子方程式为
与次氯酸钠溶液反应制得,反应的离子方程式为 也可以通过石墨为电极,以
也可以通过石墨为电极,以 和
和 的混合溶液为电解液电解制取。阳极发生的电极反应式为
的混合溶液为电解液电解制取。阳极发生的电极反应式为(4)
 在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即
在加热过程发生分解的失重曲线如图所示,已知失重曲线上的a点为样品失重3.35%(即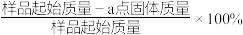 )的残留固体,通过计算求表示a点固体组成的化学式为
)的残留固体,通过计算求表示a点固体组成的化学式为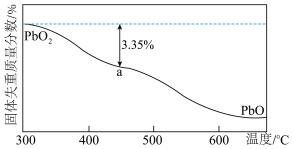
 ,从而实现铅的再生利用。在此过程中涉及如下两个反应:
,从而实现铅的再生利用。在此过程中涉及如下两个反应:①

②

上述过程中
 的作用是
的作用是 的作用
的作用
您最近一年使用:0次
名校
解题方法
10 .  为高效安全灭菌消毒剂之一,易与水反应。沸点为
为高效安全灭菌消毒剂之一,易与水反应。沸点为 ,受热易分解,高浓度时易爆炸,现用如图所示装置制备
,受热易分解,高浓度时易爆炸,现用如图所示装置制备 ,并将其通入潮湿的
,并将其通入潮湿的 得到
得到 。
。
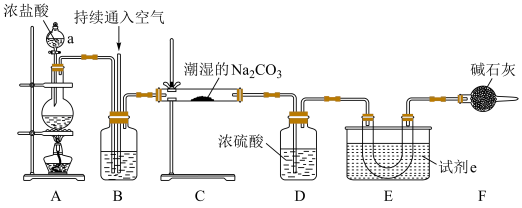
(1)仪器a的名称是___________ ,A中发生的化学反应方程式为___________ 。
(2)装置B中盛放的试剂是___________ 。实验需要按 和空气体积比
和空气体积比 的比例向装置B中持续通入空气。通入空气的目的是
的比例向装置B中持续通入空气。通入空气的目的是___________ ,可以通过观察装置B中___________ 控制通入空气的速度。
(3)装置E水槽中盛装的试剂e是___________。(填序号)
(4)装置F中碱石灰的作用是___________ 。
(5)已知氯气和潮湿 反应生成
反应生成 和另外两种盐,还原产物的化学式为
和另外两种盐,还原产物的化学式为___________ ,检验其阴离子的操作是:取少量反应后的固体加水溶解于试管中,滴加___________ ,若观察到有___________ ,即可证明。
(6) 属于酸性氧化物,将其溶解于
属于酸性氧化物,将其溶解于 溶液的离子方程式为
溶液的离子方程式为___________ 。
(7)将 和
和 混合通入水中,生成淡黄色沉淀,溶液呈强酸性,写出化学方程式
混合通入水中,生成淡黄色沉淀,溶液呈强酸性,写出化学方程式___________ 。(用双线桥表示电子转移情况)
(8)实验室使用的是质量分数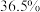 ,密度
,密度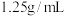 的浓盐酸溶液。若在实验过程中生成了
的浓盐酸溶液。若在实验过程中生成了 (标准状况)
(标准状况) ,至少需要
,至少需要___________  的浓盐酸。实际使用量为该体积的两倍,配制所需该物质的量浓度的浓盐酸,需要用到的玻璃仪器有烧杯、玻璃棒、
的浓盐酸。实际使用量为该体积的两倍,配制所需该物质的量浓度的浓盐酸,需要用到的玻璃仪器有烧杯、玻璃棒、___________ 。
 为高效安全灭菌消毒剂之一,易与水反应。沸点为
为高效安全灭菌消毒剂之一,易与水反应。沸点为 ,受热易分解,高浓度时易爆炸,现用如图所示装置制备
,受热易分解,高浓度时易爆炸,现用如图所示装置制备 ,并将其通入潮湿的
,并将其通入潮湿的 得到
得到 。
。
(1)仪器a的名称是
(2)装置B中盛放的试剂是
 和空气体积比
和空气体积比 的比例向装置B中持续通入空气。通入空气的目的是
的比例向装置B中持续通入空气。通入空气的目的是(3)装置E水槽中盛装的试剂e是___________。(填序号)
| A.自来水 | B.热水 | C.冰水混合物 | D. |
(5)已知氯气和潮湿
 反应生成
反应生成 和另外两种盐,还原产物的化学式为
和另外两种盐,还原产物的化学式为(6)
 属于酸性氧化物,将其溶解于
属于酸性氧化物,将其溶解于 溶液的离子方程式为
溶液的离子方程式为(7)将
 和
和 混合通入水中,生成淡黄色沉淀,溶液呈强酸性,写出化学方程式
混合通入水中,生成淡黄色沉淀,溶液呈强酸性,写出化学方程式(8)实验室使用的是质量分数
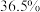 ,密度
,密度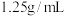 的浓盐酸溶液。若在实验过程中生成了
的浓盐酸溶液。若在实验过程中生成了 (标准状况)
(标准状况) ,至少需要
,至少需要 的浓盐酸。实际使用量为该体积的两倍,配制所需该物质的量浓度的浓盐酸,需要用到的玻璃仪器有烧杯、玻璃棒、
的浓盐酸。实际使用量为该体积的两倍,配制所需该物质的量浓度的浓盐酸,需要用到的玻璃仪器有烧杯、玻璃棒、
您最近一年使用:0次



