21-22高三上·江苏南通·期中
1 . 将金属纳米颗粒与铁氧体一起来制成复合物的研究逐渐成为热点。Fe/Fe3O4复合物材料在很多领域都具有应用。一种制取Fe/Fe3O4复合物的实验装置如图所示,实验过程如下:
步骤1:向三颈烧瓶中通入氮气,将10mLFeCl2溶液以2mL·min-1的速度滴入20mLKOH溶液中,控制温度为100℃,回流3h。
步骤2:待三颈烧瓶冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,40℃干燥,300℃焙烧,得Fe/Fe3O4复合物粗品。

(1)步骤1中反应生成了Fe和Fe3O4,该反应的离子方程式为___________ 。
(2)步骤2中用热水洗涤沉淀时,检验沉淀是否洗净的方法是___________ 。
(3)步骤2中用乙醇洗涤的目的是___________ 。
(4)步骤2中干燥、焙烧时,可能有部分Fe或Fe3O4被氧化为Fe2O3,为测定所得Fe/Fe3O4复合物粗品中Fe3O4的含量,现进行如下实验:准确称量0.4000g粗品,将粗品中的Fe分离出去,向剩余固体中加入足量稀H2SO4,待固体完全溶解后,将溶液转移至锥形瓶中,滴加2滴二苯胺磺酸钠溶液作指示剂,用0.01000mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL。
已知:Ⅰ.二苯胺磺酸钠溶液遇Fe2+显紫色,遇Fe3+不显色;
Ⅱ.Cr2O 可发生转化:Gr2O
可发生转化:Gr2O
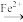 Cr3+。
Cr3+。
①滴定终点的现象是___________ 。
②计算粗品中Fe3O4的质量分数,并写出计算过程___________ 。
步骤1:向三颈烧瓶中通入氮气,将10mLFeCl2溶液以2mL·min-1的速度滴入20mLKOH溶液中,控制温度为100℃,回流3h。
步骤2:待三颈烧瓶冷却后过滤,依次用热水和乙醇洗涤所得黑色沉淀,40℃干燥,300℃焙烧,得Fe/Fe3O4复合物粗品。

(1)步骤1中反应生成了Fe和Fe3O4,该反应的离子方程式为
(2)步骤2中用热水洗涤沉淀时,检验沉淀是否洗净的方法是
(3)步骤2中用乙醇洗涤的目的是
(4)步骤2中干燥、焙烧时,可能有部分Fe或Fe3O4被氧化为Fe2O3,为测定所得Fe/Fe3O4复合物粗品中Fe3O4的含量,现进行如下实验:准确称量0.4000g粗品,将粗品中的Fe分离出去,向剩余固体中加入足量稀H2SO4,待固体完全溶解后,将溶液转移至锥形瓶中,滴加2滴二苯胺磺酸钠溶液作指示剂,用0.01000mol·L-1K2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液20.00mL。
已知:Ⅰ.二苯胺磺酸钠溶液遇Fe2+显紫色,遇Fe3+不显色;
Ⅱ.Cr2O
 可发生转化:Gr2O
可发生转化:Gr2O
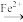 Cr3+。
Cr3+。①滴定终点的现象是
②计算粗品中Fe3O4的质量分数,并写出计算过程
您最近一年使用:0次
名校
2 . 从氧化锌烟尘(主要成分ZnO、 、ZnS、
、ZnS、 、CaO、FeO)中提取金属锗的流程如下所示:
、CaO、FeO)中提取金属锗的流程如下所示:
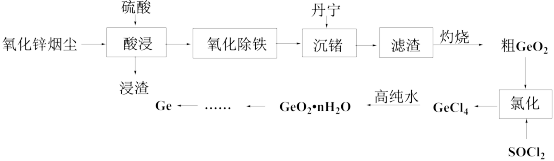
(1)写出锗的原子结构示意图:___________ 。
(2)烟尘经硫酸浸取后所得浸渣经分析含有S、 、
、___________ (填化学式),写出酸浸过程中生成S所发生的化学反应方程式:___________ 。
(3)“氧化除铁”一般先加入稍过量的氧化剂,再调节pH,当 开始沉淀时
开始沉淀时 浓度为
浓度为___________ 。
(4)“灼烧”得到粗 所需要的陶瓷仪器有
所需要的陶瓷仪器有___________ 、___________ 。
(5)“氯化”过程中除生成 外还得到一种氧化物,写出化学反应方程式:
外还得到一种氧化物,写出化学反应方程式:___________ 。
(6)用高纯水处理 后需要洗涤,能否使用pH试纸来检验
后需要洗涤,能否使用pH试纸来检验 是否洗涤干净,并说明理由:
是否洗涤干净,并说明理由:___________ 。
(7)若烟尘气中锗含量表示为 的质量分数a,则处理m吨烟尘气得到Ge的质量为nkg,则该流程综合产率为
的质量分数a,则处理m吨烟尘气得到Ge的质量为nkg,则该流程综合产率为___________ %。(用上述字母的代数式表示)
 、ZnS、
、ZnS、 、CaO、FeO)中提取金属锗的流程如下所示:
、CaO、FeO)中提取金属锗的流程如下所示:
(1)写出锗的原子结构示意图:
(2)烟尘经硫酸浸取后所得浸渣经分析含有S、
 、
、(3)“氧化除铁”一般先加入稍过量的氧化剂,再调节pH,当
 开始沉淀时
开始沉淀时 浓度为
浓度为| 离子沉淀相关pH |  |  |  |
开始沉淀(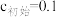 mol/L) mol/L) | 7.5 | 1.7 | 8.2 |
完全沉淀(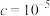 mol/L) mol/L) | 9.0 | 3.1 |
 所需要的陶瓷仪器有
所需要的陶瓷仪器有(5)“氯化”过程中除生成
 外还得到一种氧化物,写出化学反应方程式:
外还得到一种氧化物,写出化学反应方程式:(6)用高纯水处理
 后需要洗涤,能否使用pH试纸来检验
后需要洗涤,能否使用pH试纸来检验 是否洗涤干净,并说明理由:
是否洗涤干净,并说明理由:(7)若烟尘气中锗含量表示为
 的质量分数a,则处理m吨烟尘气得到Ge的质量为nkg,则该流程综合产率为
的质量分数a,则处理m吨烟尘气得到Ge的质量为nkg,则该流程综合产率为
您最近一年使用:0次
2021-11-19更新
|
294次组卷
|
2卷引用:四川省成都市石室中学2021-2022学年高三上学期期中考试化学试题
名校
3 . 金( )是国家重要储备物资。一种采用氰化工艺提金的流程如下:
)是国家重要储备物资。一种采用氰化工艺提金的流程如下:

(1)冶炼:第一步是在有氧存在的条件下,将金矿溶解于 溶液,第二步用锌将
溶液,第二步用锌将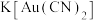 中的金置换出来。写出第一步反应的化学方程式:
中的金置换出来。写出第一步反应的化学方程式:_______ 。
(2)废水处理:利用 在
在 作用下产生的
作用下产生的 处理含氰废水的部分机理如下:
处理含氰废水的部分机理如下:
Ⅰ.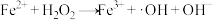
Ⅱ.
控制 ,
, 浓度为
浓度为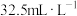 ,初始
,初始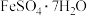 的投加量与氰去除率的关系如图所示,当
的投加量与氰去除率的关系如图所示,当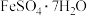 的投加量小于
的投加量小于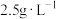 时,随着
时,随着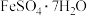 的投加量的增加,氰去除率上升的原因是
的投加量的增加,氰去除率上升的原因是_______ 。

(3)含量测定:准确称取 试样,加入王水
试样,加入王水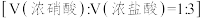 ,将
,将 转化成氯金酸(
转化成氯金酸(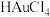 ,具有强氧化性,
,具有强氧化性, )。加热除去过量的
)。加热除去过量的 ,过滤,在不断搅拌下,加入过量
,过滤,在不断搅拌下,加入过量
 溶液
溶液 ,充分反应,二苯胺磺酸钠作指示剂,用
,充分反应,二苯胺磺酸钠作指示剂,用
 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 。
。
①王水中浓盐酸的主要作用是_______ 。
② 被
被 还原成
还原成 的离子方程式为
的离子方程式为_______ 。
③计算试样中金的质量分数(写出计算过程)_______ 。
 )是国家重要储备物资。一种采用氰化工艺提金的流程如下:
)是国家重要储备物资。一种采用氰化工艺提金的流程如下:
(1)冶炼:第一步是在有氧存在的条件下,将金矿溶解于
 溶液,第二步用锌将
溶液,第二步用锌将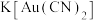 中的金置换出来。写出第一步反应的化学方程式:
中的金置换出来。写出第一步反应的化学方程式:(2)废水处理:利用
 在
在 作用下产生的
作用下产生的 处理含氰废水的部分机理如下:
处理含氰废水的部分机理如下:Ⅰ.
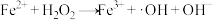
Ⅱ.

控制
 ,
, 浓度为
浓度为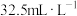 ,初始
,初始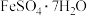 的投加量与氰去除率的关系如图所示,当
的投加量与氰去除率的关系如图所示,当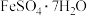 的投加量小于
的投加量小于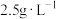 时,随着
时,随着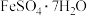 的投加量的增加,氰去除率上升的原因是
的投加量的增加,氰去除率上升的原因是
(3)含量测定:准确称取
 试样,加入王水
试样,加入王水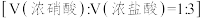 ,将
,将 转化成氯金酸(
转化成氯金酸(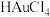 ,具有强氧化性,
,具有强氧化性, )。加热除去过量的
)。加热除去过量的 ,过滤,在不断搅拌下,加入过量
,过滤,在不断搅拌下,加入过量
 溶液
溶液 ,充分反应,二苯胺磺酸钠作指示剂,用
,充分反应,二苯胺磺酸钠作指示剂,用
 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗 溶液
溶液 。
。①王水中浓盐酸的主要作用是
②
 被
被 还原成
还原成 的离子方程式为
的离子方程式为③计算试样中金的质量分数(写出计算过程)
您最近一年使用:0次
2021-11-12更新
|
614次组卷
|
2卷引用:江苏省苏州市2021-2022学年高三上学期期中考试调研化学试题
解题方法
4 . 工业上用废钯催化剂(主要成分为Pd,还含有少量Al2O3)回收Pd及Al2(SO4)3的流程如图。

已知:“酸浸”和“中和”过程中所得含铝化合物分别为H2PdCl6、(NH4)2PdCl6;其中H2PdCl6为可溶性弱酸,(NH4)2PdCl6为难溶性固体。
回答下列问题:
(1)“焙烧”时,Al2O3与(NH4)2SO4反应的化学方程式为___________ ;“焙烧”产生的气体可通入到___________ 操作中(填操作单元的名称)。
(2)“酸浸”时发生反应的离子方程式为___________ 。
(3)实验室用下图装置进行Pd的热还原实验,测定滤渣中(NH4)2PdCl6的百分含量(杂质不参与反应)。

Ⅰ.将硬质玻璃管(带两端开关K1和K2,设为装置A)称重,记为m1 g。将滤渣装入硬质玻璃管中,再次称重,记为m2 g。
Ⅱ.热还原的操作步骤:①打开K1和K2,缓缓通入H2;②点燃酒精喷灯,加热;③充分反应后,熄灭酒精喷灯;④关闭K1和K2,冷却至室温;⑤打开K1和K2,改通空气后称量A;⑥重复上述操作步骤,直至A恒重,记为m3 g。操作⑤中改通空气的目的是___________ 。
Ⅲ.滤渣中(NH4)2PdCl6的质量分数表达式为___________ 。已知(NH4)2PdCl6的相对分子质量为355]
Ⅳ.实验结束后,发现硬质玻璃管右端有少量白色固体,其主要成分为___________ (填化学式),该现象导致实验结果___________ (填“偏高”、“偏低”或“无影响”)。
(4)金属Pd具有显著的吸氧性能,其密度为d g/cm3。标准状况下,海绵Pd吸收氢气的体积约为其体积的n倍,则海绵钯的储氢容量R=__________ mL/g。(储氢容量即1 g钯吸附氢气的体积)。

已知:“酸浸”和“中和”过程中所得含铝化合物分别为H2PdCl6、(NH4)2PdCl6;其中H2PdCl6为可溶性弱酸,(NH4)2PdCl6为难溶性固体。
回答下列问题:
(1)“焙烧”时,Al2O3与(NH4)2SO4反应的化学方程式为
(2)“酸浸”时发生反应的离子方程式为
(3)实验室用下图装置进行Pd的热还原实验,测定滤渣中(NH4)2PdCl6的百分含量(杂质不参与反应)。

Ⅰ.将硬质玻璃管(带两端开关K1和K2,设为装置A)称重,记为m1 g。将滤渣装入硬质玻璃管中,再次称重,记为m2 g。
Ⅱ.热还原的操作步骤:①打开K1和K2,缓缓通入H2;②点燃酒精喷灯,加热;③充分反应后,熄灭酒精喷灯;④关闭K1和K2,冷却至室温;⑤打开K1和K2,改通空气后称量A;⑥重复上述操作步骤,直至A恒重,记为m3 g。操作⑤中改通空气的目的是
Ⅲ.滤渣中(NH4)2PdCl6的质量分数表达式为
Ⅳ.实验结束后,发现硬质玻璃管右端有少量白色固体,其主要成分为
(4)金属Pd具有显著的吸氧性能,其密度为d g/cm3。标准状况下,海绵Pd吸收氢气的体积约为其体积的n倍,则海绵钯的储氢容量R=
您最近一年使用:0次
名校
5 . 氯化亚铜(CuCl)可用作有机合成催化剂、杀菌剂、媒染剂、脱色剂等,用途广泛,回答下列问题:
已知:①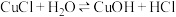
②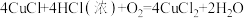
I.实验室采用 还原
还原 的方法制备CuCl,主要流程如图1所示:
的方法制备CuCl,主要流程如图1所示:

(1)上述方法制备CuCl涉及的离子方程式为: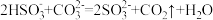 、
、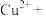

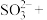 _______=
_______=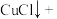

 (配平该离子方程式)
(配平该离子方程式)___________ 。
(2)实验室反应装置中的加热方式采用油浴,不使用热水浴,原因是___________ 。
(3)将CuCl沉淀先用___________ (填字母)洗涤3~5次,再用乙醇边洗涤边进行减压过滤,用乙醇作洗涤剂的目的是___________ 。
a. b.稀
b.稀 c.浓盐酸
c.浓盐酸
II.铈量法测定氯化亚铜(CuCl)的含量
称取0.2500g CuCl试样,置于预先放有50粒玻璃球和10mL 0.5mol/L 溶液(过量)的250mL锥形瓶中,不断摇动,待试样溶解充分反应后,加50mL水、2滴邻菲罗琳指示剂,立即用0.01mol/L
溶液(过量)的250mL锥形瓶中,不断摇动,待试样溶解充分反应后,加50mL水、2滴邻菲罗琳指示剂,立即用0.01mol/L  标准溶液滴定,颜色由红变绿时即为终点,消耗VmL,
标准溶液滴定,颜色由红变绿时即为终点,消耗VmL,
(4)CuCl被 溶液氧化的离子方程式为
溶液氧化的离子方程式为___________ 。
(5)滴定操作中盛放 标准溶液使用的仪器是
标准溶液使用的仪器是___________ 。
(6)滴定过程中发生氧化还原反应: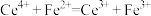 ,计算样品中CuCl质量分数的表达式为
,计算样品中CuCl质量分数的表达式为___________ (用含V的式子表示),
(7)判断下列情况对CuCl含量测定结果的影响(填“偏高”“偏低”或“无影响“)。
①若滴定开始时仰视滴定管刻度读数,则测定结果___________
②若滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则定结果___________
已知:①
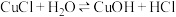
②
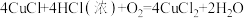
I.实验室采用
 还原
还原 的方法制备CuCl,主要流程如图1所示:
的方法制备CuCl,主要流程如图1所示:
(1)上述方法制备CuCl涉及的离子方程式为:
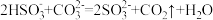 、
、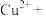

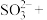 _______=
_______=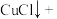

 (配平该离子方程式)
(配平该离子方程式)(2)实验室反应装置中的加热方式采用油浴,不使用热水浴,原因是
(3)将CuCl沉淀先用
a.
 b.稀
b.稀 c.浓盐酸
c.浓盐酸II.铈量法测定氯化亚铜(CuCl)的含量
称取0.2500g CuCl试样,置于预先放有50粒玻璃球和10mL 0.5mol/L
 溶液(过量)的250mL锥形瓶中,不断摇动,待试样溶解充分反应后,加50mL水、2滴邻菲罗琳指示剂,立即用0.01mol/L
溶液(过量)的250mL锥形瓶中,不断摇动,待试样溶解充分反应后,加50mL水、2滴邻菲罗琳指示剂,立即用0.01mol/L  标准溶液滴定,颜色由红变绿时即为终点,消耗VmL,
标准溶液滴定,颜色由红变绿时即为终点,消耗VmL,(4)CuCl被
 溶液氧化的离子方程式为
溶液氧化的离子方程式为(5)滴定操作中盛放
 标准溶液使用的仪器是
标准溶液使用的仪器是(6)滴定过程中发生氧化还原反应:
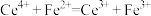 ,计算样品中CuCl质量分数的表达式为
,计算样品中CuCl质量分数的表达式为(7)判断下列情况对CuCl含量测定结果的影响(填“偏高”“偏低”或“无影响“)。
①若滴定开始时仰视滴定管刻度读数,则测定结果
②若滴定前后读数都正确,但滴定前有气泡,而滴定后气泡消失,则定结果
您最近一年使用:0次
2021-10-26更新
|
146次组卷
|
2卷引用:江西省抚州市临川区第十中学2022届高三月考化学试卷
名校
解题方法
6 . 氮化钙有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。某化学兴趣小组设计制备氮化钙并测定其纯度的实验如下:
已知:氮化钙(Ca3N2)是一种棕色粉末,遇水会发生水解,生成氢氧化钙并放出氨。
I.氮化钙的制备(如图):

(1)仪器a的名称是_______ 。
(2)装置A中每生成标准状况下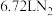 ,转移的电子数为
,转移的电子数为_______ 。
(3)装置C的作用是吸收氧气,则C中发生反应的离子方程式为_______ 。
(4)设计实验证明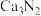 中混有钙单质,写出实验操作及现象:
中混有钙单质,写出实验操作及现象:_______ 。
II.测定氮化钙的纯度:
(5)甲同学称取mg反应后的固体,加入足量的碳酸钠溶液充分反应,过滤、洗涤、干燥得ng沉淀,通过数据m、n即可求得氮化钙的质量分数。
甲同学的方案是否合理?_______ (填“是”或“否”),理由是_______ 。
(6)乙同学的方案如下:
取氮化钙样品24g,按图所示装置进行实验,发现B装置增重5.1g。
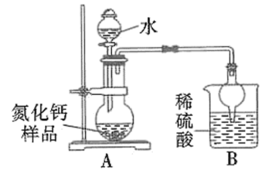
①该样品中氮化钙的质量分数为_______ 。
②导致该样品中氮化钙含量测定结果偏低的可能原因是_______ 。
已知:氮化钙(Ca3N2)是一种棕色粉末,遇水会发生水解,生成氢氧化钙并放出氨。
I.氮化钙的制备(如图):

(1)仪器a的名称是
(2)装置A中每生成标准状况下
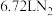 ,转移的电子数为
,转移的电子数为(3)装置C的作用是吸收氧气,则C中发生反应的离子方程式为
(4)设计实验证明
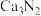 中混有钙单质,写出实验操作及现象:
中混有钙单质,写出实验操作及现象:II.测定氮化钙的纯度:
(5)甲同学称取mg反应后的固体,加入足量的碳酸钠溶液充分反应,过滤、洗涤、干燥得ng沉淀,通过数据m、n即可求得氮化钙的质量分数。
甲同学的方案是否合理?
(6)乙同学的方案如下:
取氮化钙样品24g,按图所示装置进行实验,发现B装置增重5.1g。

①该样品中氮化钙的质量分数为
②导致该样品中氮化钙含量测定结果偏低的可能原因是
您最近一年使用:0次
2021-09-16更新
|
255次组卷
|
3卷引用:云南省云南师范大学第二附属中学2022届高三8月理综试卷化学试题
名校
7 . 过氧化钙( )是一种白色、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
)是一种白色、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
①在 溶液中加入
溶液中加入 ;
;
②不断搅拌的同时加入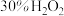 ,反应生成
,反应生成 沉淀;
沉淀;
③经过陈化、过滤,水洗得到 ,再脱水干燥得到
,再脱水干燥得到 。
。
已知 在350℃迅速分解生成
在350℃迅速分解生成 和
和 。下图是实验室测定产品中
。下图是实验室测定产品中 含量的装置(夹持装置省略)。
含量的装置(夹持装置省略)。
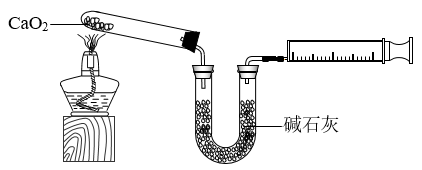
(1)第②步反应的化学方程式为___________ 。
(2) 加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是
加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是___________ 、___________ 。
(3)若所取产品质量是 ,测得气体体积为
,测得气体体积为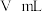 (已换算成标准状况),则产品中
(已换算成标准状况),则产品中 的质量分数为
的质量分数为___________ (用字母表示)。
(4)过氧化钙的含量也可用氧化还原滴定法测定,过程如下。准确称取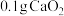 产品于锥形瓶中,加入
产品于锥形瓶中,加入 蒸馏水和
蒸馏水和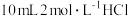 ,完全溶解后加入几滴
,完全溶解后加入几滴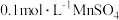 溶液,用
溶液,用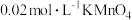 标准溶液滴定至终点。平行三次,所得实验数据如下表所示:
标准溶液滴定至终点。平行三次,所得实验数据如下表所示:
①反应加入 溶液的作用是
溶液的作用是___________ ,滴定的终点现象是___________ 。
②滴定过程中加入标准溶液发生反应的离子方程式为___________ ,过氧化钙的质量分数为___________ (保留两位有效数字)。
 )是一种白色、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:
)是一种白色、难溶于水的固体,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。工业生产过程如下:①在
 溶液中加入
溶液中加入 ;
;②不断搅拌的同时加入
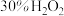 ,反应生成
,反应生成 沉淀;
沉淀;③经过陈化、过滤,水洗得到
 ,再脱水干燥得到
,再脱水干燥得到 。
。已知
 在350℃迅速分解生成
在350℃迅速分解生成 和
和 。下图是实验室测定产品中
。下图是实验室测定产品中 含量的装置(夹持装置省略)。
含量的装置(夹持装置省略)。
(1)第②步反应的化学方程式为
(2)
 加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是
加热脱水的过程中,需不断通入不含二氧化碳的氧气,目的是(3)若所取产品质量是
 ,测得气体体积为
,测得气体体积为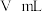 (已换算成标准状况),则产品中
(已换算成标准状况),则产品中 的质量分数为
的质量分数为(4)过氧化钙的含量也可用氧化还原滴定法测定,过程如下。准确称取
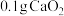 产品于锥形瓶中,加入
产品于锥形瓶中,加入 蒸馏水和
蒸馏水和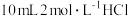 ,完全溶解后加入几滴
,完全溶解后加入几滴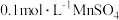 溶液,用
溶液,用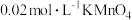 标准溶液滴定至终点。平行三次,所得实验数据如下表所示:
标准溶液滴定至终点。平行三次,所得实验数据如下表所示:| 试验次数 | 一 | 二 | 三 |
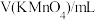 | 23.02 | 23.05 | 23.04 |
 溶液的作用是
溶液的作用是②滴定过程中加入标准溶液发生反应的离子方程式为
您最近一年使用:0次
名校
8 . 一水硫酸四氨合铜(化学式为[Cu(NH3)4]SO4·H2O)是一种深蓝色晶体。重庆南开中学化学兴趣小组在实验室以废铜(Cu)为主要原料制备该物质,并测定其中铜元素的含量,设计的制备路线为:

(1).步骤1中发生反应的化学方程式为:___________ 。
(2).步骤3中发生反应的离子方程式为:___________ ,能观察到的现象是___________ 。
(3).方案1的实验步骤为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。但该方案存在明显缺陷,因为得到的产物晶体中往往含有___________ 杂质,产生该杂质的原因是___________ 。
(4).方案2的实验步骤为:向溶液C加入适量极性较小的溶剂X、过滤、洗涤、干燥。X的名称为___________ ,作用是___________ 。
(5).测定晶体中铜元素含量的步骤如下:称取产物晶体wg,用适量稀HNO3溶解后配成100.00mL溶液D,取25.00mL溶液D,调节pH4~5,用浓度为cmol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,记录消耗的标准溶液体积vmL。
则晶体中铜元素的质量分数为___________ %,若盛装标准溶液的滴定管未润洗,会导致铜的质量分数___________ (填“偏低”、“偏高”或“不变”)。

(1).步骤1中发生反应的化学方程式为:
(2).步骤3中发生反应的离子方程式为:
(3).方案1的实验步骤为:蒸发浓缩、冷却结晶、过滤、洗涤、干燥。但该方案存在明显缺陷,因为得到的产物晶体中往往含有
(4).方案2的实验步骤为:向溶液C加入适量极性较小的溶剂X、过滤、洗涤、干燥。X的名称为
(5).测定晶体中铜元素含量的步骤如下:称取产物晶体wg,用适量稀HNO3溶解后配成100.00mL溶液D,取25.00mL溶液D,调节pH4~5,用浓度为cmol·L-1的EDTA(Na2H2Y·2H2O)标准溶液滴定Cu2+(离子方程式为Cu2++H2Y2-=CuY2-+2H+),滴定至终点,记录消耗的标准溶液体积vmL。
则晶体中铜元素的质量分数为
您最近一年使用:0次
9 . 五氧化二氮(N2O5)是有机合成中常用的绿色硝化剂。N2O5常温下为白色固体,可溶于CH2Cl2等氯代烃溶剂,微溶于水且与水反应生成强酸,高于室温时对热不稳定。
(1)1840年,Devill首次将干燥的氯气通入硝酸银,在试管壁上得到了N2O5。已知反应的氧化产物为空气中的成分之一,写出反应的化学方程式:________________________ 。
(2)某化学兴趣小组设计臭氧(O3)氧化法制备N2O5,反应原理为N2O4+O3=N2O5+O2。实验装置如图:
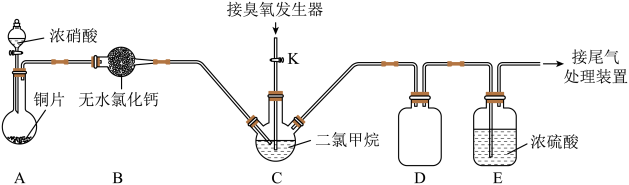
回答下列问题:
①写出装置A中发生反应的离子方程式:________________________ 。
②装置B的作用是________ ;装置E的作用是________________________ 。
③实验时,将三口烧瓶C浸入冰水中,打开装置A中分液漏斗的活塞,一段时间后C中液体变为红棕色。然后打开活塞K,通过臭氧发生器向三口烧瓶中通入含有臭氧的氧气。C中二氯甲烷(CH2Cl2)的作用是________ (填序号)。
A.溶解反应物NO2 B.充分混合反应物使其反应更加充分
C.控制O3的通入速度 D.溶解生成物N2O5
(3)判断C中反应已结束的简单方法是________________________ 。
(4)该兴趣小组用滴定法测定N2O5粗产品中N2O4的含量。取2.0 g粗产品,加入25.00 mL 0.1000 mol/L酸性高锰酸钾溶液。充分反应后,用0.1000 mol/L H2O2溶液滴定剩余的高锰酸钾,达到滴定终点时,消耗H2O2溶液20.00 mL。(已知:H2O2与HNO3不反应且不考虑其分解)
①产品中N2O4与KMnO4发生反应的离子方程式为________________ 。
②产品中N2O4的含量为________ (质量分数,结果保留三位有效数字)。
(1)1840年,Devill首次将干燥的氯气通入硝酸银,在试管壁上得到了N2O5。已知反应的氧化产物为空气中的成分之一,写出反应的化学方程式:
(2)某化学兴趣小组设计臭氧(O3)氧化法制备N2O5,反应原理为N2O4+O3=N2O5+O2。实验装置如图:

回答下列问题:
①写出装置A中发生反应的离子方程式:
②装置B的作用是
③实验时,将三口烧瓶C浸入冰水中,打开装置A中分液漏斗的活塞,一段时间后C中液体变为红棕色。然后打开活塞K,通过臭氧发生器向三口烧瓶中通入含有臭氧的氧气。C中二氯甲烷(CH2Cl2)的作用是
A.溶解反应物NO2 B.充分混合反应物使其反应更加充分
C.控制O3的通入速度 D.溶解生成物N2O5
(3)判断C中反应已结束的简单方法是
(4)该兴趣小组用滴定法测定N2O5粗产品中N2O4的含量。取2.0 g粗产品,加入25.00 mL 0.1000 mol/L酸性高锰酸钾溶液。充分反应后,用0.1000 mol/L H2O2溶液滴定剩余的高锰酸钾,达到滴定终点时,消耗H2O2溶液20.00 mL。(已知:H2O2与HNO3不反应且不考虑其分解)
①产品中N2O4与KMnO4发生反应的离子方程式为
②产品中N2O4的含量为
您最近一年使用:0次
2021-07-20更新
|
478次组卷
|
2卷引用:重庆市西南大学附属中学2020-2021学年高三下学期第六次月考化学试题
10 . 腐殖质是土壤中结构复杂的有机物,土壤肥力与腐殖质含量密切相关。可采用重铬酸钾法测定土壤中腐殖质的含量:称取0.1500 g风干的土样,加入5 mL0. 10 mol·L-1K2Cr2O7的H2SO4溶液,充分加热,氧化其中的碳(C→CO2,腐殖质中含碳58% , 90%的碳可被氧化)。以邻菲罗啉为指示剂,用0.1221 mol·L-1的(NH4)2SO4 ·FeSO4溶液滴定,消耗10.02 mL。空白实验如下:上述土壤样品经高温灼烧后,称取同样质量,采用相同的条件处理和滴定,消耗(NH4)2SO4·FeSO4溶液22.35mL。
(1)写出在酸性介质中K2Cr2O7,将碳氧化为CO2的方程式_____ 。
(1)写出硫酸亚铁铵滴定过程的方程式______ 。
(3)计算土壤中腐殖质的质量分数____ 。
(1)写出在酸性介质中K2Cr2O7,将碳氧化为CO2的方程式
(1)写出硫酸亚铁铵滴定过程的方程式
(3)计算土壤中腐殖质的质量分数
您最近一年使用:0次



