1 . 氯化钴{ ,常温下,
,常温下,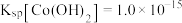 }在仪器制造、陶瓷、分析化学中用途广泛.回答下列问题:
}在仪器制造、陶瓷、分析化学中用途广泛.回答下列问题:
(1)已知钴与铁的化学性质相似.写出单质钴与稀硫酸反应的离子方程式:_________________ ;将 溶液加入坩埚中,然后用酒精喷灯持续加热,最终生成的固体物质是
溶液加入坩埚中,然后用酒精喷灯持续加热,最终生成的固体物质是_________________ (填化学式).
(2)将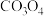 粉末与浓盐酸混合,可生成
粉末与浓盐酸混合,可生成 和一种黄绿色气体,写出该反应的化学方程式:
和一种黄绿色气体,写出该反应的化学方程式:_______________ ;该反应中,每生成 (标准状况下)黄绿色气体,转移电子数为
(标准状况下)黄绿色气体,转移电子数为_____________  .
.
(3)常温下,向 溶液中加入氨水调节
溶液中加入氨水调节 ,可以得到
,可以得到 ,若要使
,若要使 溶液中的
溶液中的 完全沉淀
完全沉淀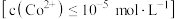 ,控制溶液的
,控制溶液的 最小为
最小为_____________ .
(4)一种从某含钴废料(主要成分为 ,及少量杂质
,及少量杂质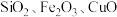 )制备
)制备 的工艺流程如下:
的工艺流程如下:

①滤渣的主要成分_____________ (填化学式).
②“操作a”的名称为_____________ ,所需要的玻璃仪器名称为烧杯、_____________ .
③向有机相加入足量的盐酸分离后,水相中除含有盐酸外,还含有_____________ (填化学式).
 ,常温下,
,常温下,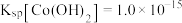 }在仪器制造、陶瓷、分析化学中用途广泛.回答下列问题:
}在仪器制造、陶瓷、分析化学中用途广泛.回答下列问题:(1)已知钴与铁的化学性质相似.写出单质钴与稀硫酸反应的离子方程式:
 溶液加入坩埚中,然后用酒精喷灯持续加热,最终生成的固体物质是
溶液加入坩埚中,然后用酒精喷灯持续加热,最终生成的固体物质是(2)将
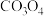 粉末与浓盐酸混合,可生成
粉末与浓盐酸混合,可生成 和一种黄绿色气体,写出该反应的化学方程式:
和一种黄绿色气体,写出该反应的化学方程式: (标准状况下)黄绿色气体,转移电子数为
(标准状况下)黄绿色气体,转移电子数为 .
.(3)常温下,向
 溶液中加入氨水调节
溶液中加入氨水调节 ,可以得到
,可以得到 ,若要使
,若要使 溶液中的
溶液中的 完全沉淀
完全沉淀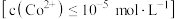 ,控制溶液的
,控制溶液的 最小为
最小为(4)一种从某含钴废料(主要成分为
 ,及少量杂质
,及少量杂质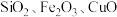 )制备
)制备 的工艺流程如下:
的工艺流程如下:
①滤渣的主要成分
②“操作a”的名称为
③向有机相加入足量的盐酸分离后,水相中除含有盐酸外,还含有
您最近一年使用:0次
名校
2 . 含氯化合物在生产生活中具有重要用途,不同价态的含氯化合物在适当条件下可以相互转化。回答下列问题:
(1)氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺( 、
、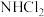 和
和 )等。
)等。
①氯胺作饮用水消毒剂是因为其与水反应生成了具有强烈杀菌作用的物质A。该物质(A)属于________ (填“强酸”或“弱酸”);其中二氯胺与水反应的化学方程式为_________________________________________ 。
②将
 通入足量
通入足量 溶液中,
溶液中, 被氧化为
被氧化为 ,则反应中转移电子的数目为
,则反应中转移电子的数目为________  。
。
(2) 有强氧化性,在强碱性介质中,
有强氧化性,在强碱性介质中, 与
与 反应生成紫红色高铁酸钾(
反应生成紫红色高铁酸钾( )溶液,
)溶液, 是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为
是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为________ 。
(3)把 溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为
溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为________________________________________________ 。
(4)二氧化氯( )气体是高效低毒的消毒剂。
)气体是高效低毒的消毒剂。 的稳定性差,因此常将其制成
的稳定性差,因此常将其制成 固体便于运输和贮存,其制备方法:将
固体便于运输和贮存,其制备方法:将 通入含
通入含 的
的 溶液中。该反应的化学方程式
溶液中。该反应的化学方程式_________________ 。
(1)氯胺是由氯气遇到氨气反应生成的一类化合物,是常用的饮用水二级消毒剂,主要包括一氯胺、二氯胺和三氯胺(
 、
、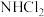 和
和 )等。
)等。①氯胺作饮用水消毒剂是因为其与水反应生成了具有强烈杀菌作用的物质A。该物质(A)属于
②将

 通入足量
通入足量 溶液中,
溶液中, 被氧化为
被氧化为 ,则反应中转移电子的数目为
,则反应中转移电子的数目为 。
。(2)
 有强氧化性,在强碱性介质中,
有强氧化性,在强碱性介质中, 与
与 反应生成紫红色高铁酸钾(
反应生成紫红色高铁酸钾( )溶液,
)溶液, 是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为
是一种优良的水处理剂。在制备反应中,氧化产物与还原产物的物质的量之比为(3)把
 溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为
溶液滴入沸水中,可得到一种红褐色、能发生丁达尔效应的分散系,该过程中发生反应的离子方程式为(4)二氧化氯(
 )气体是高效低毒的消毒剂。
)气体是高效低毒的消毒剂。 的稳定性差,因此常将其制成
的稳定性差,因此常将其制成 固体便于运输和贮存,其制备方法:将
固体便于运输和贮存,其制备方法:将 通入含
通入含 的
的 溶液中。该反应的化学方程式
溶液中。该反应的化学方程式
您最近一年使用:0次
名校
解题方法
3 . 硝酸是用途广泛的重要化工原料,自然乳和化工生产中合成硝酸各物质转化关系如下图所示,请结合你所学的知识回答以下问题:
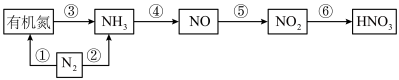
(1)上图①~⑥各步转化中,属于氮的固定的是_______ (填序号);
(2)氨的催化氧化是工业合成硝酸的重要步骤,其化学方程式为_______ 其中氧化剂与还原剂物质的量之比为_______ ;
(3)为提高NO→ 的转化率,可采取的措施是
的转化率,可采取的措施是_______ ;
(4)工业制硝酸时含有NO、 等大气污染物,可用尿素[CO(NH2)2]水溶液吸收氮氧化物,用尿素[CO(NH2)2]水溶液吸收体积比为1∶1的NO和
等大气污染物,可用尿素[CO(NH2)2]水溶液吸收氮氧化物,用尿素[CO(NH2)2]水溶液吸收体积比为1∶1的NO和 混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为_______ ;

(1)上图①~⑥各步转化中,属于氮的固定的是
(2)氨的催化氧化是工业合成硝酸的重要步骤,其化学方程式为
(3)为提高NO→
 的转化率,可采取的措施是
的转化率,可采取的措施是(4)工业制硝酸时含有NO、
 等大气污染物,可用尿素[CO(NH2)2]水溶液吸收氮氧化物,用尿素[CO(NH2)2]水溶液吸收体积比为1∶1的NO和
等大气污染物,可用尿素[CO(NH2)2]水溶液吸收氮氧化物,用尿素[CO(NH2)2]水溶液吸收体积比为1∶1的NO和 混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
混合气,可将N元素转变为对环境无害的气体。该反应的化学方程式为
您最近一年使用:0次
4 . 单一盐R仅由Fe、N、O三种元素组成,某化学兴趣小组称取4.84 g盐R进行相关实验,数据和现象如下:
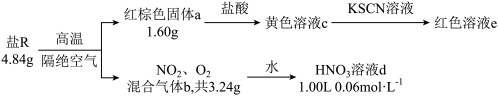
已知:①红棕色固体a为纯净物;
②混合气体b通入足量的水中,完全反应后,仅得到一种生成物;
③不考虑反应过程中的质量损失;
④ 遇KSCN溶液显血红色。
遇KSCN溶液显血红色。
回答下列问题:
(1)红棕色固体a为___________ (填化学式),其在生活中的用途有___________ (填一种即可)。
(2)盐R中Fe元素的化合价为___________ 价。
(3)写出盐R在上述条件下发生反应的化学方程式:___________ ,该反应中氧化产物与还原产物的总物质的量之比为___________ 。
(4)写出上述混合气体b通入水中发生反应的离子方程式:___________ 。
(5)研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铜加入上述所得的稀释后的溶液d中(假设溶液d很稀),恰好完全反应,无气体放出,则消耗铜的质量为___________ g。

已知:①红棕色固体a为纯净物;
②混合气体b通入足量的水中,完全反应后,仅得到一种生成物;
③不考虑反应过程中的质量损失;
④
 遇KSCN溶液显血红色。
遇KSCN溶液显血红色。回答下列问题:
(1)红棕色固体a为
(2)盐R中Fe元素的化合价为
(3)写出盐R在上述条件下发生反应的化学方程式:
(4)写出上述混合气体b通入水中发生反应的离子方程式:
(5)研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铜加入上述所得的稀释后的溶液d中(假设溶液d很稀),恰好完全反应,无气体放出,则消耗铜的质量为
您最近一年使用:0次
2023-04-18更新
|
252次组卷
|
6卷引用:陕西省西安市第八十三中学2022-2023学年高一下学期中考试化学试题
解题方法
5 . 二氧化氯( )是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:
)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:
(1) 的制备:制备
的制备:制备 的常用方法有两种,分别为Kestiog法、
的常用方法有两种,分别为Kestiog法、 与
与 反应法。
反应法。
①Kestiog法制备 的原理为
的原理为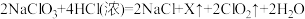 ,X的化学式为
,X的化学式为_______ ,将 通入
通入 溶液中,有红褐色沉淀生成,溶液中的主要阴离子为
溶液中,有红褐色沉淀生成,溶液中的主要阴离子为 、
、 ,若消耗
,若消耗 ,则被氧化的
,则被氧化的 为
为_______ mol。
② 与
与 反应法制备
反应法制备 ,生成物只有两种,参加反应的
,生成物只有两种,参加反应的 与
与 物质的量之比为
物质的量之比为_______ ,与Kestiog法相比, 与
与 反应法的优点是
反应法的优点是_______ (填一条)。
(2) 的用途:除毒、除异味。
的用途:除毒、除异味。
① 可以将剧毒的氰化物氧化成
可以将剧毒的氰化物氧化成 和
和 ,离子方程式为
,离子方程式为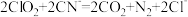 ,
, 属于
属于_______ (填“酸”“碱”或“两”)性氧化物,每转移 ,生成
,生成_______ L(标准状况下) 。
。
② 能把水溶液中有异味的
能把水溶液中有异味的 氧化成四价锰,使之形成不溶于水的
氧化成四价锰,使之形成不溶于水的 ,该反应的离子方程式为
,该反应的离子方程式为_______ 。
(3) 溶液浓度的测定:
溶液浓度的测定:
步骤1:取待测 溶液20.00mL于锥形瓶中;
溶液20.00mL于锥形瓶中;
步骤2:用稀 调节该溶液的pH,加入足量的KI,使
调节该溶液的pH,加入足量的KI,使 充分转化为
充分转化为 ;
;
 ;
;
步骤3:滴入几滴指示剂,逐滴加入0.1000mol/L的 溶液(
溶液( ),达到滴定终点时,消耗
),达到滴定终点时,消耗 溶液的体积为29.50mL。
溶液的体积为29.50mL。
 溶液物质的量浓度为
溶液物质的量浓度为_______ mol/L。
 )是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:
)是一种黄绿色到橙黄色的气体,是国际上公认的安全、无毒的绿色消毒剂。回答下列问题:(1)
 的制备:制备
的制备:制备 的常用方法有两种,分别为Kestiog法、
的常用方法有两种,分别为Kestiog法、 与
与 反应法。
反应法。①Kestiog法制备
 的原理为
的原理为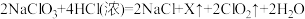 ,X的化学式为
,X的化学式为 通入
通入 溶液中,有红褐色沉淀生成,溶液中的主要阴离子为
溶液中,有红褐色沉淀生成,溶液中的主要阴离子为 、
、 ,若消耗
,若消耗 ,则被氧化的
,则被氧化的 为
为②
 与
与 反应法制备
反应法制备 ,生成物只有两种,参加反应的
,生成物只有两种,参加反应的 与
与 物质的量之比为
物质的量之比为 与
与 反应法的优点是
反应法的优点是(2)
 的用途:除毒、除异味。
的用途:除毒、除异味。①
 可以将剧毒的氰化物氧化成
可以将剧毒的氰化物氧化成 和
和 ,离子方程式为
,离子方程式为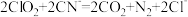 ,
, 属于
属于 ,生成
,生成 。
。②
 能把水溶液中有异味的
能把水溶液中有异味的 氧化成四价锰,使之形成不溶于水的
氧化成四价锰,使之形成不溶于水的 ,该反应的离子方程式为
,该反应的离子方程式为(3)
 溶液浓度的测定:
溶液浓度的测定:步骤1:取待测
 溶液20.00mL于锥形瓶中;
溶液20.00mL于锥形瓶中;步骤2:用稀
 调节该溶液的pH,加入足量的KI,使
调节该溶液的pH,加入足量的KI,使 充分转化为
充分转化为 ;
;
 ;
;步骤3:滴入几滴指示剂,逐滴加入0.1000mol/L的
 溶液(
溶液( ),达到滴定终点时,消耗
),达到滴定终点时,消耗 溶液的体积为29.50mL。
溶液的体积为29.50mL。 溶液物质的量浓度为
溶液物质的量浓度为
您最近一年使用:0次
6 . 亚硝酸钠(NaNO2)是一种用途广泛的工业盐,因其外观和食盐相似容易误食中毒。亚硝酸钠加热到320℃以上会分解产生Na2O、N2和O2,其水溶液呈碱性,能与AgNO3溶液反应生成难溶于水、易溶于酸的AgNO2。由于NaNO2有毒性,将含该物质的废水直接排放会引起水体严重污染,所以这种废水必须处理后才能排放。
(1)从物质分类角度来看,NaNO2是_______ (填字母代号)。
a.酸 b.碱 c.盐 d.氧化物 e.非电解质 f.电解质
(2)下列方法能用来区分固体NaNO2和NaCl的是_______(填序号)。
(3)误食NaNO2会导致人体血红蛋白中的Fe2+转化为Fe3+而中毒,该过程中NaNO2表现出的性质与下列_______(填序号)反应中H2O2表现出的性质相同。
(4)小铭通过查阅资料,可用NO制备NaNO2:2NO+Na2O2=2NaNO2.实验室制备NO的反应为:3Cu + 8HNO3=3Cu(NO3)2 + 2NO↑ + 4H2O,该反应中氧化剂是_______ ,氧化产物是_______ ;若有3.0g NO生成,有_______ mol HNO3被还原。
(1)从物质分类角度来看,NaNO2是
a.酸 b.碱 c.盐 d.氧化物 e.非电解质 f.电解质
(2)下列方法能用来区分固体NaNO2和NaCl的是_______(填序号)。
| A.分别溶于水 |
| B.分别溶于水并滴加HNO3酸化的AgNO3溶液 |
| C.分别加强热并收集气体检验 |
| D.用筷子分别蘸取固体品尝味道 |
A. |
B. |
C.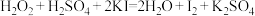 |
D. |
您最近一年使用:0次
名校
解题方法
7 . 四氧化三铁( )磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备
)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备 磁性纳米颗粒的反应是
磁性纳米颗粒的反应是
 。下列叙述不正确的是
。下列叙述不正确的是
 )磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备
)磁性纳米颗粒稳定、容易生产且用途广泛,是临床诊断、生物技术和环境化学领域多种潜在应用的有力工具。水热法制备 磁性纳米颗粒的反应是
磁性纳米颗粒的反应是
 。下列叙述不正确的是
。下列叙述不正确的是A.水热法制备 磁性纳米颗粒的反应中,还原剂是 磁性纳米颗粒的反应中,还原剂是 |
B.离子方程式中 |
C.每生成 ,被氧化的 ,被氧化的 的物质的量为 的物质的量为 |
D.该条件下 氧化性强于 氧化性强于 |
您最近一年使用:0次
2022-04-06更新
|
1678次组卷
|
7卷引用:陕西省安康市2022-2023学年高二上学期11月期中化学试题
解题方法
8 . 钒及其化合物在工业上有许多用途。从废钒(主要成分V2O3、V2O5、Fe2O3、FeO、SiO2)中提取五氧化二钒的一种工艺流程如图。

已知:①VOSO4能溶于水,VO2+与Fe不能反应。
②有机溶剂H2R对VO2+及Fe3+萃取率高,但不能萃取Fe2+。
回答下列问题:
(1)“酸浸、氧化”过程中若用浓盐酸代替硫酸,V2O5转化为VO2+,同时生成有毒的一种气体,反应的化学方程式为_______ 。同时该步骤中V2O3转化为VO2+,反应的离子方程式为_______ 。
(2)萃取前用“铁粉”对酸浸后的浸出液进行处理,主要目的是_______ ,为检验处理后的浸出液中是否含有该杂质离子,可选用的化学试剂是_______ (填试剂名称)。
(3)“溶剂萃取与反萃取”可表示为:VO2++H2R VOR+2H+。为了提高VO2+的产率,反萃取剂可选用
VOR+2H+。为了提高VO2+的产率,反萃取剂可选用_______ 。(供选物质:NaCl,NaOH,H2SO4,填写相应物质的化学式)
(4)反萃取后的水层中加KClO3,使VO2+变为VO ,ClO
,ClO 变为Cl-。当反应1.5molVO2+时,至少需要KClO3的物质的量为
变为Cl-。当反应1.5molVO2+时,至少需要KClO3的物质的量为_______ mol。
(5)已知NH4VO3难溶于水,Ksp=3.0×10-8,向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液忽略混合过程中的体积变化,欲使VO 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为_________ (保留两位有效数字,溶液中某离子浓度≤1×10-6mol·L-1时,认为该离子沉淀完全)

已知:①VOSO4能溶于水,VO2+与Fe不能反应。
②有机溶剂H2R对VO2+及Fe3+萃取率高,但不能萃取Fe2+。
回答下列问题:
(1)“酸浸、氧化”过程中若用浓盐酸代替硫酸,V2O5转化为VO2+,同时生成有毒的一种气体,反应的化学方程式为
(2)萃取前用“铁粉”对酸浸后的浸出液进行处理,主要目的是
(3)“溶剂萃取与反萃取”可表示为:VO2++H2R
 VOR+2H+。为了提高VO2+的产率,反萃取剂可选用
VOR+2H+。为了提高VO2+的产率,反萃取剂可选用(4)反萃取后的水层中加KClO3,使VO2+变为VO
 ,ClO
,ClO 变为Cl-。当反应1.5molVO2+时,至少需要KClO3的物质的量为
变为Cl-。当反应1.5molVO2+时,至少需要KClO3的物质的量为(5)已知NH4VO3难溶于水,Ksp=3.0×10-8,向10mL0.1mol·L-1NaVO3的滤液中加入等体积的NH4Cl溶液忽略混合过程中的体积变化,欲使VO
 沉淀完全,则NH4Cl溶液的最小浓度为
沉淀完全,则NH4Cl溶液的最小浓度为
您最近一年使用:0次
名校
9 . 2020年突如其来的“新冠肺炎”使人们认识到日常杀菌消毒的重要性。其中含氯消毒剂在生产生活中有着广泛的用途。
(1)写出实验室中制取氯气的离子方程式_______ 。
(2)常温下,氯气与烧碱溶液反应得“84”消毒液,NaClO是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用。
①用化学方程式表示“84”消毒液的生成过程:_______ 。工业上用氯气与石灰乳反应制备漂白粉,其有效成分为_______ 。(填化学式)
②居家消毒时,不能将“84”消毒液与洁厕灵(有效成分为盐酸)混合使用,原因是_______ 。
③某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO和 的混合溶液,经测定
的混合溶液,经测定 与
与 的离子个数比为1:3。该反应中,被氧化的Cl与被还原的Cl的质量之比为
的离子个数比为1:3。该反应中,被氧化的Cl与被还原的Cl的质量之比为_______ 。
(3)世界卫生组织将ClO2定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。消毒效率是用单位质量的消毒剂得电子数来表示的,ClO2作消毒剂时和氯气一样,还原产物均为 ,ClO2的消毒效率是氯气的
,ClO2的消毒效率是氯气的_______ 倍(保留两位小数)。
(1)写出实验室中制取氯气的离子方程式
(2)常温下,氯气与烧碱溶液反应得“84”消毒液,NaClO是“84”消毒液的有效成分,在此次抗击新冠病毒中发挥了重要作用。
①用化学方程式表示“84”消毒液的生成过程:
②居家消毒时,不能将“84”消毒液与洁厕灵(有效成分为盐酸)混合使用,原因是
③某温度下,将氯气通入NaOH溶液中,得到NaCl、NaClO和
 的混合溶液,经测定
的混合溶液,经测定 与
与 的离子个数比为1:3。该反应中,被氧化的Cl与被还原的Cl的质量之比为
的离子个数比为1:3。该反应中,被氧化的Cl与被还原的Cl的质量之比为(3)世界卫生组织将ClO2定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。消毒效率是用单位质量的消毒剂得电子数来表示的,ClO2作消毒剂时和氯气一样,还原产物均为
 ,ClO2的消毒效率是氯气的
,ClO2的消毒效率是氯气的
您最近一年使用:0次
10 . 某化工厂从废旧锂电池正极材料(主要成分为LiCoO2、炭黑及铝片)中回收锂、铝、钴的流程如图所示。

(1)“料渣1”的主要用途有____ (填一种即可)。
(2)“酸浸还原”,LiCoO2(难溶于水))在Na2SO3的作用下转化为Li2SO4和CoSO4,写出该反应的离子方程式____ 。
(3)“料渣2”经过加热分解、电解可制得Al,写出电解制铝的化学方程式____ ;电解过程中阳极(电极为碳)要不断补充碳块的理由___ (用必要的电极反应式和化学方程式说明)。
(4)萃取剂选择磷酸二异辛酯,是因为其具有两种物理性质:____ ;____ 。
(5)取一定质量的CoC2O4·2H2O分解后的钴氧化物(其中Co的化合价为+2、+3价),用200mL12mol·L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。写出+3价钴氧化物与该盐酸反应的化学方程式____ ,通过计算确定该钴氧化物中Co与O的物质的量之比为____ 。

(1)“料渣1”的主要用途有
(2)“酸浸还原”,LiCoO2(难溶于水))在Na2SO3的作用下转化为Li2SO4和CoSO4,写出该反应的离子方程式
(3)“料渣2”经过加热分解、电解可制得Al,写出电解制铝的化学方程式
(4)萃取剂选择磷酸二异辛酯,是因为其具有两种物理性质:
(5)取一定质量的CoC2O4·2H2O分解后的钴氧化物(其中Co的化合价为+2、+3价),用200mL12mol·L-1盐酸恰好完全溶解固体,得到CoCl2溶液和4.48L(标准状况)黄绿色气体。写出+3价钴氧化物与该盐酸反应的化学方程式
您最近一年使用:0次



