1 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
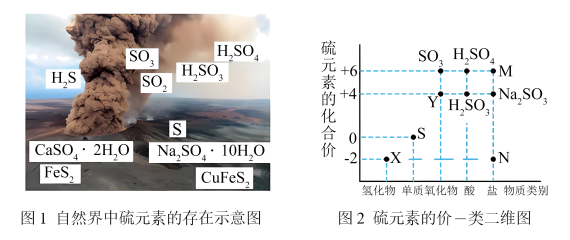
(1)图1中与图2中M、N对应的物质分别是
(2)X与Y反应中氧化剂与还原剂的物质的量之比为
(3)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是(4)已知
 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与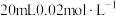 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:(5)过二硫酸钠
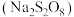 有强氧化性,在碱性条件下
有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为(6)雌黄
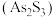 和雄黄
和雄黄 在自然界中共生且可以相互转化(两者的硫元素价态均为-2价)。
在自然界中共生且可以相互转化(两者的硫元素价态均为-2价)。① 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为
② 和
和 可以相互转化,转化过程中存在如图所示的步骤。若
可以相互转化,转化过程中存在如图所示的步骤。若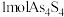 参加反应时,转移
参加反应时,转移 电子,则物质
电子,则物质 为
为
您最近一年使用:0次
2 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。
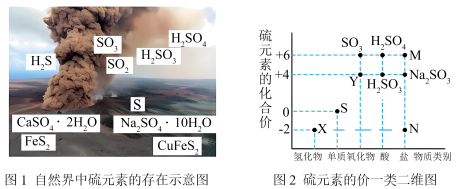
(1)图1中与图2中M、N对应的物质分别是___________ 、___________ 。
(2) 与
与 反应中氧化剂与还原剂的物质的量之比为
反应中氧化剂与还原剂的物质的量之比为___________ 。
(3) 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是___________ 。
(4)已知 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与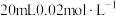 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:___________ 。
(5) 的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:

请回答下列问题:
①反应b的化学方程式为:___________ 。
②在一段时间内连续不断测定溶液 的
的 ,发现
,发现 变小,表示该变化的化学方程式是:
变小,表示该变化的化学方程式是:___________ 。
③若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式:___________ 。
(6)过二硫酸钠( )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成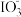 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为___________ 。
(7)雌黄( )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。
① 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为___________ 。
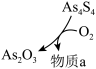
② 和
和 可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移
可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移 电子,则物质
电子,则物质 为
为___________ ,消耗氧气___________  。
。

(1)图1中与图2中M、N对应的物质分别是
(2)
 与
与 反应中氧化剂与还原剂的物质的量之比为
反应中氧化剂与还原剂的物质的量之比为(3)
 溶液易变质,实验室检验
溶液易变质,实验室检验 溶液是否变质的基本操作是
溶液是否变质的基本操作是(4)已知
 能被酸性
能被酸性 氧化为
氧化为 ,则
,则 的
的 溶液与
溶液与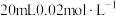 的
的 溶液恰好反应时,发生的离子方程式为:
溶液恰好反应时,发生的离子方程式为:(5)
 的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
的排放是造成酸雨的主要因素。形成酸雨的原理之一可简单表示如下:
请回答下列问题:
①反应b的化学方程式为:
②在一段时间内连续不断测定溶液
 的
的 ,发现
,发现 变小,表示该变化的化学方程式是:
变小,表示该变化的化学方程式是:③若用足量的氢氧化钠溶液吸收含二氧化硫的工业废气,写出该反应的离子方程式:
(6)过二硫酸钠(
 )有强氧化性,在碱性条件下
)有强氧化性,在碱性条件下 溶液能将
溶液能将 氧化成
氧化成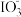 ,且反应后的溶液滴入
,且反应后的溶液滴入 溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为
溶液生成不溶于稀盐酸的白色沉淀,该反应的离子方程式为(7)雌黄(
 )和雄黄(
)和雄黄( )在自然界中共生且可以相互转化(两者的硫元素价态均为
)在自然界中共生且可以相互转化(两者的硫元素价态均为 价)。
价)。①
 和
和 在盐酸中恰好完全反应转化为
在盐酸中恰好完全反应转化为 和
和 并放出
并放出 气体。则参加反应的
气体。则参加反应的 和
和 的物质的量之比为
的物质的量之比为②
 和
和 可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移
可以相互转化,转化过程中存在如图所示的步骤。若1molAs4S4参加反应时,转移 电子,则物质
电子,则物质 为
为 。
。
您最近一年使用:0次
名校
解题方法
3 . 铜和三氧化二铁在工农业生产中用途广泛,用黄铜矿(主要成分为CuFeS2,其中Cu为+2价、Fe为+2价)制取铜和三氧化二铁的工艺流程如图所示

(1)将黄铜矿粉碎的目的是___________ 。
(2)高温焙烧时发生的反应是CuFeS2+O2 SO2+FeS+Cu,该反应中,还原产物是
SO2+FeS+Cu,该反应中,还原产物是___________ ;1molO2参加反应时,反应中转移电子___________ mol。
(3)滤液A中含有FeCl2,向滤液A通入Cl2的离子方程式为___________ 。
(4)向溶液B中通入NH3后发生反应的离子方程式为___________ 。
(5)操作b后检验滤渣已经洗涤干净的实验操作为___________ 。
(6)工业上用生物法处理H2S的原理为(硫杆菌有较强的活性作催化剂):H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O,由图甲和图乙判断使用硫杆菌的最佳条件为___________ ,若反应温度过高,反应速率下降,其原因是___________ 。


(1)将黄铜矿粉碎的目的是
(2)高温焙烧时发生的反应是CuFeS2+O2
 SO2+FeS+Cu,该反应中,还原产物是
SO2+FeS+Cu,该反应中,还原产物是(3)滤液A中含有FeCl2,向滤液A通入Cl2的离子方程式为
(4)向溶液B中通入NH3后发生反应的离子方程式为
(5)操作b后检验滤渣已经洗涤干净的实验操作为
(6)工业上用生物法处理H2S的原理为(硫杆菌有较强的活性作催化剂):H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4;4FeSO4+O2+2H2SO4=2Fe2(SO4)3+2H2O,由图甲和图乙判断使用硫杆菌的最佳条件为

您最近一年使用:0次
名校
4 . Ⅰ.现有下列七种物质:①CO2②过氧化钠③氧化铁 ④ 溶液 ⑤碳酸氢钠⑥
溶液 ⑤碳酸氢钠⑥ 溶液⑦次氯酸钠。请根据上述物质回答下列问题:
溶液⑦次氯酸钠。请根据上述物质回答下列问题:
(1)在上述物质中属于电解质的有_______ (填①~⑦序号)。
(2)含有0.4mol氧原子的②与足量①反应,产生气体在标准状况下的体积为_______ L。
(3)写出⑤物质的一种用途_______ 。
(4)某同学帮助水质检测站配制240mL④溶液以备使用。
①该同学应用托盘天平称取NaOH固体_______ g。
②配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、_______ 。
③定容时仰视刻度线,则所配制的溶液的浓度会_______ (填“偏高”、“偏低”、“不变”)。
(5)⑤⑥两种溶液混合可以发生反应,离子方程式为_______ 。
(6)废水脱氮工艺有一种方法是在废水中加入过量⑦使 完全转化为N2,此方法可用离子方程式表示为:
完全转化为N2,此方法可用离子方程式表示为: 。用双线桥法在离子方程式上标出电子转移的方向和数目
。用双线桥法在离子方程式上标出电子转移的方向和数目_______ ;该反应中氧化剂与还原剂的物质的量之比为_______ 。
Ⅱ.神舟十三号载人飞船的成功发射离不开化学燃料。火箭分级推进所使用的燃料中含有的氧化剂主要有液氧、 和高氯酸铵
和高氯酸铵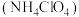 。
。
(7)写出高氯酸铵在水中的电离方程式:_______ 。
(8)载人飞船中的呼吸面具供氧剂为Na2O2,其阴、阳离子的个数比为_______ ,写出Na2O2与二氧化碳反应的化学方程式:_______ 。
 溶液 ⑤碳酸氢钠⑥
溶液 ⑤碳酸氢钠⑥ 溶液⑦次氯酸钠。请根据上述物质回答下列问题:
溶液⑦次氯酸钠。请根据上述物质回答下列问题:(1)在上述物质中属于电解质的有
(2)含有0.4mol氧原子的②与足量①反应,产生气体在标准状况下的体积为
(3)写出⑤物质的一种用途
(4)某同学帮助水质检测站配制240mL④溶液以备使用。
①该同学应用托盘天平称取NaOH固体
②配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、胶头滴管、
③定容时仰视刻度线,则所配制的溶液的浓度会
(5)⑤⑥两种溶液混合可以发生反应,离子方程式为
(6)废水脱氮工艺有一种方法是在废水中加入过量⑦使
 完全转化为N2,此方法可用离子方程式表示为:
完全转化为N2,此方法可用离子方程式表示为: 。用双线桥法在离子方程式上标出电子转移的方向和数目
。用双线桥法在离子方程式上标出电子转移的方向和数目Ⅱ.神舟十三号载人飞船的成功发射离不开化学燃料。火箭分级推进所使用的燃料中含有的氧化剂主要有液氧、
 和高氯酸铵
和高氯酸铵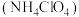 。
。(7)写出高氯酸铵在水中的电离方程式:
(8)载人飞船中的呼吸面具供氧剂为Na2O2,其阴、阳离子的个数比为
您最近一年使用:0次
5 . 氯的化合物在生活中有着广泛的用途。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生 和少量的
和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为
转化为 除去。
除去。
①关于二氧化氯的说法不正确 的是______ 。
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去 的离子方程式为
的离子方程式为______ 。
(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为: (未配平)。
(未配平)。
①ClO2的氧化性______ H2O2的氧化性(填“大于”或“小于”)。
②当消耗标准状况下2.24 L ClO2时,生成O2的质量为___________ 。
(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收SO2的过程如下图。

①该过程的总反应的离子方程式是___________ 。
②整个吸收SO2过程中作氧化剂的微粒有___________ 。
(1)二氧化氯(ClO2)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生
 和少量的
和少量的 ,可利用酸性FeSO4溶液将
,可利用酸性FeSO4溶液将 转化为
转化为 除去。
除去。①关于二氧化氯的说法
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②FeSO4除去
 的离子方程式为
的离子方程式为(2)亚氯酸钠(NaClO2)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:
 (未配平)。
(未配平)。①ClO2的氧化性
②当消耗标准状况下2.24 L ClO2时,生成O2的质量为
(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收SO2的过程如下图。

①该过程的总反应的离子方程式是
②整个吸收SO2过程中作氧化剂的微粒有
您最近一年使用:0次
名校
6 .  是环境污染物。
是环境污染物。
(1)消除 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为_______ 。
(2)以氨气为原料脱硝除去 。
。
①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知: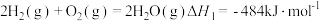
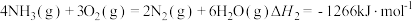
则 的
的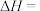
_______  。
。
②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为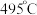 时,
时, 的温度为
的温度为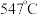 ,而
,而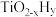 的温度为
的温度为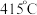 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是_______ 。 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。_______ 。(用化学式表示)
②若参加反应的丙烯与 物质的量之比为
物质的量之比为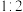 ,则反应的化学方程式为
,则反应的化学方程式为_______ 。
(4)以 为原料脱硝除去
为原料脱硝除去 。
。
烟气中的 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的 (羟基自由基),
(羟基自由基), 能将
能将 快速氧化为
快速氧化为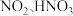 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示:_______ 。
②化学式为 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为_______ 。
 是环境污染物。
是环境污染物。(1)消除
 转化为游离态的氮。氮元素的单质有
转化为游离态的氮。氮元素的单质有 。
。 分子有多种结构,一种
分子有多种结构,一种 分子中4个氮原子在同一平面上,
分子中4个氮原子在同一平面上, 的结构式为
的结构式为(2)以氨气为原料脱硝除去
 。
。①合成氨是人类科学技术上的一项重大突破,氨的用途广泛。
已知:
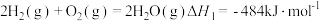
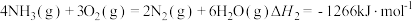
则
 的
的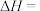
 。
。②近期我国科学家为了解决合成氨反应速率和平衡产率的矛盾,选择使用
 双催化剂,通过光辐射产生温差(如体系温度为
双催化剂,通过光辐射产生温差(如体系温度为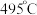 时,
时, 的温度为
的温度为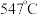 ,而
,而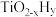 的温度为
的温度为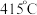 )。结合图1示解释该双催化剂的工作原理是
)。结合图1示解释该双催化剂的工作原理是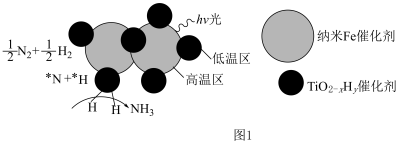
 。研究表明催化剂添加助剂后催化活性提高的原因是形成活性
。研究表明催化剂添加助剂后催化活性提高的原因是形成活性 参与反应,图2为丙烯脱硝机理。
参与反应,图2为丙烯脱硝机理。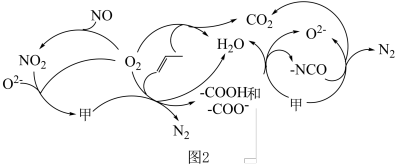
②若参加反应的丙烯与
 物质的量之比为
物质的量之比为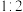 ,则反应的化学方程式为
,则反应的化学方程式为(4)以
 为原料脱硝除去
为原料脱硝除去 。
。烟气中的
 与
与 反应缓慢。雾化后的
反应缓慢。雾化后的 在催化剂中
在催化剂中 元素作用下可以产生具有极强氧化活性的
元素作用下可以产生具有极强氧化活性的 (羟基自由基),
(羟基自由基), 能将
能将 快速氧化为
快速氧化为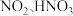 等物质。
等物质。  在一种固体催化剂表面转化的过程如图3所示:
在一种固体催化剂表面转化的过程如图3所示: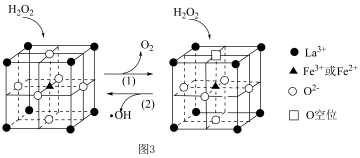
②化学式为
 的催化剂中,
的催化剂中, 和
和 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
7 . 卤族元素的化合物在生活、医药、化工中有着重要的用途。
Ⅰ.过氧化氢氧化法制备碘酸钾(KIO3)的方法如图:
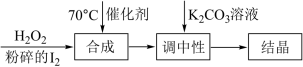
(1)合成步骤的加热方法为______ ,发生反应的化学方程式为____________________ 。
(2)当合成温度高于70℃,碘酸钾产率会降低,写出可能的两种原因:____________________ 。
Ⅱ.ClO2和Cl2都可以用于自来水消毒杀菌,可以通过下列方法制取: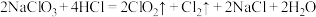
(3)该反应的氧化产物为______ ,若反应过程中有4 mol HCl参与反应,则电子转移的数目为______ 。
Ⅲ.目前从海水中提溴(Br2)大致有“浓缩”、“氧化”、“提取”等步骤。
(4)向浓缩的海水中通入Cl2,将海水中的 氧化为Br2,再用热空气将Br2从溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2,吸收反应的离子方程式为
氧化为Br2,再用热空气将Br2从溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2,吸收反应的离子方程式为____________________ 。
Ⅰ.过氧化氢氧化法制备碘酸钾(KIO3)的方法如图:

(1)合成步骤的加热方法为
(2)当合成温度高于70℃,碘酸钾产率会降低,写出可能的两种原因:
Ⅱ.ClO2和Cl2都可以用于自来水消毒杀菌,可以通过下列方法制取:
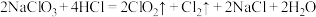
(3)该反应的氧化产物为
Ⅲ.目前从海水中提溴(Br2)大致有“浓缩”、“氧化”、“提取”等步骤。
(4)向浓缩的海水中通入Cl2,将海水中的
 氧化为Br2,再用热空气将Br2从溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2,吸收反应的离子方程式为
氧化为Br2,再用热空气将Br2从溶液中吹出,并由浓Na2CO3溶液吸收,转变为NaBr、NaBrO3和CO2,吸收反应的离子方程式为
您最近一年使用:0次
8 . K2FeO4为紫色固体,易溶于水,微溶于KOH溶液,不溶于乙醇;具有强氧化性,在0℃~5℃的强碱性溶液中较稳定,在酸性或中性溶液中快速产生O2。
(1)高铁酸钾(K2FeO4,M=198g/mol)是一种高效多功能的绿色消毒剂,用途广泛。在用高铁酸钾(K2FeO4)进行水处理时,发生反应的化学方程式为4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2↑。
①K2FeO4属于_______ (填“酸”、“碱”或“盐”)。
②现取49.5g某高铁酸钾样品完全发生上述反应,生成标准状况下3.36LO2,则反应中转移了_______ mole-,该高铁酸钾样品的纯度为_______ 。(用质量分数表示)
③高铁酸钾可用于消毒的原因是_______ 。
K2FeO4的制备常用两种方法:
I.湿法制备K2FeO4(夹持装置略)

(2)下列试剂中,装置B的X溶液可以选用的_______(填字母)。
(3)C中Cl2与Fe(OH)3及KOH发生反应的化学方程式是_______ 。
II.干法制备高铁酸钾分两步进行。
(4)第一步反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2SO4+2Na2O+O2,第二步反应为:Na2FeO4+2KCl=K2FeO4↓+2NaCl。其中第一步该反应中还原剂是_______ ;
(1)高铁酸钾(K2FeO4,M=198g/mol)是一种高效多功能的绿色消毒剂,用途广泛。在用高铁酸钾(K2FeO4)进行水处理时,发生反应的化学方程式为4K2FeO4+10H2O=4Fe(OH)3(胶体)+8KOH+3O2↑。
①K2FeO4属于
②现取49.5g某高铁酸钾样品完全发生上述反应,生成标准状况下3.36LO2,则反应中转移了
③高铁酸钾可用于消毒的原因是
K2FeO4的制备常用两种方法:
I.湿法制备K2FeO4(夹持装置略)

(2)下列试剂中,装置B的X溶液可以选用的_______(填字母)。
| A.饱和食盐水 | B.浓盐酸 | C.氢氧化钠溶液 | D.饱和NaHCO3溶液 |
(3)C中Cl2与Fe(OH)3及KOH发生反应的化学方程式是
II.干法制备高铁酸钾分两步进行。
(4)第一步反应为:2FeSO4+6Na2O2=2Na2FeO4+2Na2SO4+2Na2O+O2,第二步反应为:Na2FeO4+2KCl=K2FeO4↓+2NaCl。其中第一步该反应中还原剂是
您最近一年使用:0次
9 . 铁红(Fe2O3)是一种用途广泛的颜料,用某烧渣(主要成分为 ,含少量
,含少量 )制备铁红的流程如下:
)制备铁红的流程如下:
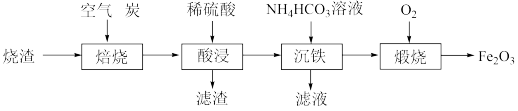
(1)“焙烧”时,CO将 还原为FeO。该过程中参加反应的还原剂与氧化剂的物质的量之比是
还原为FeO。该过程中参加反应的还原剂与氧化剂的物质的量之比是_______ 。
(2)“酸浸”时,生成 的离子方程式为
的离子方程式为_______ 。
(3)“沉铁”时,除了生成 白色沉淀,还生成一种气体,该气体为
白色沉淀,还生成一种气体,该气体为_______ 。(填化学式)
(4)“煅烧”时,在一定温度下加热颗粒状 。一段时间后所得产物有两种成分,其中外层产物为
。一段时间后所得产物有两种成分,其中外层产物为 ,内层产物为
,内层产物为 。从受热的温度和接触的气体分析,产生该现象的可能原因是
。从受热的温度和接触的气体分析,产生该现象的可能原因是_______ 。
(5)产品中 的质量分数测定:称取已干燥的产品1.000g,将其置于500mL锥形瓶中,加入适量的盐酸并加热使其完全反应,然后滴加足量的
的质量分数测定:称取已干燥的产品1.000g,将其置于500mL锥形瓶中,加入适量的盐酸并加热使其完全反应,然后滴加足量的 溶液,发生反应
溶液,发生反应 ,充分反应后,除去其中过量
,充分反应后,除去其中过量 ;再向锥形瓶中逐滴加入0.1000mol·L
;再向锥形瓶中逐滴加入0.1000mol·L
 溶液,发生反应
溶液,发生反应 ,恰好完全反应时消耗
,恰好完全反应时消耗 溶液18.75mL。计算产品中
溶液18.75mL。计算产品中 的质量分数
的质量分数_______ 。(写出计算过程)
 ,含少量
,含少量 )制备铁红的流程如下:
)制备铁红的流程如下:
(1)“焙烧”时,CO将
 还原为FeO。该过程中参加反应的还原剂与氧化剂的物质的量之比是
还原为FeO。该过程中参加反应的还原剂与氧化剂的物质的量之比是(2)“酸浸”时,生成
 的离子方程式为
的离子方程式为(3)“沉铁”时,除了生成
 白色沉淀,还生成一种气体,该气体为
白色沉淀,还生成一种气体,该气体为(4)“煅烧”时,在一定温度下加热颗粒状
 。一段时间后所得产物有两种成分,其中外层产物为
。一段时间后所得产物有两种成分,其中外层产物为 ,内层产物为
,内层产物为 。从受热的温度和接触的气体分析,产生该现象的可能原因是
。从受热的温度和接触的气体分析,产生该现象的可能原因是(5)产品中
 的质量分数测定:称取已干燥的产品1.000g,将其置于500mL锥形瓶中,加入适量的盐酸并加热使其完全反应,然后滴加足量的
的质量分数测定:称取已干燥的产品1.000g,将其置于500mL锥形瓶中,加入适量的盐酸并加热使其完全反应,然后滴加足量的 溶液,发生反应
溶液,发生反应 ,充分反应后,除去其中过量
,充分反应后,除去其中过量 ;再向锥形瓶中逐滴加入0.1000mol·L
;再向锥形瓶中逐滴加入0.1000mol·L
 溶液,发生反应
溶液,发生反应 ,恰好完全反应时消耗
,恰好完全反应时消耗 溶液18.75mL。计算产品中
溶液18.75mL。计算产品中 的质量分数
的质量分数
您最近一年使用:0次
名校
10 . 氯的化合物在生活中有着广泛的用途。
(1)二氧化氯( )的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生
)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生 和少量的
和少量的 。
。
①关于二氧化氯的说法不正确的是_______ 。
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②下列试剂中,可将 转化为
转化为 的是
的是_______ (填字母序号)。
a. b.
b. c.
c. d.
d.
(2)亚氯酸钠( )是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:
)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为: (未配平)。
(未配平)。
① 的氧化性
的氧化性______  的氧化性(填“大于”或“小于”)。
的氧化性(填“大于”或“小于”)。
②当消耗 时,生成
时,生成 的质量为
的质量为___________ 。
(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收 的过程如下图。
的过程如下图。

①该过程的总反应的离子方程式是___________ 。
②整个吸收 过程中作氧化剂的微粒有
过程中作氧化剂的微粒有___________ ,催化剂是___________ 。
(1)二氧化氯(
 )的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生
)的熔点-59℃,沸点11℃,易溶于水,是一种常用的饮用水消毒剂,消毒时会产生 和少量的
和少量的 。
。①关于二氧化氯的说法不正确的是
A.易液化 B.实验室可用排水法收集
C.氯的化合价为+4 D.消毒时利用其强还原性
②下列试剂中,可将
 转化为
转化为 的是
的是a.
 b.
b. c.
c. d.
d.
(2)亚氯酸钠(
 )是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为:
)是一种高效的漂白剂和氧化剂,某种制备亚氯酸钠的反应为: (未配平)。
(未配平)。①
 的氧化性
的氧化性 的氧化性(填“大于”或“小于”)。
的氧化性(填“大于”或“小于”)。②当消耗
 时,生成
时,生成 的质量为
的质量为(3)“84”消毒液是一种常用家庭消毒液,其有效成分为NaClO。一种碱性NaClO溶液吸收
 的过程如下图。
的过程如下图。
①该过程的总反应的离子方程式是
②整个吸收
 过程中作氧化剂的微粒有
过程中作氧化剂的微粒有
您最近一年使用:0次



