名校
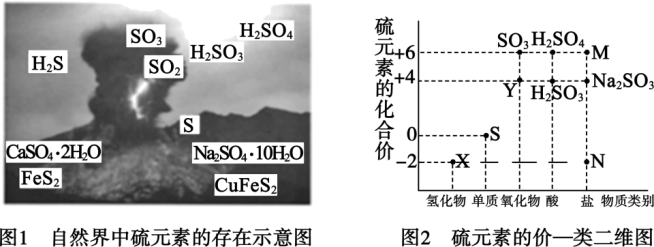
1 . 硫元素是动植物生长不可缺少的元素,图1是自然界中硫元素的存在示意图。图2是硫元素的常见化合价与部分物质类别的对应关系,回答下列问题。_______ 、_______ , _______ 。
(2)X与Y反应中氧化剂与还原剂的物质的量之比为_______ 。
(3)SO2和氯水都有漂白性,有人为增强漂白效果,将Cl2和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:_______ 。
(4)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4
方案乙:由Cu→CuO→CuSO4
①方案甲中,铜和浓硫酸反应的化学方程式是_______ 。该反应体现了浓硫酸的_______ 性。
②这两种方案,你认为哪一种方案更合理?_______ 。理由是_______
(2)X与Y反应中氧化剂与还原剂的物质的量之比为
(3)SO2和氯水都有漂白性,有人为增强漂白效果,将Cl2和SO2混合使用,结果适得其反,几乎没有漂白效果,用离子方程式表示其原因:
(4)硫酸是用途广泛的化工原料,可作脱水剂、吸水剂、氧化剂和催化剂等。甲、乙两位同学用铜和硫酸做原料,设计了两种制取硫酸铜的方案。
方案甲:铜与浓硫酸加热直接反应,即Cu→CuSO4
方案乙:由Cu→CuO→CuSO4
①方案甲中,铜和浓硫酸反应的化学方程式是
②这两种方案,你认为哪一种方案更合理?
您最近一年使用:0次
2022-09-24更新
|
236次组卷
|
2卷引用:山东省济宁市第一中学2023-2024学年高一下学期4月月考化学试题
名校
解题方法
2 . I.元素的“价—类”二维图体现了化学变化之美。部分含硫、氮物质的类别与硫元素和氮元素化合价的对应关系如下图所示。回答下列问题:

(1)实验室用两种固体制备R的化学方程式________ 。
(2)下列有关图中所示含N、S物质的叙述,正确的是________ (填标号)。
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与NaOH溶液反应,都是酸性氧化物
e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
II.已知:①联氨(N2H4)性质与NH3相似,溶于水可生成一种二元弱碱。
②N2H4以还原性为主,氧化产物一般是N2,通常总是把联氨用作强还原剂。
(3)用次氯酸钠和氨气常温制备联氨,化学方程式为:________ 。
(4)根据以上信息,推断下列关于N2H4的说法不正确的是______。
(5)在标准状况下将1.92g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到只由NO2和NO组成的混合气体1.12L,则混合气体中NO的体积为_____。

(1)实验室用两种固体制备R的化学方程式
(2)下列有关图中所示含N、S物质的叙述,正确的是
a.在催化剂的作用下,R可将Y、Z还原为X
b.图中所示的物质中,只有W、D、E属于电解质
c.用玻璃棒分别蘸取浓的R溶液和浓的W溶液,玻璃棒靠近时有白烟产生
d.Z、C、F均能与NaOH溶液反应,都是酸性氧化物
e.制备焦亚硫酸钠(Na2S2O5),从氧化还原反应的角度分析,可选择B和D反应
II.已知:①联氨(N2H4)性质与NH3相似,溶于水可生成一种二元弱碱。
②N2H4以还原性为主,氧化产物一般是N2,通常总是把联氨用作强还原剂。
(3)用次氯酸钠和氨气常温制备联氨,化学方程式为:
(4)根据以上信息,推断下列关于N2H4的说法不正确的是______。
| A.它与E形成的酸式盐可以表示为N2H5HSO5 |
| B.它溶于水所得的溶液中共有4种离子 |
C.它溶于水发生电离的第一步可表示为: |
| D.若已知联氨和四氧化二氮可以做火箭推进剂,两者反应产物可以是氮气和水 |
(5)在标准状况下将1.92g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到只由NO2和NO组成的混合气体1.12L,则混合气体中NO的体积为_____。
| A.56mL | B.112mL | C.224mL | D.448mL |
您最近一年使用:0次
名校
解题方法
3 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
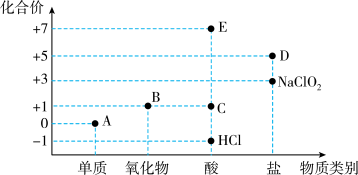
回答下列问题:
(1)已知D可用于实验室制O2,其焰色试验为紫色,D中含有的化学键有_______ ;A、B、C、D四种物质中,属于电解质的是_______ (填化学式)。
(2)B为酸性氧化物,则B与氢氧化钠溶液反应的化学方程式为_______ 。
(3)将E滴入碳酸氢钠溶液中,有大量气泡产生,该反应的离子方程式为_______ 。
(4)已知A与氢氧化钠溶液反应生成NaCl、NaClO和NaClO3的混合物,若n(NaClO)与n(NaClO3)之比为3∶1,则氧化剂与还原剂的物质的量之比为______ 。
(5)NaClO2、二氧化氯(ClO2)均为高效无毒的消毒剂。
①NaClO2的消毒效率是A的_______ 倍(还原产物都是Cl-,消毒效率以单位物质的量的物质得到的电子数表示)。
②ClO2在杀菌消毒过程中会产生亚氯酸盐( ),需将其转化为Cl-除去,下列试剂可将
),需将其转化为Cl-除去,下列试剂可将 转化为Cl-的是
转化为Cl-的是_________ (填标号)。
A.FeSO4 B.O3 C.KMnO4 D.Na2SO3

回答下列问题:
(1)已知D可用于实验室制O2,其焰色试验为紫色,D中含有的化学键有
(2)B为酸性氧化物,则B与氢氧化钠溶液反应的化学方程式为
(3)将E滴入碳酸氢钠溶液中,有大量气泡产生,该反应的离子方程式为
(4)已知A与氢氧化钠溶液反应生成NaCl、NaClO和NaClO3的混合物,若n(NaClO)与n(NaClO3)之比为3∶1,则氧化剂与还原剂的物质的量之比为
(5)NaClO2、二氧化氯(ClO2)均为高效无毒的消毒剂。
①NaClO2的消毒效率是A的
②ClO2在杀菌消毒过程中会产生亚氯酸盐(
 ),需将其转化为Cl-除去,下列试剂可将
),需将其转化为Cl-除去,下列试剂可将 转化为Cl-的是
转化为Cl-的是A.FeSO4 B.O3 C.KMnO4 D.Na2SO3
您最近一年使用:0次
2023-06-08更新
|
233次组卷
|
5卷引用:山东省临沂市2021-2022学年高一上学期期末统考化学试题
名校
解题方法
4 . 利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:

已知:g为钠盐。
(1)按物质性质分类,c、d均属于___________ 氧化物。
(2)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有___________ (填化学式)。
(3)若将a与c混合可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为___________ 。
(4)f的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为___________ 。
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是___________ (填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)c→e→f是硫酸型酸雨的形成途径之一、某地收集的雨水样品在不同时间测得pH如表所示,请用化学方程式解释该雨水样品随时间变化酸性逐渐增强的原因___________ 。

已知:g为钠盐。
(1)按物质性质分类,c、d均属于
(2)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有
(3)若将a与c混合可生成淡黄色固体,该反应中氧化剂与还原剂的物质的量之比为
(4)f的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为
(5)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(6)c→e→f是硫酸型酸雨的形成途径之一、某地收集的雨水样品在不同时间测得pH如表所示,请用化学方程式解释该雨水样品随时间变化酸性逐渐增强的原因
| 时间/h | 0 | 2 | 4 | 6 | 8 | 10 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 |
您最近一年使用:0次
名校
5 . 利用“价类二维图”研究物质的性质是化学研究的重要手段。下图是氯元素的化合价与部分物质类别的对应关系。
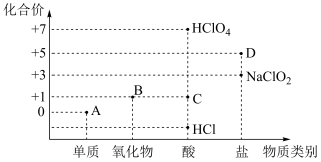
(1)已知D可用于实验室制 ,其焰色试验为紫色。A、B、C、D四种物质中,属于电解质的是
,其焰色试验为紫色。A、B、C、D四种物质中,属于电解质的是___________ (填化学式)。
(2)B溶于氢氧化钠溶液,可生成“84”消毒液的有效成分,则B属于___________ (填“酸性”或“碱性”)氧化物。
(3)D在400℃时分解只生成两种盐,其中一种是无氧酸盐;另一种盐M的阴阳离子个数比为1:1,则M的电离方程式为___________ 。
(4) 是一种高效的消毒剂和漂白剂。Mathieson法制备
是一种高效的消毒剂和漂白剂。Mathieson法制备 的流程如下:
的流程如下:
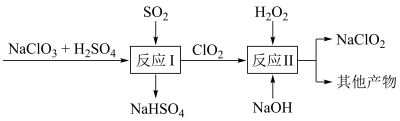
①反应Ⅰ中氧化剂与还原剂的物质的量之比为___________ ;反应Ⅱ中的氧化产物是___________ 。
②与新型消毒剂 比较,
比较, 消毒效率
消毒效率___________  消毒效率(填“<”、“>”或“=”;已知:以单位质量得到的电子数衡量消毒效率,两者还原产物均是
消毒效率(填“<”、“>”或“=”;已知:以单位质量得到的电子数衡量消毒效率,两者还原产物均是 )。
)。

(1)已知D可用于实验室制
 ,其焰色试验为紫色。A、B、C、D四种物质中,属于电解质的是
,其焰色试验为紫色。A、B、C、D四种物质中,属于电解质的是(2)B溶于氢氧化钠溶液,可生成“84”消毒液的有效成分,则B属于
(3)D在400℃时分解只生成两种盐,其中一种是无氧酸盐;另一种盐M的阴阳离子个数比为1:1,则M的电离方程式为
(4)
 是一种高效的消毒剂和漂白剂。Mathieson法制备
是一种高效的消毒剂和漂白剂。Mathieson法制备 的流程如下:
的流程如下:
①反应Ⅰ中氧化剂与还原剂的物质的量之比为
②与新型消毒剂
 比较,
比较, 消毒效率
消毒效率 消毒效率(填“<”、“>”或“=”;已知:以单位质量得到的电子数衡量消毒效率,两者还原产物均是
消毒效率(填“<”、“>”或“=”;已知:以单位质量得到的电子数衡量消毒效率,两者还原产物均是 )。
)。
您最近一年使用:0次
名校
6 . 回答下列问题
(1)储氢纳米碳管具有广泛的用途,电弧法合成的碳纳米管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应的化学方程式如下: 。回答下列问题:
。回答下列问题:
①用双线桥标出反应中电子转移方向和数目___________ 。
②上述反应中的还原产物为___________ 。
③上述反应的离子方程式是___________
(2)磷酸(H3PO4)、次磷酸(H3PO2)是精细磷化工产品,次磷酸具有较强还原性,回答下列问题:
①已知H3PO2与足量NaOH溶液反应生成NaH2PO2.则H3PO2是___________ 酸(填“一元、二元或三元”),NaH2PO2为___________ (填“正盐”或“酸式盐”)。
②H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于对器皿实现化学镀银,利用H3PO2进行化学镀银反应中,氧化产物为H3PO4 则化学方程式氧化剂与还原剂的化学计量数之比为
则化学方程式氧化剂与还原剂的化学计量数之比为_________ 。
(1)储氢纳米碳管具有广泛的用途,电弧法合成的碳纳米管常伴有大量的杂质碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯,反应的化学方程式如下:
 。回答下列问题:
。回答下列问题:①用双线桥标出反应中电子转移方向和数目
②上述反应中的还原产物为
③上述反应的离子方程式是
(2)磷酸(H3PO4)、次磷酸(H3PO2)是精细磷化工产品,次磷酸具有较强还原性,回答下列问题:
①已知H3PO2与足量NaOH溶液反应生成NaH2PO2.则H3PO2是
②H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于对器皿实现化学镀银,利用H3PO2进行化学镀银反应中,氧化产物为H3PO4
 则化学方程式氧化剂与还原剂的化学计量数之比为
则化学方程式氧化剂与还原剂的化学计量数之比为
您最近一年使用:0次
名校
解题方法
7 .  具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图所示。将干燥的氨气通入
具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图所示。将干燥的氨气通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: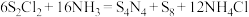 [已知
[已知 (分子结构为
(分子结构为 是硫单质中最稳定的]。下列说法错误的是
是硫单质中最稳定的]。下列说法错误的是

A. 属于分子晶体, 属于分子晶体,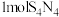 中含有 中含有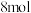 极性键 极性键 |
B.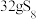 中含有 中含有 非极性键 非极性键 |
C.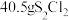 参与上述制备反应,转移 参与上述制备反应,转移 电子 电子 |
D. 的VSEPR模型均为四面体形 的VSEPR模型均为四面体形 |
您最近一年使用:0次
2024-03-03更新
|
383次组卷
|
2卷引用:山东省菏泽市东明县第一中学2023-2024学年高三下学期开学化学试题
名校
8 . Ⅰ.某城市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5 μm的悬浮颗粒物),其主要来源为燃煤、机动车尾气等。请回答下列问题:
(1)PM2.5分散在空气中形成的分散系________ (填“属于”或“不属于”)胶体。
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
根据表中数据判断待测试样为_____ (填“酸”或“碱”)性,表示该试样酸碱性的c(H+)或c(OH-)=______ mol·L-1。
Ⅱ.氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(3)“维生素C可以将食物中的Fe3+转化为Fe2+,说明维生素C______ 具有(填“氧化性”或“还原性”)。
(4)二氧化氯是一种高效消毒剂。工业上制备ClO2的反应为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①该反应中每生成1molClO2分子,转移电子的数目为_____ 。
②ClO2在杀菌消毒的过程中会生成副产物亚氯酸盐( ),需要将其转化为Cl-除去,下列试剂能实现其转化过程的是
),需要将其转化为Cl-除去,下列试剂能实现其转化过程的是_____ 。
A.O2 B.FeCl2 C.KCl D.KMnO4
(1)PM2.5分散在空气中形成的分散系
(2)将PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ |  |  |  | Cl- |
| 浓度/mol·L-1 | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
Ⅱ.氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(3)“维生素C可以将食物中的Fe3+转化为Fe2+,说明维生素C
(4)二氧化氯是一种高效消毒剂。工业上制备ClO2的反应为2NaClO3+4HCl=2ClO2↑+Cl2↑+2H2O+2NaCl。
①该反应中每生成1molClO2分子,转移电子的数目为
②ClO2在杀菌消毒的过程中会生成副产物亚氯酸盐(
 ),需要将其转化为Cl-除去,下列试剂能实现其转化过程的是
),需要将其转化为Cl-除去,下列试剂能实现其转化过程的是A.O2 B.FeCl2 C.KCl D.KMnO4
您最近一年使用:0次
2024-02-14更新
|
48次组卷
|
2卷引用:山东省德州市第一中学2023-2024学年高一上学期12月月考化学试题
名校
解题方法
9 .  具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图所示。将干燥的氨气通入
具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图所示。将干燥的氨气通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: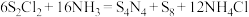 (已知
(已知 分子结构为
分子结构为 。下列说法错误的是
。下列说法错误的是

 具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图所示。将干燥的氨气通入
具有很好的导电性,在光学、电学等行业有着重要的用途,其分子结构如图所示。将干燥的氨气通入 的
的 溶液中,可制得该物质:
溶液中,可制得该物质: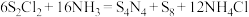 (已知
(已知 分子结构为
分子结构为 。下列说法错误的是
。下列说法错误的是
A. 属于分子晶体, 属于分子晶体,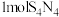 中含有8mol极性键 中含有8mol极性键 |
B. 中S采取 中S采取 杂化 杂化 |
C.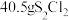 参与上述制备反应,转移0.3mol电子 参与上述制备反应,转移0.3mol电子 |
D. 在上述反应中体现了还原性和碱性 在上述反应中体现了还原性和碱性 |
您最近一年使用:0次
名校
解题方法
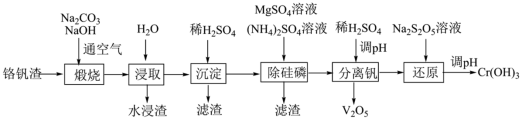
10 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:
已知:最高价铬酸根在酸性介质中以 存在,在碱性介质中以
存在,在碱性介质中以 存在。
存在。
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为_______ (填化学式)。
(2)“沉淀”步骤中主要生成的滤渣为_______ (填化学式)。
(3)“除硅磷”步骤中,使硅、磷分别以 和
和 的形式沉淀,该步需要控制溶液的
的形式沉淀,该步需要控制溶液的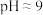 的原因为
的原因为_______ 。
(4)“分离钒”步骤中,将溶液pH调到1.8左右得到 沉淀,
沉淀, 在
在 时溶解为
时溶解为 的离子方程式为
的离子方程式为_______ 。
(5)“还原”步骤中加入焦亚硫酸钠 溶液,反应中氧化剂和还原剂的物质的量之比为
溶液,反应中氧化剂和还原剂的物质的量之比为_______ ; 的性质与
的性质与 相似,写出
相似,写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式_______ 。

已知:最高价铬酸根在酸性介质中以
 存在,在碱性介质中以
存在,在碱性介质中以 存在。
存在。(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(2)“沉淀”步骤中主要生成的滤渣为
(3)“除硅磷”步骤中,使硅、磷分别以
 和
和 的形式沉淀,该步需要控制溶液的
的形式沉淀,该步需要控制溶液的 的原因为
的原因为(4)“分离钒”步骤中,将溶液pH调到1.8左右得到
 沉淀,
沉淀, 在
在 时溶解为
时溶解为 的离子方程式为
的离子方程式为(5)“还原”步骤中加入焦亚硫酸钠
 溶液,反应中氧化剂和还原剂的物质的量之比为
溶液,反应中氧化剂和还原剂的物质的量之比为 的性质与
的性质与 相似,写出
相似,写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式
您最近一年使用:0次



