名校
1 . 研究物质性质及物质转化具有重要的价值,根据所学知识回答下列问题:
(1)在酸性条件下,可发生反应: ,在该过程中
,在该过程中 被氧化,
被氧化,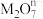 中M的化合价是
中M的化合价是___________ 价。
(2)卫星发射时以 (联氨)和
(联氨)和 为火箭的动力源,二者发生的反应为:
为火箭的动力源,二者发生的反应为: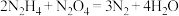 ,反应温度高达2700℃。用双线桥标出该反应电子转移的方向和数目
,反应温度高达2700℃。用双线桥标出该反应电子转移的方向和数目___________ 。
(3)某同学设计如下实验研究 的性质:
的性质:
①从理论上分析 具有还原性的原因
具有还原性的原因___________ 。
②能证明 具有氧化性的实验是
具有氧化性的实验是___________ (填序号),该实验发生氧化还原反应中的氧化产物是___________ 。
(1)在酸性条件下,可发生反应:
 ,在该过程中
,在该过程中 被氧化,
被氧化,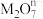 中M的化合价是
中M的化合价是(2)卫星发射时以
 (联氨)和
(联氨)和 为火箭的动力源,二者发生的反应为:
为火箭的动力源,二者发生的反应为: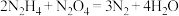 ,反应温度高达2700℃。用双线桥标出该反应电子转移的方向和数目
,反应温度高达2700℃。用双线桥标出该反应电子转移的方向和数目(3)某同学设计如下实验研究
 的性质:
的性质:| 序号 | 实验 | 实验现象 |
| Ⅰ | 向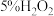 溶液中滴加酸性 溶液中滴加酸性 溶液 溶液 | a.溶液紫色褪去 b.有大量气泡产生 |
| Ⅱ | 向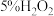 酸性溶液中滴加淀粉碘化钾溶液 酸性溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
 具有还原性的原因
具有还原性的原因②能证明
 具有氧化性的实验是
具有氧化性的实验是
您最近一年使用:0次
2 . 氯气管道发生泄漏可用浓氨水检验:3Cl2+8NH3=6NH4Cl+N2,下列说法不正确 的是(NA为阿伏加德罗常数的值)
| A.生成0.5mol N2时转移电子为3NA | B.Cl2发生了还原反应 |
| C.NH3仅体现还原性 | D.N2也有一定的氧化性,但氧化性比Cl2弱 |
您最近一年使用:0次
名校
3 . 研究人员在金星大气中探测到了磷化氢( )气体、
)气体、 常作为一种熏蒸剂,在贮粮中用于防治害虫,一种制备
常作为一种熏蒸剂,在贮粮中用于防治害虫,一种制备 的流程如图所示。下列说法正确的是
的流程如图所示。下列说法正确的是
 )气体、
)气体、 常作为一种熏蒸剂,在贮粮中用于防治害虫,一种制备
常作为一种熏蒸剂,在贮粮中用于防治害虫,一种制备 的流程如图所示。下列说法正确的是
的流程如图所示。下列说法正确的是
| A.上述流程中每一步均属于氧化还原反应 |
| B.白磷与浓氢氧化钠反应中氧化剂和还原剂的质量比是3:1 |
C.已知次磷酸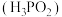 为一元酸,则次磷酸钠 为一元酸,则次磷酸钠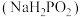 属于正盐 属于正盐 |
D.次磷酸分解时被氧化成 ,被还原成 ,被还原成 |
您最近一年使用:0次
4 . 对于Na2O2与H2O的反应,下列说法中正确的是
| A.Na2O2是氧化剂,H2O是还原剂 | B.Na2O2既是氧化剂又是还原剂 |
| C.每生成1个氧分子,该反应中转移4个电子 | D.18g H2O与足量Na2O2反应,产生32 g O2 |
您最近一年使用:0次
5 . 储氢纳米碳管研究成功体现了科技的进步。但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒。这种碳纳米颗粒可用氧化气化法提纯。其反应方程式为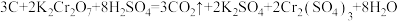 请回答下列问题:
请回答下列问题:
(1)用双线桥法标明上述反应方程式中电子转移的方向和数目___________ 。
(2)上述反应中氧化剂是___________ ,被氧化的元素是___________ (填元素符号),氧化产物是___________ ,还原产物是___________ 。
(3)H2SO4在上述反应中表现出来的性质是___________(填标号)。
(4)该反应中每生成3个CO2转移___________ 个电子。
(5)请配平下列离子方程式___________ ,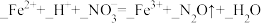 。
。
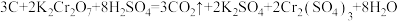 请回答下列问题:
请回答下列问题:(1)用双线桥法标明上述反应方程式中电子转移的方向和数目
(2)上述反应中氧化剂是
(3)H2SO4在上述反应中表现出来的性质是___________(填标号)。
| A.酸性 | B.氧化性 | C.氧化性和酸性 | D.还原性和酸性 |
(5)请配平下列离子方程式
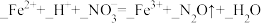 。
。
您最近一年使用:0次
6 . 已知常温下,在溶液中发生如下反应:①16H++10Z-+2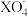 =2X2++5Z2+8H2O;②2A2++B2=2A3++2B-;③2B-+Z2=B2+2Z-。由此推断下列说法错误的是
=2X2++5Z2+8H2O;②2A2++B2=2A3++2B-;③2B-+Z2=B2+2Z-。由此推断下列说法错误的是
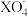 =2X2++5Z2+8H2O;②2A2++B2=2A3++2B-;③2B-+Z2=B2+2Z-。由此推断下列说法错误的是
=2X2++5Z2+8H2O;②2A2++B2=2A3++2B-;③2B-+Z2=B2+2Z-。由此推断下列说法错误的是| A.反应Z2+2A2+=2A3++2Z-可以进行 |
| B.B2在反应②中是氧化剂,在反应③中是氧化产物 |
C.氧化性由强到弱的顺序是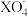 、Z2、B2、A3+ 、Z2、B2、A3+ |
D.反应①中1个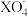 参加反应得到10个电子 参加反应得到10个电子 |
您最近一年使用:0次
名校
解题方法
7 . 一定条件下发生反应: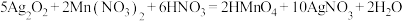 。下列关于该反应的叙述错误的是
。下列关于该反应的叙述错误的是
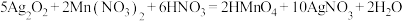 。下列关于该反应的叙述错误的是
。下列关于该反应的叙述错误的是| A.氧化性:Ag2O2>HMnO4 |
| B.当溶液变红色时表明已发生反应 |
| C.氧化产物、还原产物的物质的量之比为1:1 |
| D.0.1mol Ag2O2完全反应转移电子数约为0.2×6.02×1023 |
您最近一年使用:0次
2024-10-03更新
|
137次组卷
|
2卷引用:甘肃省白银市第八中学2024-2025学年高三上学期第一次月考 化学试题
8 . 次磷酸钠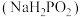 广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如下:
广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如下:
(1)红磷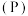 与白磷之间的关系为互为
与白磷之间的关系为互为_______ ,二者在一定条件下可以发生转化,该反应属于_______ (填“氧化还原反应”或“非氧化还原反应”)。
(2) 中磷元素的化合价为
中磷元素的化合价为_______ ,已知 为一元酸,则
为一元酸,则 为
为_______ (填“酸式盐”“碱式盐”或“正盐”)。
(3)写出“碱溶”过程发生反应的化学方程式:_______ ,该反应中氧化剂与还原剂的质量之比为_______ 。
(4)由“镀镍”过程可知 具有
具有_______ (填“氧化”或“还原”)性,理论上要制备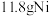 需要
需要 的质量为
的质量为_______ 。
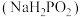 广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如下:
广泛应用于化学镀镍,次磷酸钠的生产与镀镍过程如下: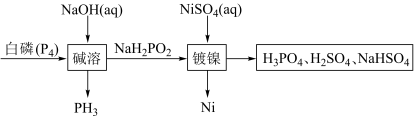
(1)红磷
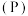 与白磷之间的关系为互为
与白磷之间的关系为互为(2)
 中磷元素的化合价为
中磷元素的化合价为 为一元酸,则
为一元酸,则 为
为(3)写出“碱溶”过程发生反应的化学方程式:
(4)由“镀镍”过程可知
 具有
具有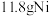 需要
需要 的质量为
的质量为
您最近一年使用:0次
名校
9 . 工业上由含铜废料(含有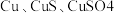 等)制备硝酸铜晶体的流程如图所示:
等)制备硝酸铜晶体的流程如图所示: 时进行,写出由
时进行,写出由 “焙烧”生成
“焙烧”生成 和
和 的化学方程式为:
的化学方程式为:___________ 。
(2)“过滤”所得滤液中溶质的主要成分为___________ (填化学式)。
(3)“淘洗”所用的溶液A可以是___________(填字母)。
(4)“反应”一步所用的试剂是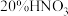 和
和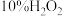 ,反应过程中无红棕色气体生成。
,反应过程中无红棕色气体生成。
①理论上消耗的 和
和 的物质的量之比为
的物质的量之比为___________ 。
②若不加10%的 溶液,只用20%的
溶液,只用20%的 溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为
溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为___________ 。
(5)根据下图分析从“反应”所得溶液中析出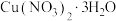 的方法是
的方法是___________ 。 有很多性质,既能体现酸性,又能体现氧化性或还原性,请写出
有很多性质,既能体现酸性,又能体现氧化性或还原性,请写出 使酸性高锰酸钾溶液褪色的离子方程式:
使酸性高锰酸钾溶液褪色的离子方程式:___________ 。
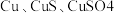 等)制备硝酸铜晶体的流程如图所示:
等)制备硝酸铜晶体的流程如图所示:
 时进行,写出由
时进行,写出由 “焙烧”生成
“焙烧”生成 和
和 的化学方程式为:
的化学方程式为:(2)“过滤”所得滤液中溶质的主要成分为
(3)“淘洗”所用的溶液A可以是___________(填字母)。
| A.稀硫酸 | B.浓硫酸 | C.稀硝酸 | D.浓硝酸 |
(4)“反应”一步所用的试剂是
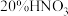 和
和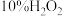 ,反应过程中无红棕色气体生成。
,反应过程中无红棕色气体生成。①理论上消耗的
 和
和 的物质的量之比为
的物质的量之比为②若不加10%的
 溶液,只用20%的
溶液,只用20%的 溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为
溶液,随着反应的进行,温度上升并出现大量红棕色气体,反应的离子方程式为(5)根据下图分析从“反应”所得溶液中析出
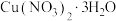 的方法是
的方法是
 有很多性质,既能体现酸性,又能体现氧化性或还原性,请写出
有很多性质,既能体现酸性,又能体现氧化性或还原性,请写出 使酸性高锰酸钾溶液褪色的离子方程式:
使酸性高锰酸钾溶液褪色的离子方程式:
您最近一年使用:0次
名校
10 . 已知: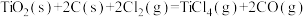 △H<0,下列说法正确的是
△H<0,下列说法正确的是
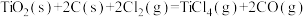 △H<0,下列说法正确的是
△H<0,下列说法正确的是A.该条件下, 熔点比 熔点比 高 高 |
B.平衡时升高温度, 减小, 减小, 增大 增大 |
C.及时分离 可加快反应达到平衡状态 可加快反应达到平衡状态 |
D.上述反应中每生成1molCO,转移电子的数目为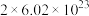 |
您最近一年使用:0次
2024-08-30更新
|
233次组卷
|
2卷引用:甘肃省武威市第六中学2024-2025学年高二上学期开学考试化学试卷



