1 . 下列表示氧化还原反应中电子转移的方向和数目正确的是
A.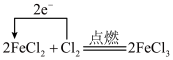 | B.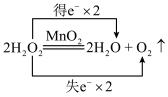 |
C. | D.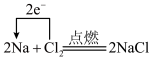 |
您最近一年使用:0次
名校
2 . 某同学利用如图实验装置用氯气制备少量的漂白粉。回答下列问题:
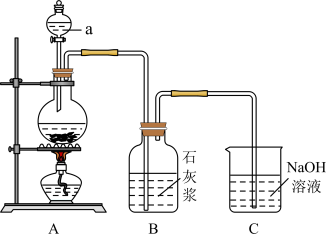
(1)漂白粉的有效成分是___________ 。(填化学式)
(2)装置C的作用是___________ ,C中发生反应的离子方程式为 ___________ 。
(3)装置B中反应放热会使体系温度升高,导致氯气和石灰浆发生副反应产生杂质Ca(ClO3)2,该副反应氧化剂和还原剂的质量之比___________ ;为防止该副反应发生,可采取的措施是 ___________ 。
(4)利用二氧化锰和浓盐酸制取氯气的离子方程式为___________ 。

(1)漂白粉的有效成分是
(2)装置C的作用是
(3)装置B中反应放热会使体系温度升高,导致氯气和石灰浆发生副反应产生杂质Ca(ClO3)2,该副反应氧化剂和还原剂的质量之比
(4)利用二氧化锰和浓盐酸制取氯气的离子方程式为
您最近一年使用:0次
名校
3 . a mol FeS与b mol FeO投入到V L、c mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液的成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④Vc-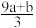 mol ⑤3(a+b)mol
mol ⑤3(a+b)mol
①(a+b)×63g ②(a+b)×189g ③(a+b)mol ④Vc-
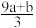 mol ⑤3(a+b)mol
mol ⑤3(a+b)mol| A.①③④ | B.②③⑤ | C.①②③ | D.②④⑤ |
您最近一年使用:0次
4 . 氧化还原反应在工农业生产、日常生活中具有广泛用途,贯穿古今。
(1)工业盐的主要成分是 ,以前有许多起因误食
,以前有许多起因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有_______ (填“氧化”或“还原”,下同)。工业盐中毒后,可服用维生素C来缓解中毒状况,这说明维生素C具有________ 性。
(2) 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下: 。
。
①配平上述氧化还原反应方程式___________ 。
②该反应中,氧化剂是___________ (填化学式),被氧化的元素是___________ (填元素名称)。
(3)二氧化氯是一种高效消毒剂。工业上制备 的反应为:
的反应为: 。
。
①该反应中的还原产物是___________ (写化学式),反应中每生成1mol 分子,被氧化的HCl的物质的量为
分子,被氧化的HCl的物质的量为___________ ,转移电子的数目为___________ 。
②用“单线桥”标出反应中电子转移的方向与数目___________ 。
③ 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),要将其转化为
),要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是___________ (填字母)。
a. b.
b. c.
c. d.
d.
(4)双氯水是公认的绿色氧化剂。已知氯化性强弱顺序为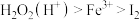 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为___________ 。
(1)工业盐的主要成分是
 ,以前有许多起因误食
,以前有许多起因误食 而中毒的事件,其原因是
而中毒的事件,其原因是 把人体内的
把人体内的 转化为
转化为 而失去与
而失去与 结合的能力,这说明
结合的能力,这说明 具有
具有(2)
 常用于焊接,在焊接铜器时可用
常用于焊接,在焊接铜器时可用 除去铜器表面的氧化铜,便于焊接,其反应如下:
除去铜器表面的氧化铜,便于焊接,其反应如下: 。
。①配平上述氧化还原反应方程式
②该反应中,氧化剂是
(3)二氧化氯是一种高效消毒剂。工业上制备
 的反应为:
的反应为: 。
。①该反应中的还原产物是
 分子,被氧化的HCl的物质的量为
分子,被氧化的HCl的物质的量为②用“单线桥”标出反应中电子转移的方向与数目
③
 在杀菌消毒的过程中会生成副产物亚氯酸盐(
在杀菌消毒的过程中会生成副产物亚氯酸盐( ),要将其转化为
),要将其转化为 除去,下列试剂能实现其转化过程的是
除去,下列试剂能实现其转化过程的是a.
 b.
b. c.
c. d.
d.
(4)双氯水是公认的绿色氧化剂。已知氯化性强弱顺序为
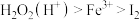 ,向
,向 溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
溶液中加入足量硫酸酸化的双氧水,发生反应的离子方程式为
您最近一年使用:0次
5 . 反应3Fe+4NaOH=Fe3O4+2H2↑+4Na↑可用于制备钠。下列有关说法正确的是
| A.钠可从四氯化钛溶液中置换出钛 |
| B.生成的气体在空气中冷却可获得钠 |
| C.该反应条件下铁的氧化性比钠强 |
| D.每生成1molH2转移的电子数约为4×6.02×1023 |
您最近一年使用:0次
2024-02-14更新
|
155次组卷
|
2卷引用:新疆乌鲁木齐市第十一中学2023-2024学年高一上学期1月期末化学试题
名校
6 . 工业上用生物法处理H2S的原理如下:
反应1:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
反应2:4Fe2SO4+2H2SO4+O2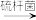 2Fe(SO4)3+2H2O
2Fe(SO4)3+2H2O
以硫杆菌作催化剂时,反应温度及溶液pH对Fe2+氧化速率的影响分别如图1、图2所示,下列说法不正确的是

反应1:H2S+Fe2(SO4)3=S↓+2FeSO4+H2SO4
反应2:4Fe2SO4+2H2SO4+O2
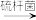 2Fe(SO4)3+2H2O
2Fe(SO4)3+2H2O以硫杆菌作催化剂时,反应温度及溶液pH对Fe2+氧化速率的影响分别如图1、图2所示,下列说法不正确的是

| A.上述总反应方程式为:2H2S+O2=2S↓+2H2O,Fe2(SO4)3是该反应的催化剂 |
| B.当反应温度过高时,Fe2+氧化速率下降的原因可能是硫杆菌失去活性 |
| C.由图-1、图-2可得出结论:使用硫杆菌作催化剂的最佳条件为30℃、pH=2.0 |
| D.当反应1中转移0.1mol电子时,反应1中消耗的H2S在标准状况下的体积为2.24L |
您最近一年使用:0次
2024-02-14更新
|
143次组卷
|
2卷引用:新疆乌鲁木齐市第十一中学2023-2024学年高一上学期1月期末化学试题
7 . 微生物法炼铜是在反应釜中加入黄铜矿( ,其中Cu为+2价)、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,各物质的转化关系如图所示,下列说法错误的是
,其中Cu为+2价)、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,各物质的转化关系如图所示,下列说法错误的是
 ,其中Cu为+2价)、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,各物质的转化关系如图所示,下列说法错误的是
,其中Cu为+2价)、硫酸铁、硫酸和微生物,并鼓入空气,黄铜矿逐渐溶解,各物质的转化关系如图所示,下列说法错误的是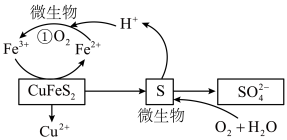
| A.反应釜中保持高温不利于反应进行 |
B.整个转化过程中,可以循环利用的物质有 和 和 |
C.反应①的离子方程式为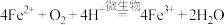 |
D.当黄铜矿中的铁元素全部转化为 时,生成 时,生成 共消耗 共消耗 |
您最近一年使用:0次
2024-02-14更新
|
505次组卷
|
3卷引用:新疆生产建设兵团第三师图木舒克市第一中学2023-2024学年高一下学期4月月考化学试题
名校
8 .  将逐渐取代
将逐渐取代 成为生产自来水的消毒剂。工业上常通过如下反应制取:
成为生产自来水的消毒剂。工业上常通过如下反应制取: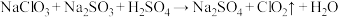 (未配平)。下列说法正确的是
(未配平)。下列说法正确的是
 将逐渐取代
将逐渐取代 成为生产自来水的消毒剂。工业上常通过如下反应制取:
成为生产自来水的消毒剂。工业上常通过如下反应制取: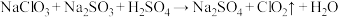 (未配平)。下列说法正确的是
(未配平)。下列说法正确的是| A.反应中氯元素被氧化,硫元素被还原 |
B.还原性: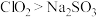 |
| C.氧化剂和还原剂的物质的量之比为2:1 |
D.每生成 转移2mol电子 转移2mol电子 |
您最近一年使用:0次
2024-02-11更新
|
162次组卷
|
4卷引用: 新疆实验中学2023-2024学年高一上学期1月月考化学试题
名校
9 . 学以致用是学习化学的动力和源泉,掌握化学知识有助于我们更好地认识世界。回答下列问题:
(1)云、雾属于胶体,鉴别胶体和溶液的方法是______ ,胶体和溶液的本质区别是_______ 。
(2)生铁是______ (填“混合物”或“化合物”)。通常合金的熔点_____ (填“高于”或“低于”)其组成单质的熔点。
(3)ClO2是一种新型含氯消毒剂,已经用于自来水消毒。实验室可通过以下反应制得: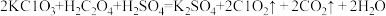 。产生1molC1O2时,转移电子的物质的量为
。产生1molC1O2时,转移电子的物质的量为______ mol;该反应中的还原剂是______ (填化学式)。
(4)在标准状况下,由CO2和CO组成的混合气体的密度是H2的19倍,则两者体积比V(CO2):V(CO)=____ 。
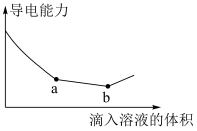
(5)Ba(OH)2溶液中滴入浓度相等的NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。从开始到a点总的离子方程式是______ ,从a点到b点反应的离子方程式是______ ,解释b点之后导电能力上升的原因:______ 。
(1)云、雾属于胶体,鉴别胶体和溶液的方法是
(2)生铁是
(3)ClO2是一种新型含氯消毒剂,已经用于自来水消毒。实验室可通过以下反应制得:
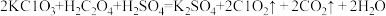 。产生1molC1O2时,转移电子的物质的量为
。产生1molC1O2时,转移电子的物质的量为(4)在标准状况下,由CO2和CO组成的混合气体的密度是H2的19倍,则两者体积比V(CO2):V(CO)=
(5)Ba(OH)2溶液中滴入浓度相等的NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如图所示。从开始到a点总的离子方程式是
您最近一年使用:0次
2024-01-28更新
|
104次组卷
|
4卷引用:新疆生产建设兵团第三师图木舒克市第二中学2023-2024学年高一下学期开学考试化学试题
名校
解题方法
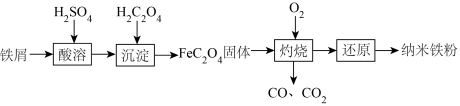
10 . 纳米铁是一种黑色粉末,可用于制作高密度磁性材料。以铁屑(含少量 杂质)为原料制备纳米铁粉流程如下:
杂质)为原料制备纳米铁粉流程如下:
已知:草酸( )是一种二元酸
)是一种二元酸
(1)取少量产品分散于水中,通过_______ 效应,可验证所得铁粉直径是否为纳米级。
(2)写出“酸溶”时氧化还原反应的离子方程式:_______ 、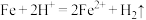 。
。
(3)若加入480mL1.5mol/LH2SO4时,铁屑与 恰好完全反应,为了使
恰好完全反应,为了使 元素完全转化,则沉淀过程中加入2mol/LH2C2O4的体积至少为
元素完全转化,则沉淀过程中加入2mol/LH2C2O4的体积至少为_______  。
。
(4) 固体在空气中灼烧后得到红棕色固体和
固体在空气中灼烧后得到红棕色固体和 、
、 混合气体,若产物中
混合气体,若产物中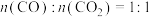 ,则“灼烧”过程中发生反应的化学方程式为
,则“灼烧”过程中发生反应的化学方程式为_______ 。
(5)纳米铁粉可用于处理含氧酸性废水中的 ,反应原理如图所示。
,反应原理如图所示。
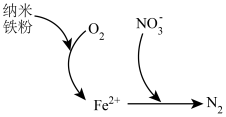
①该过程中体现了纳米铁粉的_______ 性(填“氧化”或“还原”)。
②在铁粉总量一定的条件下,废水中的溶解氧过多不利于 的去除,原因是
的去除,原因是_______ 。
(6)一定条件下,向 溶液中加入过量碱性
溶液中加入过量碱性 溶液,(B元素的化合价为+3价),溶液中
溶液,(B元素的化合价为+3价),溶液中 与
与 反应生成纳米铁粉、
反应生成纳米铁粉、 和
和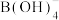 ,其离子方程式为
,其离子方程式为_______ 。
 杂质)为原料制备纳米铁粉流程如下:
杂质)为原料制备纳米铁粉流程如下:
已知:草酸(
 )是一种二元酸
)是一种二元酸(1)取少量产品分散于水中,通过
(2)写出“酸溶”时氧化还原反应的离子方程式:
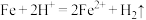 。
。(3)若加入480mL1.5mol/LH2SO4时,铁屑与
 恰好完全反应,为了使
恰好完全反应,为了使 元素完全转化,则沉淀过程中加入2mol/LH2C2O4的体积至少为
元素完全转化,则沉淀过程中加入2mol/LH2C2O4的体积至少为 。
。(4)
 固体在空气中灼烧后得到红棕色固体和
固体在空气中灼烧后得到红棕色固体和 、
、 混合气体,若产物中
混合气体,若产物中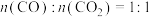 ,则“灼烧”过程中发生反应的化学方程式为
,则“灼烧”过程中发生反应的化学方程式为(5)纳米铁粉可用于处理含氧酸性废水中的
 ,反应原理如图所示。
,反应原理如图所示。
①该过程中体现了纳米铁粉的
②在铁粉总量一定的条件下,废水中的溶解氧过多不利于
 的去除,原因是
的去除,原因是(6)一定条件下,向
 溶液中加入过量碱性
溶液中加入过量碱性 溶液,(B元素的化合价为+3价),溶液中
溶液,(B元素的化合价为+3价),溶液中 与
与 反应生成纳米铁粉、
反应生成纳米铁粉、 和
和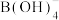 ,其离子方程式为
,其离子方程式为
您最近一年使用:0次
2024-01-25更新
|
182次组卷
|
2卷引用:新疆维吾尔自治区乌鲁木齐市第101中学2023-2024学年高一上学期1月期末化学试题



