解题方法
1 . 物质的形成与氧化还原反应的发生
英国科学家道尔顿是近代原子学说的创始人。他认为物质是由原子构成的,这些是不可分割的实心球体,同种原子的质量和性质相同。意大利科学家阿伏加德罗提出了分子的概念,指出了分子和原子的区别与联系。
构成物质的微粒之间通过不同性质和强度的作用力即化学键相互作用形成了具有特定组成的、性质各异的物质。
氧化还原反应是指在反应前后元素的氧化数有相应升降变化的化学反应。其由氧化反应和还原反应构成,并遵守电荷守恒定律。
氧化还原反应广泛应用于工业、农业、生物、能源等领域。例如,煤炭、石油、天然气等燃料的燃烧,植物的呼吸作用、光合作用,化学电池的制造,金属冶炼,火箭发射,施入土壤后化肥的变化等都与该反应息息相关。因此,认识氧化还原反应的实质与规律,对人类的生产和生活都具有非常重要的意义。
1.据报道,某医院正在研究用放射性同位素碘 治疗肿瘤。该核素原子核外电子数是_________。
治疗肿瘤。该核素原子核外电子数是_________。
2.下列物质中,不可能含有离子键的是_________。
3.用化学用语表示化学方程式2Na+2H2O=2NaOH+H2↑中的相关徼粒,正确的是_________。
4.已知元素A的+1价的正离子核外没有电子,元素B的-2价的负离子的电子层结构与Ne原子相同。
①写出元素符号:A为___________ ;B为___________ 。
②A、B两元素结合成的一种常见的三原子化合物的分子式是___________ ,属于___________ 化合物。
③AlCl3是一种常用的氯化物,认识其结构有利于开发新的含氯元素的化合物。经实验测定,AlCl3在2.02×105Pa时熔点为190℃,且在180℃时即升华。据此性质推测,AlCl3应该属于___________ 选填“离子”或“共价”化合物。由此可知构成AlCl3固体的微粒是___________ 。
5.已知铜能与浓硝酸反应,化学方程式为:Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
①用单线桥标出上述反应的电子转移的方向和数目___________ ;
Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
②上述反应中氧化剂是___________ 填序号,被还原的元素是___________ 填序号;
a. Cu b.HNO3 c. +5价的N元素 d.0价的Cu元素
③写出该反应的离子方程式___________ 。
④0.3molCu被硝酸完全溶解后,被还原的硝酸是___________ mol,产生NO2气体的体积为___________ L标准状况下不考虑NO2与水的反应。
英国科学家道尔顿是近代原子学说的创始人。他认为物质是由原子构成的,这些是不可分割的实心球体,同种原子的质量和性质相同。意大利科学家阿伏加德罗提出了分子的概念,指出了分子和原子的区别与联系。
构成物质的微粒之间通过不同性质和强度的作用力即化学键相互作用形成了具有特定组成的、性质各异的物质。
氧化还原反应是指在反应前后元素的氧化数有相应升降变化的化学反应。其由氧化反应和还原反应构成,并遵守电荷守恒定律。
氧化还原反应广泛应用于工业、农业、生物、能源等领域。例如,煤炭、石油、天然气等燃料的燃烧,植物的呼吸作用、光合作用,化学电池的制造,金属冶炼,火箭发射,施入土壤后化肥的变化等都与该反应息息相关。因此,认识氧化还原反应的实质与规律,对人类的生产和生活都具有非常重要的意义。
1.据报道,某医院正在研究用放射性同位素碘
 治疗肿瘤。该核素原子核外电子数是_________。
治疗肿瘤。该核素原子核外电子数是_________。| A.72 | B.29 | C.53 | D.125 |
| A.CaO | B.NaOH | C.NaCl | D.HCl |
| A.中子数为12的钠原子:12Na | B.F-的结构示意图为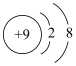 |
C.O的电子式: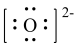 | D.NaOH中只含离子键 |
①写出元素符号:A为
②A、B两元素结合成的一种常见的三原子化合物的分子式是
③AlCl3是一种常用的氯化物,认识其结构有利于开发新的含氯元素的化合物。经实验测定,AlCl3在2.02×105Pa时熔点为190℃,且在180℃时即升华。据此性质推测,AlCl3应该属于
5.已知铜能与浓硝酸反应,化学方程式为:Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
①用单线桥标出上述反应的电子转移的方向和数目
Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
②上述反应中氧化剂是
a. Cu b.HNO3 c. +5价的N元素 d.0价的Cu元素
③写出该反应的离子方程式
④0.3molCu被硝酸完全溶解后,被还原的硝酸是
您最近一年使用:0次
2 . 实验室用 与浓盐酸共热制备
与浓盐酸共热制备 ,反应如下:
,反应如下: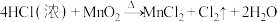
(1)该反应中被氧化的元素是___________ ,还原产物是___________ ;
(2)用单线桥标明电子转移的方向与数目___________ 。
(3)该反应中,氧化剂与还原剂的物质的量之比为___________ (前者比后者);盐酸在反应中表现出来的性质是___________ 。
(4)当生成标准状况下 时,转移的电子数目为
时,转移的电子数目为___________ ,被氧化的还原剂的物质的量为___________ 。
(5)也可以用 和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用
和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用 的原因:
的原因:___________ 。
(6)举例说明氯气的氧化性比硫单质强,___________ 。
 与浓盐酸共热制备
与浓盐酸共热制备 ,反应如下:
,反应如下: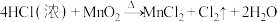
(1)该反应中被氧化的元素是
(2)用单线桥标明电子转移的方向与数目
(3)该反应中,氧化剂与还原剂的物质的量之比为
(4)当生成标准状况下
 时,转移的电子数目为
时,转移的电子数目为(5)也可以用
 和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用
和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用 的原因:
的原因:(6)举例说明氯气的氧化性比硫单质强,
您最近一年使用:0次
解题方法
3 . “太阳能热化学循环制氢”是将太阳能转化成化学能,通过多个化学过程产生H2.如常见的铁氧化物循环制氢过程如图所示。

(1)写出反应Ⅰ的化学方程式:
(2)若该反应生成标准状况下5.6 L氢气,转移电子数目为:
您最近一年使用:0次
解题方法
4 . 自然界中的硫循环和氮循环。人类的文明历程与自然环境的变化密切相关。自然界中,陆地、海洋、大气中的硫元素和氮元素,通过各种循环建立起生态平衡。
(1)陆地和海洋中的硫通过有机物分解释放H2S或可溶硫酸盐、火山喷发(H2S、SO 、SO2)等过程使硫变成可移动的简单化合物进入大气。在火山气体中的硫蒸汽到达地面后会在喷口附近凝结,形成硫黄。火山喷发中形成的H2S和SO2也会发生反应,形成硫。请写出该反应的化学方程式
、SO2)等过程使硫变成可移动的简单化合物进入大气。在火山气体中的硫蒸汽到达地面后会在喷口附近凝结,形成硫黄。火山喷发中形成的H2S和SO2也会发生反应,形成硫。请写出该反应的化学方程式______ 。该反应的氧化剂是______ ,氧化产物和还原产物的比例为______ 。
(2)大气中的水能结合SO2,被氧化后形成硫酸,随降水落入土壤或水体中,以硫酸盐的形式被植物的根系吸收,转变成蛋白质等有机物。SO2与水反应的方程式为:______ 。
(3)工业革命以来,过度的资源开发和利用,打破了自然界的平衡。SO2的过渡排放会引起酸雨等一系列环境问题。下列措施中可用于减少SO2排放量,且经济可行的是______ 。
氮循环是指氮在自然界中的循环转化过程,是生物圈内基本的物质循环之一、大气中的氮经固氮作用进入土壤,最终又在微生物的参与下返回大气中,如此反复循环,以至无穷。
(4)使空气中的氮进入土壤的方法称为氮的固定。下列不属于氮的固定的是______ 。
人们对植物、水体施加氮肥的过程也是氮进入土壤、水体的途径之一、然而,铵态氮肥的施肥过度会造成水体的富营养化。研究发现,可以用化学方法和生物方法去除氨氮。
(5)化学方法一般用次氯酸钠氧化。次氯酸钠可以和水中溶解的氨气反应得到无毒无害物质,其离子方程式为:3ClO-+2NH3=3Cl-+N2↑+3H2O。氨氮脱除率受溶液pH和 的比例影响。表中是不同pH下的氨氮脱除率:
的比例影响。表中是不同pH下的氨氮脱除率:

由上述信息判断,反应的最佳pH范围是______ ,最佳投料比是______ 。
(6)生物方法是O2在硝化细菌作用下,将水体中的NH 转化为NO
转化为NO 。之后,在氧气较少的环境下,NO
。之后,在氧气较少的环境下,NO 又可以在反硝化细菌的作用下与NH
又可以在反硝化细菌的作用下与NH 反应,使氮以N2形式放出。生物方法相对于化学方法的优势是
反应,使氮以N2形式放出。生物方法相对于化学方法的优势是______ 。
(1)陆地和海洋中的硫通过有机物分解释放H2S或可溶硫酸盐、火山喷发(H2S、SO
 、SO2)等过程使硫变成可移动的简单化合物进入大气。在火山气体中的硫蒸汽到达地面后会在喷口附近凝结,形成硫黄。火山喷发中形成的H2S和SO2也会发生反应,形成硫。请写出该反应的化学方程式
、SO2)等过程使硫变成可移动的简单化合物进入大气。在火山气体中的硫蒸汽到达地面后会在喷口附近凝结,形成硫黄。火山喷发中形成的H2S和SO2也会发生反应,形成硫。请写出该反应的化学方程式(2)大气中的水能结合SO2,被氧化后形成硫酸,随降水落入土壤或水体中,以硫酸盐的形式被植物的根系吸收,转变成蛋白质等有机物。SO2与水反应的方程式为:
(3)工业革命以来,过度的资源开发和利用,打破了自然界的平衡。SO2的过渡排放会引起酸雨等一系列环境问题。下列措施中可用于减少SO2排放量,且经济可行的是
| A.用天然气代替煤炭做民用燃料 | B.将工厂的烟囱造高 |
| C.使用CS2萃取煤炭中的硫 | D.工业尾气经碱液处理后再排放 |
氮循环是指氮在自然界中的循环转化过程,是生物圈内基本的物质循环之一、大气中的氮经固氮作用进入土壤,最终又在微生物的参与下返回大气中,如此反复循环,以至无穷。
(4)使空气中的氮进入土壤的方法称为氮的固定。下列不属于氮的固定的是
A.N2+O2 2NO 2NO | B.2NO+O2=2NO2 |
C.N2+3H2 2NH3 2NH3 | D.3Mg+N2 Mg3N2 Mg3N2 |
人们对植物、水体施加氮肥的过程也是氮进入土壤、水体的途径之一、然而,铵态氮肥的施肥过度会造成水体的富营养化。研究发现,可以用化学方法和生物方法去除氨氮。
(5)化学方法一般用次氯酸钠氧化。次氯酸钠可以和水中溶解的氨气反应得到无毒无害物质,其离子方程式为:3ClO-+2NH3=3Cl-+N2↑+3H2O。氨氮脱除率受溶液pH和
 的比例影响。表中是不同pH下的氨氮脱除率:
的比例影响。表中是不同pH下的氨氮脱除率:
| pH | 氨氮脱除率 |
| 5.8 | 51.1% |
| 6.9 | 61.3% |
| 7.7 | 65.8% |
| 8.8 | 61.7% |
| 9.3 | 48.7% |
(6)生物方法是O2在硝化细菌作用下,将水体中的NH
 转化为NO
转化为NO 。之后,在氧气较少的环境下,NO
。之后,在氧气较少的环境下,NO 又可以在反硝化细菌的作用下与NH
又可以在反硝化细菌的作用下与NH 反应,使氮以N2形式放出。生物方法相对于化学方法的优势是
反应,使氮以N2形式放出。生物方法相对于化学方法的优势是
您最近一年使用:0次
名校
5 . 实验室制备 的原理是用亚氯酸钠固体与氯气反应:
的原理是用亚氯酸钠固体与氯气反应: 配平该氧化还原反应方程式,并用单线桥标出电子转移方向和数目
配平该氧化还原反应方程式,并用单线桥标出电子转移方向和数目_______ 。

 与
与 用作消毒剂时均被还原为
用作消毒剂时均被还原为 ,则
,则 的消毒能力是等质量的
的消毒能力是等质量的 的
的_______ 倍(保留小数点后2位,消毒能力可以用氧化剂转移电子数来衡量)。
 的原理是用亚氯酸钠固体与氯气反应:
的原理是用亚氯酸钠固体与氯气反应: 配平该氧化还原反应方程式,并用单线桥标出电子转移方向和数目
配平该氧化还原反应方程式,并用单线桥标出电子转移方向和数目
 与
与 用作消毒剂时均被还原为
用作消毒剂时均被还原为 ,则
,则 的消毒能力是等质量的
的消毒能力是等质量的 的
的
您最近一年使用:0次
名校
6 . 氯气和一些含氯化合物常用作消毒剂。 制备流程可表述如下:
制备流程可表述如下:
① 与
与 作用生成
作用生成 ;
;
②在75℃左右, 进一步完全转化为
进一步完全转化为 ,
,
此步方程式为 (未配平)
(未配平)
(1)写出①生成 的化学方程式
的化学方程式_______ 。漂粉精久置空气中会变质,在变质过程中不会涉及的性质是_______
A. 的酸性 B.HClO的不稳定性 C.HClO的弱酸性 D.HClO的漂白性
的酸性 B.HClO的不稳定性 C.HClO的弱酸性 D.HClO的漂白性
(2)若某学生在上述流程中发现某含钙离子盐的化学式为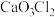 ,试根据盐的定义写出构成这种盐的酸根离子的符号
,试根据盐的定义写出构成这种盐的酸根离子的符号_______ 。
(3)若每一步反应均完全进行,且没有其他副产物,最终 与
与 的物质的量之比为
的物质的量之比为_______ 。
 制备流程可表述如下:
制备流程可表述如下:①
 与
与 作用生成
作用生成 ;
;②在75℃左右,
 进一步完全转化为
进一步完全转化为 ,
,此步方程式为
 (未配平)
(未配平)(1)写出①生成
 的化学方程式
的化学方程式A.
 的酸性 B.HClO的不稳定性 C.HClO的弱酸性 D.HClO的漂白性
的酸性 B.HClO的不稳定性 C.HClO的弱酸性 D.HClO的漂白性(2)若某学生在上述流程中发现某含钙离子盐的化学式为
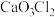 ,试根据盐的定义写出构成这种盐的酸根离子的符号
,试根据盐的定义写出构成这种盐的酸根离子的符号(3)若每一步反应均完全进行,且没有其他副产物,最终
 与
与 的物质的量之比为
的物质的量之比为
您最近一年使用:0次
7 . 高铁酸钾( )是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转化为
)是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转化为 胶体,制备高铁酸钾流程如图所示。
胶体,制备高铁酸钾流程如图所示。

下列叙述不正确的是
 )是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转化为
)是一种环保、高效、多功能饮用水处理剂,在水处理过程中,高铁酸钾转化为 胶体,制备高铁酸钾流程如图所示。
胶体,制备高铁酸钾流程如图所示。
下列叙述不正确的是
A.反应I的化学方程式是 |
B.反应Ⅱ中氧化剂与还原剂的物质的量之比为 |
C.用 溶液吸收反应I中尾气所得产物可再利用 溶液吸收反应I中尾气所得产物可再利用 |
D.用 对饮用水杀菌消毒的同时, 对饮用水杀菌消毒的同时, 胶体吸附杂质净化水 胶体吸附杂质净化水 |
您最近一年使用:0次
名校
解题方法
8 . 有下列三个反应:
①
②
③
下列说法正确的是
①

②

③

下列说法正确的是
A.①②③中的还原产物分别是 、 、 、 、 |
B.在反应③中 做还原剂,每产生 做还原剂,每产生 ,转移电子数目为 ,转移电子数目为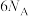 |
C.氧化性: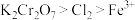 |
| D.反应①中铁元素被还原,反应②铁元素被氧化 |
您最近一年使用:0次
名校
解题方法
9 . 物质的类别和核心元素的化合价是研究物质性质的两个基本视角。请根据如图所示,回答下列问题:

(1)X的化学式为___________ ,W的浓溶液可以干燥氢气,体现其___________ 性。
(2)Y是形成酸雨的主要物质之一,含有Y的尾气可以用过量的NaOH溶液吸收,发生反应的化学方程式为___________ ;另一类硝酸型酸雨主要由人类活动(汽车尾气)产生的 造成的,写出
造成的,写出 与水反应的化学方程式为
与水反应的化学方程式为___________ 。
(3)硫酸钠和Z混和溶液,检验存在硫酸根离子的方法是:___________ 。
(4)火药是中国的“四大发明”之一,硫磺是黑火药的成分之一、黑火药在发生爆炸时,发生如下的反应: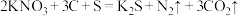 ,生成物中属于非电解质的是
,生成物中属于非电解质的是___________ 。每生成1mol氧化产物,消耗 的质量是
的质量是___________ 克。

(1)X的化学式为
(2)Y是形成酸雨的主要物质之一,含有Y的尾气可以用过量的NaOH溶液吸收,发生反应的化学方程式为
 造成的,写出
造成的,写出 与水反应的化学方程式为
与水反应的化学方程式为(3)硫酸钠和Z混和溶液,检验存在硫酸根离子的方法是:
(4)火药是中国的“四大发明”之一,硫磺是黑火药的成分之一、黑火药在发生爆炸时,发生如下的反应:
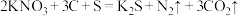 ,生成物中属于非电解质的是
,生成物中属于非电解质的是 的质量是
的质量是
您最近一年使用:0次
10 . 关于反应 ,下列说法正确的是
,下列说法正确的是
 ,下列说法正确的是
,下列说法正确的是A. 中H元素被氧化 中H元素被氧化 | B. 在反应过程中失去电子 在反应过程中失去电子 |
| C.还原剂与氧化剂的质量之比为34∶69 | D.氧化产物与还原产物的质量之比为3∶4 |
您最近一年使用:0次



