1 . 实验室可利用反应: 制备
制备 。设
。设 代表阿伏加德罗常数的值,下列说法正确的是
代表阿伏加德罗常数的值,下列说法正确的是
 制备
制备 。设
。设 代表阿伏加德罗常数的值,下列说法正确的是
代表阿伏加德罗常数的值,下列说法正确的是A.常温常压下,8.7g  和MnS的混合物中含有Mn原子的数目为 和MnS的混合物中含有Mn原子的数目为 |
B.  溶液中含有的离子数为 溶液中含有的离子数为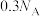 |
C.标准状况下,11.2L  的分子数为 的分子数为 |
D.该反应中生成0.2mol  时,转移的电子数为 时,转移的电子数为 |
您最近一年使用:0次
2 . 若 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是
 表示阿伏加德罗常数的值,下列说法正确的是
表示阿伏加德罗常数的值,下列说法正确的是A.标准状况下,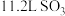 含有的分子数为 含有的分子数为 |
B.32g Cu在足量硫蒸气中完全反应失去的电子数为 |
C.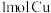 和含有 和含有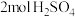 的浓硫酸反应,生成的 的浓硫酸反应,生成的 分子数目为 分子数目为 |
D.常温下,5.6g铁与硝酸反应,失去的电子数一定为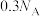 |
您最近一年使用:0次
3 . 利用废旧锂电池可回收金属元素。已知废旧锂离子电池的主要成分为 以及
以及 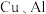 等单质,回收工艺流程如图:
等单质,回收工艺流程如图:
(1)“反萃取”中主要用到的玻璃仪器是_______(填字母)。
(2)“生化反应”后溶液中存在的主要阳离子有 、
、_______ 。“生化反应”最初使用的是 和
和  ,该过程中反应的
,该过程中反应的  与还原剂的物质的量之比为
与还原剂的物质的量之比为_______ ,使用细菌的优点是_______ 。
(3) 萃取率随温度变化如图所示,请解释变化的原因:
萃取率随温度变化如图所示,请解释变化的原因:_______ 。_______ 。
(5) (相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到
(相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到 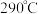 过程中,若生成两种气体,剩余固体的质量为
过程中,若生成两种气体,剩余固体的质量为 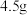 ,所得固体成分为
,所得固体成分为_______ (填化学式)。
(6)金属铜的晶胞如图所示,此晶胞的边长为 ,设
,设  为阿伏加德罗常数的值,则铜晶胞的密度ρ=
为阿伏加德罗常数的值,则铜晶胞的密度ρ=_______ g∙cm-3 (用含  的代数式表示)。
的代数式表示)。
 以及
以及 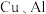 等单质,回收工艺流程如图:
等单质,回收工艺流程如图: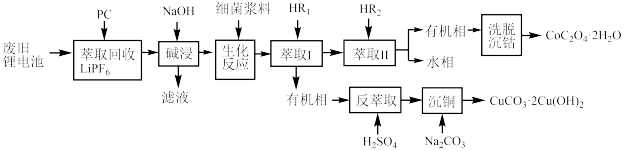
(1)“反萃取”中主要用到的玻璃仪器是_______(填字母)。
| A.漏斗 | B.胶头滴管 | C.分液漏斗 | D.蒸馏烧瓶 |
(2)“生化反应”后溶液中存在的主要阳离子有
 、
、 和
和  ,该过程中反应的
,该过程中反应的  与还原剂的物质的量之比为
与还原剂的物质的量之比为(3)
 萃取率随温度变化如图所示,请解释变化的原因:
萃取率随温度变化如图所示,请解释变化的原因: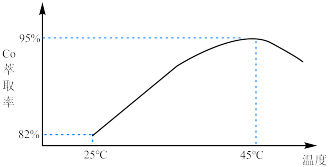
(5)
 (相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到
(相对分子质量为183)经过反复洗涤、干燥后,进行灼烧,加热到 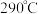 过程中,若生成两种气体,剩余固体的质量为
过程中,若生成两种气体,剩余固体的质量为 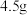 ,所得固体成分为
,所得固体成分为(6)金属铜的晶胞如图所示,此晶胞的边长为
 ,设
,设  为阿伏加德罗常数的值,则铜晶胞的密度ρ=
为阿伏加德罗常数的值,则铜晶胞的密度ρ= 的代数式表示)。
的代数式表示)。
您最近一年使用:0次
解题方法
4 . 氢氧化铈  是淡黄色粉末,具有很好的光学性质、电学性质和催化性能,被广泛应用于气数传感器、燃料电池、催化剂等领域。利用铈矿石[主要成分为
是淡黄色粉末,具有很好的光学性质、电学性质和催化性能,被广泛应用于气数传感器、燃料电池、催化剂等领域。利用铈矿石[主要成分为 ]制备氢氧化铈的流程如图。下列说法
]制备氢氧化铈的流程如图。下列说法错误 的是
 是淡黄色粉末,具有很好的光学性质、电学性质和催化性能,被广泛应用于气数传感器、燃料电池、催化剂等领域。利用铈矿石[主要成分为
是淡黄色粉末,具有很好的光学性质、电学性质和催化性能,被广泛应用于气数传感器、燃料电池、催化剂等领域。利用铈矿石[主要成分为 ]制备氢氧化铈的流程如图。下列说法
]制备氢氧化铈的流程如图。下列说法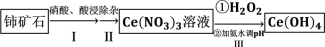
| A.铈是一种常见的稀土元素且属于金属元素 |
B.步骤Ⅰ中发生的反应为 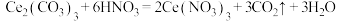 |
| C.步骤Ⅱ中用到的玻璃仪器有漏斗、烧杯、玻璃棒 |
D.步骤Ⅲ中参加反应的氧化剂与还原剂的物质的量之比为 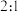 |
您最近一年使用:0次
名校
解题方法
5 . 硒是动物和人体所必需的微量元素之一,也是一种重要的工业原料。河南焦作的山药富含硒( ),有抗癌、抗衰老等重要功能。请回答下列问题。
),有抗癌、抗衰老等重要功能。请回答下列问题。
(1) 的原子结构示意图为
的原子结构示意图为______________ ,其在周期表中的位置为______________ 。
(2)氧、硫、硒位于同一主族,其性质具有一定的递变性。
①下列说法正确的是______________ (填标号)。
A.还原性: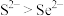
B.浓硒酸可能具有强氧化性、吸水性
C.稳定性: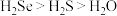
D.氧化性: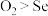
② 通入
通入 的水溶液中会生成不溶于水的
的水溶液中会生成不溶于水的 ,该反应的化学方程式为
,该反应的化学方程式为______________ ; 能与浓硫酸反应生成
能与浓硫酸反应生成 和
和 ,则浓硫酸、
,则浓硫酸、 和
和 三者中,氧化性最弱的为
三者中,氧化性最弱的为______________ 。
(3)某混合物中硒主要以 和
和 的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
ⅰ.将该混合物与浓硫酸混合焙烧,产生 、
、 的烟气
的烟气
ⅱ.用水吸收ⅰ中烟气,可得 固体
固体
已知: 的熔点为315℃,沸点为684.9℃。
的熔点为315℃,沸点为684.9℃。
①可用足量 溶液吸收烟气中的
溶液吸收烟气中的 ,二者反应生成一种盐,该盐的化学式为
,二者反应生成一种盐,该盐的化学式为__________ 。
② 中
中 的化合价为
的化合价为_________ 价;焙烧时, 与浓
与浓 反应的化学方程式为
反应的化学方程式为_________________ ,理论上该反应每转移1 电子,得到的
电子,得到的 的质量为
的质量为_________ g。
 ),有抗癌、抗衰老等重要功能。请回答下列问题。
),有抗癌、抗衰老等重要功能。请回答下列问题。(1)
 的原子结构示意图为
的原子结构示意图为(2)氧、硫、硒位于同一主族,其性质具有一定的递变性。
①下列说法正确的是
A.还原性:
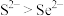
B.浓硒酸可能具有强氧化性、吸水性
C.稳定性:
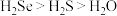
D.氧化性:
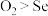
②
 通入
通入 的水溶液中会生成不溶于水的
的水溶液中会生成不溶于水的 ,该反应的化学方程式为
,该反应的化学方程式为 能与浓硫酸反应生成
能与浓硫酸反应生成 和
和 ,则浓硫酸、
,则浓硫酸、 和
和 三者中,氧化性最弱的为
三者中,氧化性最弱的为(3)某混合物中硒主要以
 和
和 的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:
的形式存在,工业上常用硫酸化焙烧法提取硒,主要步骤如下:ⅰ.将该混合物与浓硫酸混合焙烧,产生
 、
、 的烟气
的烟气ⅱ.用水吸收ⅰ中烟气,可得
 固体
固体已知:
 的熔点为315℃,沸点为684.9℃。
的熔点为315℃,沸点为684.9℃。①可用足量
 溶液吸收烟气中的
溶液吸收烟气中的 ,二者反应生成一种盐,该盐的化学式为
,二者反应生成一种盐,该盐的化学式为②
 中
中 的化合价为
的化合价为 与浓
与浓 反应的化学方程式为
反应的化学方程式为 电子,得到的
电子,得到的 的质量为
的质量为
您最近一年使用:0次
2024-04-21更新
|
224次组卷
|
3卷引用:广西壮族自治区百所名校2023-2024学年高一下学期3月联合考试化学试题
6 . 钛酸亚铁通过以下反应转化为TiCl4: 。设NA为阿伏加德罗常数的值,下列说法正确的是
。设NA为阿伏加德罗常数的值,下列说法正确的是
 。设NA为阿伏加德罗常数的值,下列说法正确的是
。设NA为阿伏加德罗常数的值,下列说法正确的是| A.12g金刚石中含有C—C键数为4 NA |
| B.标准状况下1.12L CO含有质子数为0.7 NA |
| C.每生成2mol TiCl4转移电子数为12 NA |
| D.1L 0.1mol/L的FeCl3溶液中,阳离子数目为0.1 NA |
您最近一年使用:0次
名校
解题方法
7 . 数形结合思想是化学学科的重要思维模式。如图为硫元素的“价—类”二维图,涉及H2S、S、X、Y、Z、M、N七种物质,请结合所学知识和图像使用正确的化学用语来作答:_____ 周期第_____ 族。
(2)从硫元素的化合价角度分析,图中所示物质既有氧化性又有还原性的氧化物是______ (填化学式),写出其与酸性高锰酸钾溶液反应的离子方程式________ 。
(3)常温下,以上不能被Z的浓溶液干燥的气体是______ (填化学式),原因是(写化学方程式)_____ 。
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是______ (填代号)。
a.Na2SO3+Na2SO4 b.Na2S+S c.Na2SO3+S d.SO2+Na2SO4
(5)X和H2S发生化学反应,氧化产物和还原产物的物质的量之比为____ 。
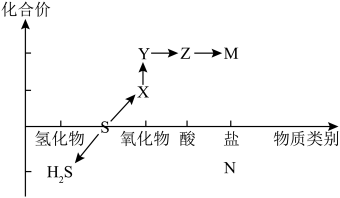
(2)从硫元素的化合价角度分析,图中所示物质既有氧化性又有还原性的氧化物是
(3)常温下,以上不能被Z的浓溶液干燥的气体是
(4)Na2S2O3是重要的化工原料。从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是
a.Na2SO3+Na2SO4 b.Na2S+S c.Na2SO3+S d.SO2+Na2SO4
(5)X和H2S发生化学反应,氧化产物和还原产物的物质的量之比为
您最近一年使用:0次
名校
解题方法
8 . 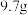 只含有
只含有 和
和 的合金与一定量的稀硝酸反应,固体完全溶解且无硝酸剩余,常温常压下得到只含有
的合金与一定量的稀硝酸反应,固体完全溶解且无硝酸剩余,常温常压下得到只含有 、
、 的混合气体甲
的混合气体甲 (常温常压下,
(常温常压下,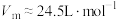 )。将生成的
)。将生成的 、
、 与
与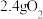 同时通入水中,气体恰好被全部吸收。将吸收气体后的溶液稀释为
同时通入水中,气体恰好被全部吸收。将吸收气体后的溶液稀释为 ,得到溶液乙。下列说法正确的是
,得到溶液乙。下列说法正确的是
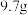 只含有
只含有 和
和 的合金与一定量的稀硝酸反应,固体完全溶解且无硝酸剩余,常温常压下得到只含有
的合金与一定量的稀硝酸反应,固体完全溶解且无硝酸剩余,常温常压下得到只含有 、
、 的混合气体甲
的混合气体甲 (常温常压下,
(常温常压下,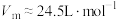 )。将生成的
)。将生成的 、
、 与
与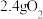 同时通入水中,气体恰好被全部吸收。将吸收气体后的溶液稀释为
同时通入水中,气体恰好被全部吸收。将吸收气体后的溶液稀释为 ,得到溶液乙。下列说法正确的是
,得到溶液乙。下列说法正确的是A.原合金中, 和 和 的物质的量之比为 的物质的量之比为 |
B.生成的混合气体甲的总质量为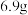 |
C.溶液乙中,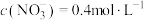 |
D.原硝酸溶液中含有 的物质的量为 的物质的量为 |
您最近一年使用:0次
2024-03-27更新
|
159次组卷
|
7卷引用:广西壮族自治区百所名校2023-2024学年高一下学期3月联合考试化学试题
9 . 一种电化学还原制氨气的反应为: ,
, 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是
 ,
, 为阿伏加德罗常数的值,下列说法正确的是
为阿伏加德罗常数的值,下列说法正确的是A.常温常压下,28g 中含有的 中含有的 键数目为 键数目为 |
B.标准状况下,22.4L 中氢原子的数目为 中氢原子的数目为 |
C.1L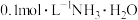 溶液的pH为13 溶液的pH为13 |
D.每生成3mol ,理论上电子转移的数目为 ,理论上电子转移的数目为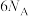 |
您最近一年使用:0次
10 .  是一种重要的消毒剂,在日常生活中应用广泛。
是一种重要的消毒剂,在日常生活中应用广泛。
(1) 在水溶液中的电离方程式是
在水溶液中的电离方程式是_______ 。
(2)使用 溶液时经常滴加稀硫酸,目的是
溶液时经常滴加稀硫酸,目的是_______ 。
(3)实验室中要配制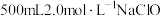 溶液。
溶液。
①实验中用到的玻璃仪器是烧杯、玻璃棒、_______ ;
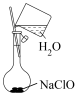
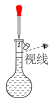
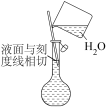
②配制溶液的过程中一些操作如下图所示:
关于上述操作的说法正确的是_______ 。
A.溶解 固体的操作如图①所示
固体的操作如图①所示
B.定容时的操作如图②所示
C.定容时的操作可用图③表示
D.定容时向容量瓶内加蒸馏水至接近刻度线 时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
(4)下列操作能使所配制溶液浓度偏低的是_______。
(5)洁厕灵(主要成分是盐酸)与“84”消毒液混合使用发生下列反应: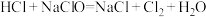 ,该反应的氧化剂是
,该反应的氧化剂是______ ,反应过程中生成标准状况下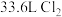 ,转移电子数是
,转移电子数是_____ 。
 是一种重要的消毒剂,在日常生活中应用广泛。
是一种重要的消毒剂,在日常生活中应用广泛。(1)
 在水溶液中的电离方程式是
在水溶液中的电离方程式是(2)使用
 溶液时经常滴加稀硫酸,目的是
溶液时经常滴加稀硫酸,目的是(3)实验室中要配制
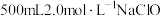 溶液。
溶液。①实验中用到的玻璃仪器是烧杯、玻璃棒、
②配制溶液的过程中一些操作如下图所示:
 |  |  |
| ① | ② | ③ |
A.溶解
 固体的操作如图①所示
固体的操作如图①所示B.定容时的操作如图②所示
C.定容时的操作可用图③表示
D.定容时向容量瓶内加蒸馏水至接近刻度线
 时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切(4)下列操作能使所配制溶液浓度偏低的是_______。
| A.称量固体时物码反放 | B.使用的容量瓶不干燥 |
| C.称量时使用有油污的砝码 | D.定容摇匀后液面下降又加水 |
(5)洁厕灵(主要成分是盐酸)与“84”消毒液混合使用发生下列反应:
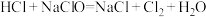 ,该反应的氧化剂是
,该反应的氧化剂是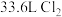 ,转移电子数是
,转移电子数是
您最近一年使用:0次



