1 . 土壤中硝酸盐会被细菌分解。有一种脱氧硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理如下:
___________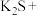 ___________
___________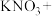 ___________
___________ ___________
___________ ___________
___________ ___________KOH
___________KOH
①配平反应方程式,并标出电子转移的方向和数目。___________
②上述反应___________ 元素被氧化,发生氧化反应的物质是___________ 。若生成
 ,转移电子数为
,转移电子数为___________ 个。
___________
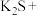 ___________
___________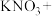 ___________
___________ ___________
___________ ___________
___________ ___________KOH
___________KOH①配平反应方程式,并标出电子转移的方向和数目。
②上述反应

 ,转移电子数为
,转移电子数为
您最近一年使用:0次
名校
2 . 过量使用尿素[CO(NH2)2]会造成水体中氨氮(以 表示)浓度过量,造成水体富营养化,可用
表示)浓度过量,造成水体富营养化,可用 在酸性环境下将其氧化为无害气体除法
在酸性环境下将其氧化为无害气体除法
(1)写出上述反应的离子方程式。___________ 。
(2)若收集到标况下 气体,转移电子的数目为
气体,转移电子的数目为___________ 。
(3)氨氮去除率随 的不断通入先升高后降低,原因是
的不断通入先升高后降低,原因是___________ 。
(4)某废水中氨氮浓度(以 计)为
计)为 ,通入
,通入 ,氨氮去除率为
,氨氮去除率为 。已知氮元素只被氧化为
。已知氮元素只被氧化为 ,则处理每升废水消耗
,则处理每升废水消耗 质量为
质量为______ ?(写出计算过程)
 表示)浓度过量,造成水体富营养化,可用
表示)浓度过量,造成水体富营养化,可用 在酸性环境下将其氧化为无害气体除法
在酸性环境下将其氧化为无害气体除法(1)写出上述反应的离子方程式。
(2)若收集到标况下
 气体,转移电子的数目为
气体,转移电子的数目为(3)氨氮去除率随
 的不断通入先升高后降低,原因是
的不断通入先升高后降低,原因是(4)某废水中氨氮浓度(以
 计)为
计)为 ,通入
,通入 ,氨氮去除率为
,氨氮去除率为 。已知氮元素只被氧化为
。已知氮元素只被氧化为 ,则处理每升废水消耗
,则处理每升废水消耗 质量为
质量为
您最近一年使用:0次
名校
3 . 过氧化钠( ,其中氧元素显
,其中氧元素显 价)和水的反应:
价)和水的反应: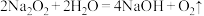 。用
。用 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是
 ,其中氧元素显
,其中氧元素显 价)和水的反应:
价)和水的反应: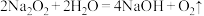 。用
。用 表示阿伏加德罗常数,下列说法正确的是
表示阿伏加德罗常数,下列说法正确的是A.每转移 个电子生成氧化产物1mol 个电子生成氧化产物1mol |
B.22.4L 含 含 个氧原子 个氧原子 |
C. 既是氧化产物又是还原产物 既是氧化产物又是还原产物 |
D.4gNaOH溶于100mL水中,所得溶液的物质的量浓度为 |
您最近一年使用:0次
名校
解题方法
4 . 钠、铝等金属及其材料在人类文明进步和社会发展中发挥了重要的作用。
(1)请用一个离子方程式说明钠与铝的金属性强弱___________ 。
(2)叠氮化钠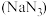 是一种无色结晶,其固体中正负离子的个数比为
是一种无色结晶,其固体中正负离子的个数比为 ,则该固体中含有的化学键是
,则该固体中含有的化学键是___________ (填化学键名称)。叠氮化钠受撞击完全分解产生钠和氮气,故可应用于汽车安全气囊。若产生40.32L(标准状况下)氮气,至少需要叠氮化钠___________ g。
(3)在含0.1molNaOH的溶液中不断地通入 ,得到溶质的质量为8.35g,则烧杯中生产的溶质是
,得到溶质的质量为8.35g,则烧杯中生产的溶质是___________ 。溶质的物质的量是___________ 。
(4)高锰酸根离子 水对人体危害极大,可用过碳酸钠
水对人体危害极大,可用过碳酸钠 改性赤泥进行处理,反应如下:
改性赤泥进行处理,反应如下:
___________ ___________
___________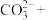 ___________
___________ ___________
___________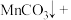 ___________
___________ ___________
___________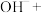 ___________H2O
___________H2O
补全并配平上述化学反应过程式___________ ;反应中,过碳酸钠起沉淀剂和___________ 剂作用;若将1L含Mn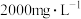 的含高锰酸根离子的废水处理至含Mn
的含高锰酸根离子的废水处理至含Mn ,则转移电子数为
,则转移电子数为___________ mol(保留2位小数)。
(1)请用一个离子方程式说明钠与铝的金属性强弱
(2)叠氮化钠
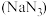 是一种无色结晶,其固体中正负离子的个数比为
是一种无色结晶,其固体中正负离子的个数比为 ,则该固体中含有的化学键是
,则该固体中含有的化学键是(3)在含0.1molNaOH的溶液中不断地通入
 ,得到溶质的质量为8.35g,则烧杯中生产的溶质是
,得到溶质的质量为8.35g,则烧杯中生产的溶质是(4)高锰酸根离子
 水对人体危害极大,可用过碳酸钠
水对人体危害极大,可用过碳酸钠 改性赤泥进行处理,反应如下:
改性赤泥进行处理,反应如下:___________
 ___________
___________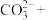 ___________
___________ ___________
___________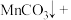 ___________
___________ ___________
___________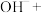 ___________H2O
___________H2O补全并配平上述化学反应过程式
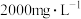 的含高锰酸根离子的废水处理至含Mn
的含高锰酸根离子的废水处理至含Mn ,则转移电子数为
,则转移电子数为
您最近一年使用:0次
名校
5 . 设计了下图所示的实验装置模拟工业生产制备少量硝酸。___________ (填“吸热”或“放热”),反应的化学方程式是___________ 。
(2)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。红棕色气体的化学式是___________ ,白烟的化学式是___________ 。
②欲使氨气尽可能完全转化为硝酸,理论上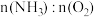 的最佳比例为
的最佳比例为___________ 。
(3)下图中制取氨气的装置和选用的试剂,合理的是(填字母)___________。
(4)实验室制备氨气的化学方程式是___________ 。
(5)用4mol/L稀硝酸与2mol/L稀硫酸的混合液10mL与2.56gCu反应,反应完毕后可生成标准状况下气体的体积是___________ L。
(2)控制氨气和氧气的比例是制备硝酸的关键。
①当比例不合适时,A中不仅有红棕色气体产生,还伴有白烟。红棕色气体的化学式是
②欲使氨气尽可能完全转化为硝酸,理论上
 的最佳比例为
的最佳比例为(3)下图中制取氨气的装置和选用的试剂,合理的是(填字母)___________。

| A.①② | B.②③ | C.②④ | D.①③ |
(4)实验室制备氨气的化学方程式是
(5)用4mol/L稀硝酸与2mol/L稀硫酸的混合液10mL与2.56gCu反应,反应完毕后可生成标准状况下气体的体积是
您最近一年使用:0次
2024-04-30更新
|
137次组卷
|
2卷引用:上海市行知中学2023-2024学年高一下学期期中考试 化学试卷
解题方法
6 . 物质的形成与氧化还原反应的发生
英国科学家道尔顿是近代原子学说的创始人。他认为物质是由原子构成的,这些是不可分割的实心球体,同种原子的质量和性质相同。意大利科学家阿伏加德罗提出了分子的概念,指出了分子和原子的区别与联系。
构成物质的微粒之间通过不同性质和强度的作用力即化学键相互作用形成了具有特定组成的、性质各异的物质。
氧化还原反应是指在反应前后元素的氧化数有相应升降变化的化学反应。其由氧化反应和还原反应构成,并遵守电荷守恒定律。
氧化还原反应广泛应用于工业、农业、生物、能源等领域。例如,煤炭、石油、天然气等燃料的燃烧,植物的呼吸作用、光合作用,化学电池的制造,金属冶炼,火箭发射,施入土壤后化肥的变化等都与该反应息息相关。因此,认识氧化还原反应的实质与规律,对人类的生产和生活都具有非常重要的意义。
1.据报道,某医院正在研究用放射性同位素碘 治疗肿瘤。该核素原子核外电子数是_________。
治疗肿瘤。该核素原子核外电子数是_________。
2.下列物质中,不可能含有离子键的是_________。
3.用化学用语表示化学方程式2Na+2H2O=2NaOH+H2↑中的相关徼粒,正确的是_________。
4.已知元素A的+1价的正离子核外没有电子,元素B的-2价的负离子的电子层结构与Ne原子相同。
①写出元素符号:A为___________ ;B为___________ 。
②A、B两元素结合成的一种常见的三原子化合物的分子式是___________ ,属于___________ 化合物。
③AlCl3是一种常用的氯化物,认识其结构有利于开发新的含氯元素的化合物。经实验测定,AlCl3在2.02×105Pa时熔点为190℃,且在180℃时即升华。据此性质推测,AlCl3应该属于___________ 选填“离子”或“共价”化合物。由此可知构成AlCl3固体的微粒是___________ 。
5.已知铜能与浓硝酸反应,化学方程式为:Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
①用单线桥标出上述反应的电子转移的方向和数目___________ ;
Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
②上述反应中氧化剂是___________ 填序号,被还原的元素是___________ 填序号;
a. Cu b.HNO3 c. +5价的N元素 d.0价的Cu元素
③写出该反应的离子方程式___________ 。
④0.3molCu被硝酸完全溶解后,被还原的硝酸是___________ mol,产生NO2气体的体积为___________ L标准状况下不考虑NO2与水的反应。
英国科学家道尔顿是近代原子学说的创始人。他认为物质是由原子构成的,这些是不可分割的实心球体,同种原子的质量和性质相同。意大利科学家阿伏加德罗提出了分子的概念,指出了分子和原子的区别与联系。
构成物质的微粒之间通过不同性质和强度的作用力即化学键相互作用形成了具有特定组成的、性质各异的物质。
氧化还原反应是指在反应前后元素的氧化数有相应升降变化的化学反应。其由氧化反应和还原反应构成,并遵守电荷守恒定律。
氧化还原反应广泛应用于工业、农业、生物、能源等领域。例如,煤炭、石油、天然气等燃料的燃烧,植物的呼吸作用、光合作用,化学电池的制造,金属冶炼,火箭发射,施入土壤后化肥的变化等都与该反应息息相关。因此,认识氧化还原反应的实质与规律,对人类的生产和生活都具有非常重要的意义。
1.据报道,某医院正在研究用放射性同位素碘
 治疗肿瘤。该核素原子核外电子数是_________。
治疗肿瘤。该核素原子核外电子数是_________。| A.72 | B.29 | C.53 | D.125 |
| A.CaO | B.NaOH | C.NaCl | D.HCl |
| A.中子数为12的钠原子:12Na | B.F-的结构示意图为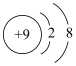 |
C.O的电子式: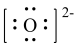 | D.NaOH中只含离子键 |
①写出元素符号:A为
②A、B两元素结合成的一种常见的三原子化合物的分子式是
③AlCl3是一种常用的氯化物,认识其结构有利于开发新的含氯元素的化合物。经实验测定,AlCl3在2.02×105Pa时熔点为190℃,且在180℃时即升华。据此性质推测,AlCl3应该属于
5.已知铜能与浓硝酸反应,化学方程式为:Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
①用单线桥标出上述反应的电子转移的方向和数目
Cu+4HNO3浓=Cu(NO3)2+2NO2↑+2H2O
②上述反应中氧化剂是
a. Cu b.HNO3 c. +5价的N元素 d.0价的Cu元素
③写出该反应的离子方程式
④0.3molCu被硝酸完全溶解后,被还原的硝酸是
您最近一年使用:0次
7 . 实验室用 与浓盐酸共热制备
与浓盐酸共热制备 ,反应如下:
,反应如下: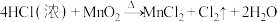
(1)该反应中被氧化的元素是___________ ,还原产物是___________ ;
(2)用单线桥标明电子转移的方向与数目___________ 。
(3)该反应中,氧化剂与还原剂的物质的量之比为___________ (前者比后者);盐酸在反应中表现出来的性质是___________ 。
(4)当生成标准状况下 时,转移的电子数目为
时,转移的电子数目为___________ ,被氧化的还原剂的物质的量为___________ 。
(5)也可以用 和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用
和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用 的原因:
的原因:___________ 。
(6)举例说明氯气的氧化性比硫单质强,___________ 。
 与浓盐酸共热制备
与浓盐酸共热制备 ,反应如下:
,反应如下: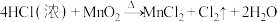
(1)该反应中被氧化的元素是
(2)用单线桥标明电子转移的方向与数目
(3)该反应中,氧化剂与还原剂的物质的量之比为
(4)当生成标准状况下
 时,转移的电子数目为
时,转移的电子数目为(5)也可以用
 和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用
和浓盐酸反应,在常温下制氯气,请从化合价的角度分析,能够使用 的原因:
的原因:(6)举例说明氯气的氧化性比硫单质强,
您最近一年使用:0次
8 . Cu2S与一定浓度的硝酸反应,生成硝酸铜、硫酸铜、二氧化氮、一氧化氮和水,当二氧化氮与一氧化氮的物质的量之比为 时,实际参加反应的硫化亚铜与硝酸的物质的量之比为
时,实际参加反应的硫化亚铜与硝酸的物质的量之比为___________ 。
 时,实际参加反应的硫化亚铜与硝酸的物质的量之比为
时,实际参加反应的硫化亚铜与硝酸的物质的量之比为
您最近一年使用:0次
9 . 焙烧黄铜矿的反应为2CuFeS2+O2 Cu2S+2FeS+SO2,下列说法中正确的是
Cu2S+2FeS+SO2,下列说法中正确的是
 Cu2S+2FeS+SO2,下列说法中正确的是
Cu2S+2FeS+SO2,下列说法中正确的是| A.SO2只是氧化产物 |
| B.CuFeS2仅作还原剂,硫元素被氧化 |
| C.每生成1molCu2S,有4mol硫元素被氧化 |
| D.每转移0.6mol电子,有0.2mol铜元素被还原 |
您最近一年使用:0次
解题方法
10 . 锂在电池领域的消费量最大,被称为“21世纪的能源金属”。
以β-锂辉矿石(主要成分为Li2O·Al2O3·4SiO2,还含有铁、镁、铝及钙的氧化物等杂质)为原料来制取碳酸锂的一种工艺流程如图:
浓硫酸的沸点是330℃。
部分金属离子沉淀的pH如下表:
1.滤渣2的主要成分是_____ ,“除杂2”步骤中氧化剂和还原剂的理论物质的量之比是_____ 。
已知Li2CO3和CaCO3在不同温度下的Ksp:
2.“除杂3”步骤中,原溶液中Ca2+和Li+浓度分别为4.0×10-4mol·L-1和5.0mol·L-1.通过列式计算说明不损失Li+的情况下,Ca2+是否能除尽(工业离子除尽要求是浓度小于1.0×10-6mol·L-1)_____ 。
3.Li2CO3在不同温度下的溶解度是:0℃1.54g,20℃1.33g,80℃0.85g,则系列操作为_____ 。
以β-锂辉矿石(主要成分为Li2O·Al2O3·4SiO2,还含有铁、镁、铝及钙的氧化物等杂质)为原料来制取碳酸锂的一种工艺流程如图:
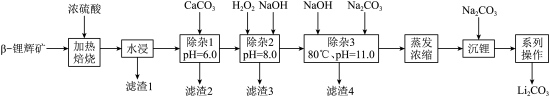
浓硫酸的沸点是330℃。
部分金属离子沉淀的pH如下表:
| 金属离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Ca2+ |
| 开始沉淀时(c=0.01mol/L)的pH | 2.2 | 3.7 | 7.5 | 9.6 | 13.37 |
| 沉淀完全时(c=1.0×10-5mol/L)的pH | 3.2 | 4.7 | 9.0 | 11.0 | — |
已知Li2CO3和CaCO3在不同温度下的Ksp:
| 20℃ | Ksp(Li2CO3)=2.5×10-2 | Ksp (CaCO3)=2.8×10-9 |
| 80℃ | Ksp (Li2CO3)=6.0×10-3 | Ksp (CaCO3)=4.0×10-9 |
3.Li2CO3在不同温度下的溶解度是:0℃1.54g,20℃1.33g,80℃0.85g,则系列操作为
您最近一年使用:0次



