1 . 三氯异氰尿酸[Cl3(CNO)3]是一种高效含氯消毒剂,具有极强的氧化性,是漂白粉的更新换代产品。纯品为白色粉末,微溶于水,遇酸、碱易分解。其粗产品制备原理和相关的实验装置如下:
①尿素热裂解脱氨合成氰尿酸:3CO(NH2)2 3NH3↑+H3(CNO)3(氰尿酸微溶于冷水)
3NH3↑+H3(CNO)3(氰尿酸微溶于冷水)
②碱溶氰尿酸:H3(CNO)3(s)+3NaOH(ag)=Na3(CNO)3(aq)+3H2O(l) ΔH<0
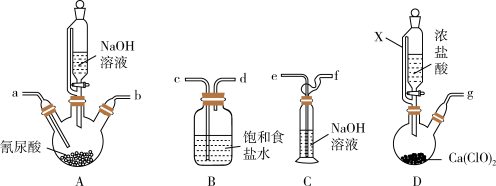
(1)仪器X的支管的作用是____ 。
(2)D装置中反应的化学方程式为____ 。
(3)在A装置中“碱溶氰尿酸”后通入Cl2进行“氯化”制得粗产品,该反应的化学方程式为____ 。
(4)使用上述装置制备三氯异氰尿酸,按气体流向从左至右,导管连接顺序为____ (填字母)。
(5)为了确保产品纯度,A装置中“碱溶氰尿酸”过程中时____ (填实验现象),停止滴加NaOH溶液。
(6)A装置在“氯化”阶段需控制反应温度在10℃-15℃,控制反应温度的实验操作为____ 。
(7)粗产品中Cl3(CNO)3含量测定。将mg粗产品溶于蒸馏水中配制成100mL溶液。取20.00mL所配制溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min后,加入淀粉溶液,用cmol/LNa2S2O3标准溶液进行滴定,滴定至终点消耗vmLNa2S2O3标准溶液。(已知:杂质与KI不反应,涉及的反应为Cl3(CNO)3+6I-+3H+=H3(CNO)3+3I2+3Cl-,I2+2S2O =2I-+S4O
=2I-+S4O )
)
①粗产品中Cl3(CNO)3的百分含量为____ %(用含m,c,V的代数式表示)。
②下列操作将导致测定结果偏低的是____ 。
A.滴定前滴定管中未排气泡,滴定后气泡消失
B.盛装Na2S2O3标准溶液的滴定管未润洗
C.读数时,滴定前平视,滴定后俯视
D.加入KI溶液的量不足
①尿素热裂解脱氨合成氰尿酸:3CO(NH2)2
 3NH3↑+H3(CNO)3(氰尿酸微溶于冷水)
3NH3↑+H3(CNO)3(氰尿酸微溶于冷水)②碱溶氰尿酸:H3(CNO)3(s)+3NaOH(ag)=Na3(CNO)3(aq)+3H2O(l) ΔH<0

(1)仪器X的支管的作用是
(2)D装置中反应的化学方程式为
(3)在A装置中“碱溶氰尿酸”后通入Cl2进行“氯化”制得粗产品,该反应的化学方程式为
(4)使用上述装置制备三氯异氰尿酸,按气体流向从左至右,导管连接顺序为
(5)为了确保产品纯度,A装置中“碱溶氰尿酸”过程中时
(6)A装置在“氯化”阶段需控制反应温度在10℃-15℃,控制反应温度的实验操作为
(7)粗产品中Cl3(CNO)3含量测定。将mg粗产品溶于蒸馏水中配制成100mL溶液。取20.00mL所配制溶液于碘量瓶中,加入适量稀硫酸和过量KI溶液,密封在暗处静置5min后,加入淀粉溶液,用cmol/LNa2S2O3标准溶液进行滴定,滴定至终点消耗vmLNa2S2O3标准溶液。(已知:杂质与KI不反应,涉及的反应为Cl3(CNO)3+6I-+3H+=H3(CNO)3+3I2+3Cl-,I2+2S2O
 =2I-+S4O
=2I-+S4O )
)①粗产品中Cl3(CNO)3的百分含量为
②下列操作将导致测定结果偏低的是
A.滴定前滴定管中未排气泡,滴定后气泡消失
B.盛装Na2S2O3标准溶液的滴定管未润洗
C.读数时,滴定前平视,滴定后俯视
D.加入KI溶液的量不足
您最近一年使用:0次
名校
解题方法
2 . 回答下列问题
(1)金属与硝酸反应通常不能生成H2,用3mol/L HNO3与过量铁粉反应,HNO3的还原产物主要是NO,请写出反应的离子方程式:___________ 。
有同学在查阅文献时发现文献有记载:HNO3与铁反应能产生H2。于是其小组进行了金属铁与硝酸反应能否产生H2及其有利条件的探究。
实验I:20℃,将过量铁粉溶于0.5mol·L-1 HNO3中,立即有无色气体生成,充分反应后,溶液几乎无色。
(2)检验气体:方法如图所示。
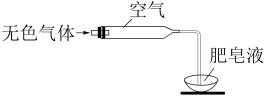
确认气体是H2,不含NO。实验证据是___________ 。
(3)检验溶液:取上层清液,等分两份
①向一份滴加K3[Fe(CN)6]溶液,___________ (填现象),说明含有Fe2+。
②向另一份加入NaOH溶液,产生灰绿色沉淀;加热至沸,有刺激性气味气体逸出,用湿润红色石蕊试纸检验,试纸变蓝。综合①、②,说明实验I中发生的反应有Fe+2H+=Fe2++H2↑,另外还有___________ (写出离子方程式)。
对H2产生的原因提出假设:在稀的酸性溶液中,HNO3中H+的氧化性大于NO ,验证如下:
,验证如下:
(4)实验II:将铜粉溶于0.5mol/L HNO3中。经检测,发现没有___________ 生成,初步证实假设不成立。
(5)再次查阅文献发现:在酸性介质中,尽管电极电势数据显示NO 离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验I,向2mL 0.5mol·L-1 HNO3中加入过量铁粉,结果如下:
离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验I,向2mL 0.5mol·L-1 HNO3中加入过量铁粉,结果如下:
经检验,实验III、IV、V中,NO 的还原产物与实验I相同。
的还原产物与实验I相同。
从反应速率的角度解释温度升高H2体积减少的原因___________ 。
(6)综上所述,有利于金属与硝酸反应生成氢气的条件是___________ 。
(1)金属与硝酸反应通常不能生成H2,用3mol/L HNO3与过量铁粉反应,HNO3的还原产物主要是NO,请写出反应的离子方程式:
有同学在查阅文献时发现文献有记载:HNO3与铁反应能产生H2。于是其小组进行了金属铁与硝酸反应能否产生H2及其有利条件的探究。
实验I:20℃,将过量铁粉溶于0.5mol·L-1 HNO3中,立即有无色气体生成,充分反应后,溶液几乎无色。
(2)检验气体:方法如图所示。

确认气体是H2,不含NO。实验证据是
(3)检验溶液:取上层清液,等分两份
①向一份滴加K3[Fe(CN)6]溶液,
②向另一份加入NaOH溶液,产生灰绿色沉淀;加热至沸,有刺激性气味气体逸出,用湿润红色石蕊试纸检验,试纸变蓝。综合①、②,说明实验I中发生的反应有Fe+2H+=Fe2++H2↑,另外还有
对H2产生的原因提出假设:在稀的酸性溶液中,HNO3中H+的氧化性大于NO
 ,验证如下:
,验证如下:(4)实验II:将铜粉溶于0.5mol/L HNO3中。经检测,发现没有
(5)再次查阅文献发现:在酸性介质中,尽管电极电势数据显示NO
 离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验I,向2mL 0.5mol·L-1 HNO3中加入过量铁粉,结果如下:
离子是个颇强的氧化剂,然而动力学原因导致它在稀酸中的反应一般都很慢。于是小组改变条件重复实验I,向2mL 0.5mol·L-1 HNO3中加入过量铁粉,结果如下:| 实验序号 | Ⅲ | Ⅳ | Ⅴ |
| 温度 | 20℃ | 40℃ | 60℃ |
| 生成H2体积 | 6.0mL | 3.4mL | 2.6mL |
经检验,实验III、IV、V中,NO
 的还原产物与实验I相同。
的还原产物与实验I相同。从反应速率的角度解释温度升高H2体积减少的原因
(6)综上所述,有利于金属与硝酸反应生成氢气的条件是
您最近一年使用:0次
2022-01-19更新
|
1006次组卷
|
6卷引用:甘肃省兰州市西北师范大学附属中学2022-2023学年高三上学期期中考试化学试题
甘肃省兰州市西北师范大学附属中学2022-2023学年高三上学期期中考试化学试题(已下线)第18周 晚练题-备战2022年高考化学周测与晚练(新高考专用)广东省韶关市北江中等职业学校等九校 2021-2022学年高三上学期11月联考化学试题湖北省宜城市第三高级中学2021-2022学年高三上学期期中考试化学试题(已下线)化学(云南,安徽,黑龙江,山西,吉林五省通用B卷)-学易金卷:2023年高考第一次模拟考试卷(已下线)模拟卷03-2023年高三化学对接新高考全真模拟试卷(云南,安徽,黑龙江,山西,吉林五省通用)
名校
解题方法
3 . 碱式硫酸铁[Fe(OH)SO4]是一种絮疑剂,常用于污水处理。工业上利用废铁屑(含少量Al2O3、Fe2O3等)生产碱式硫酸铁的工艺流程如图所示。
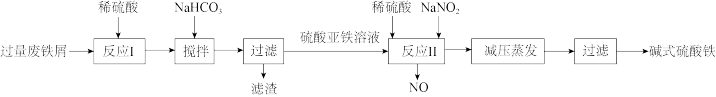
下列说法错误的是

下列说法错误的是
| A.“反应I”后的溶液中主要存在的阳离子有H+、Fe2+、Al3+ |
| B.“反应II”中加入稀硫酸可抑制Fe3+的水解 |
C.“反应II”对应的离子方程式为Fe2++NO +2H+=Fe3++NO↑+H2O +2H+=Fe3++NO↑+H2O |
| D.若用O2代替NaNO2,则每消耗112mL(标准状况)O2相当于节约了2.76gNaNO2 |
您最近一年使用:0次
2022-08-23更新
|
827次组卷
|
3卷引用:甘肃省兰州市西北师范大学附属中学2022-2023学年高三上学期期中考试化学试题
名校
解题方法
4 . 通过下列实验以印刷线路板碱性蚀刻废液(主要成分为[Cu(NH3)4]Cl2)为原料制备还原性物质CuCl。下列说法不正确的是
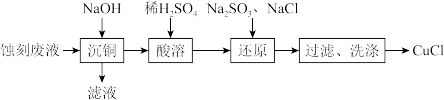

| A.“沉铜”得到的沉淀主要为Cu(OH)2 |
B.“还原”时离子方程式为SO +Cu2++Cl-+H2O=CuCl↓+SO +Cu2++Cl-+H2O=CuCl↓+SO +2H+ +2H+ |
| C.“过滤”、“洗涤”时应该在隔绝空气的条件下进行 |
| D.可循环利用的物质为H2SO4 |
您最近一年使用:0次
2023-11-07更新
|
661次组卷
|
5卷引用:甘肃省兰州第一中学2023-2024学年高三上学期11月期中考试化学试题
甘肃省兰州第一中学2023-2024学年高三上学期11月期中考试化学试题(已下线)题型06 化工微流程-2024年高考化学二轮热点题型归纳与变式演练(新高考通用)宁夏银川市育才中学2023-2024学年高三上学期1月期末理科综合化学试题宁夏银川市西夏区育才中学2023-2024学年高三上学期1月期末化学试题(已下线)专题02 元素化合物 有机化合物-【好题汇编】2024年高考化学一模试题分类汇编(新高考七省专用)
名校
解题方法
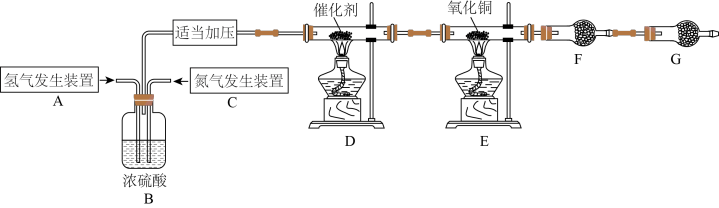
5 . 某学习小组根据氨气还原氧化铜的反应,设计实验测定铜元素相对原子质量Ar(Cu)(近似值)。甲同学模拟合成氨工业制备氨气,反应前先称量反应物氧化铜的质量m(CuO),反应完全后测定生成物水的质量m(H2O),由此计算Ar(Cu)。装置图如下: 。请回答下列问题:
。请回答下列问题:
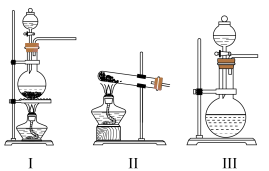
(1)C装置应选用______ (填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)装置B的作用是:①使气体混合均匀;②______ ;③______ 。
(3)氨气还原炽热氧化铜(产物之一为空气中含量最多的气体)化学方程式为____________________ 。
(4)干燥管F中盛放的干燥剂为______(填字母代号)。
(5)G装置的作用是①______ ;②______ 。
若没有G装置,测得结果Ar(Cu)______ (填“偏大”“偏小”或“无影响”)。
(6)乙同学认为上述装置操作麻烦,对原装置改进,新装置如图所示。实验前将石英玻璃管(带两端开关K1和K2)(设为装置C)称重,记为m1 g。将氧化铜装入石英玻璃管中,再次将装置C称重,记为m2 g。按下图连接好装置进行实验,通入NH3,充分反应直至C恒重,记为m3 g。______ (填化学式)
②根据实验记录,计算铜元素相对原子质量Ar(Cu)=______ (用含有m1、m2、m3的式子表示)。
 。请回答下列问题:
。请回答下列问题:(1)C装置应选用
(2)装置B的作用是:①使气体混合均匀;②
(3)氨气还原炽热氧化铜(产物之一为空气中含量最多的气体)化学方程式为
(4)干燥管F中盛放的干燥剂为______(填字母代号)。
| A.五氧化二磷 | B.无水CuSO4 | C.碱石灰 | D.无水CaCl2 |
(5)G装置的作用是①
若没有G装置,测得结果Ar(Cu)
(6)乙同学认为上述装置操作麻烦,对原装置改进,新装置如图所示。实验前将石英玻璃管(带两端开关K1和K2)(设为装置C)称重,记为m1 g。将氧化铜装入石英玻璃管中,再次将装置C称重,记为m2 g。按下图连接好装置进行实验,通入NH3,充分反应直至C恒重,记为m3 g。
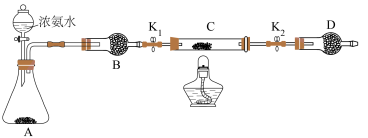
②根据实验记录,计算铜元素相对原子质量Ar(Cu)=
您最近一年使用:0次
2024-03-12更新
|
592次组卷
|
5卷引用:甘肃省兰州第一中学2023-2024学年高一下学期3月月考化学试题
6 . 过二硫酸钾( )是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
)是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
实验(一):探究过二硫酸钾的强氧化性。
探究 溶液与
溶液与 溶液反应,实验操作与现象如下:
溶液反应,实验操作与现象如下:
(1)同学甲用碰撞理论分析,实验Ⅰ中 和
和 反应很慢的主要原因是
反应很慢的主要原因是___________
(2)同学乙猜想实验Ⅱ中 起催化作用,其总反应分两步进行:
起催化作用,其总反应分两步进行:
(ⅰ)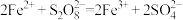 ;(ⅱ)___________。
;(ⅱ)___________。
①补充反应(ⅱ):___________ 。
②请你设计实验证明同学乙的猜想:___________ 。
(3)查阅文献知,氧化性: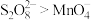 。在稀硫酸酸化的
。在稀硫酸酸化的 溶液中滴加1滴
溶液中滴加1滴 溶液作催化剂,再滴加
溶液作催化剂,再滴加 溶液,实验现象是
溶液,实验现象是___________ ,该反应的离子方程式为___________ 。
实验(二):探究过二硫酸钾的热稳定性。
已知几种气体的熔点、沸点如下表所示:
取适量的 装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
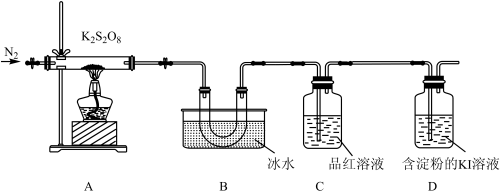
(4)加热之前,先通入一段时间 ,当观察到D中
,当观察到D中___________ (填实验现象)时点燃酒精灯。
(5)B中U形管收集的物质是___________ (填化学式)。
(6)当A中硬质玻璃管中固体完全分解,停止加热,残留的固体产物只有一种。待冷却至室温时取少量残留固体于试管,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。A中 完全分解发生反应的化学方程式为
完全分解发生反应的化学方程式为___________ 。
 )是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。
)是一种白色结晶性粉末,溶于水、不溶于乙醇,具有强氧化性,加热至100℃时会完全分解。某学习小组拟探究过二硫酸钾的性质。实验(一):探究过二硫酸钾的强氧化性。
探究
 溶液与
溶液与 溶液反应,实验操作与现象如下:
溶液反应,实验操作与现象如下:| 实验 | 操作 | 现象 |
| Ⅰ | 在10L含淀粉的 的 的 溶液中滴加 溶液中滴加   溶液 溶液 | 一段时间后,溶液缓慢变蓝 |
| Ⅱ | 在 含淀粉的 含淀粉的 的 的 溶液中先滴几滴 溶液中先滴几滴 的 的 溶液,再滴加 溶液,再滴加   溶液 溶液 | 溶液迅速变蓝 |
 和
和 反应很慢的主要原因是
反应很慢的主要原因是(2)同学乙猜想实验Ⅱ中
 起催化作用,其总反应分两步进行:
起催化作用,其总反应分两步进行:(ⅰ)
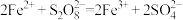 ;(ⅱ)___________。
;(ⅱ)___________。①补充反应(ⅱ):
②请你设计实验证明同学乙的猜想:
(3)查阅文献知,氧化性:
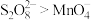 。在稀硫酸酸化的
。在稀硫酸酸化的 溶液中滴加1滴
溶液中滴加1滴 溶液作催化剂,再滴加
溶液作催化剂,再滴加 溶液,实验现象是
溶液,实验现象是实验(二):探究过二硫酸钾的热稳定性。
已知几种气体的熔点、沸点如下表所示:
| 气体 |  |  |  |
| 熔点/℃ | 16.8 | -72.7 | -218.4 |
| 沸点/℃ | 44.8 | -10 | -182.9 |
 装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
装入硬质玻璃管中,加热,将分解产物依次通过装置B、C、D。实验中发现B中U形管内产生无色液体,接着无色液体慢慢变成固体,C中溶液颜色无明显变化,D中溶液逐渐变蓝色。
(4)加热之前,先通入一段时间
 ,当观察到D中
,当观察到D中(5)B中U形管收集的物质是
(6)当A中硬质玻璃管中固体完全分解,停止加热,残留的固体产物只有一种。待冷却至室温时取少量残留固体于试管,加入蒸馏水,溶解后滴加BaCl2溶液和盐酸,产生白色沉淀。A中
 完全分解发生反应的化学方程式为
完全分解发生反应的化学方程式为
您最近一年使用:0次
2022-04-13更新
|
533次组卷
|
5卷引用:甘肃省兰州第一中学2022-2023学年高三上学期期中考试化学试题
甘肃省兰州第一中学2022-2023学年高三上学期期中考试化学试题陕西省榆林市2022届高三第二次联考化学试题(已下线)秘籍21 性质探究实验-备战2022年高考化学抢分秘籍(全国通用)甘肃省平凉市2022届高三下学期第二次模拟考试理科综合化学试题热点1物质性质探究类实验
名校
7 . 下表是元素周期表的一部分,请据表标注的元素回答(用相应的化学符号作答):
(1)形成单质不含化学键的是___________ (填化学式)。
(2)元素a分别与元素e、k、m所形成的简单气态化合物中稳定性最强的是___________ (填化学式);
(3)元素k、m、n最高价氧化物对应的水化物酸性由强到弱的顺序为___________ (用物质化学式表示);
(4)元素g、h、m、n所形成的简单离子的半径由大到小的顺序为___________ (用离子符号表示);
(5)元素d的简单氢化物,与其最高价氧化物的水化物反应的产物,所含化学键的类型有___________
(6)写出由元素a、e、g组成的化合物的电子式:___________ ;
(7)写出由元素b、e组成的化合物be2的结构式:___________ ;
(8)我国长征运载火箭的推进剂是一种由a、b、d三种元素组成的化合物偏二甲肼,其分子式为b2a8d2,与由d、e元素组成的原子个数比为1:2,相对分子质量为92的化合物混合,点火燃烧产生巨大推力,燃烧产物是两种对环境无污染的气体及水蒸气,请写出该类火箭推进剂燃烧的化学方程式:___________ 。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | a | f | ||||||
| 2 | b | d | e | |||||
| 3 | g | h | k | m | n | |||
(2)元素a分别与元素e、k、m所形成的简单气态化合物中稳定性最强的是
(3)元素k、m、n最高价氧化物对应的水化物酸性由强到弱的顺序为
(4)元素g、h、m、n所形成的简单离子的半径由大到小的顺序为
(5)元素d的简单氢化物,与其最高价氧化物的水化物反应的产物,所含化学键的类型有
(6)写出由元素a、e、g组成的化合物的电子式:
(7)写出由元素b、e组成的化合物be2的结构式:
(8)我国长征运载火箭的推进剂是一种由a、b、d三种元素组成的化合物偏二甲肼,其分子式为b2a8d2,与由d、e元素组成的原子个数比为1:2,相对分子质量为92的化合物混合,点火燃烧产生巨大推力,燃烧产物是两种对环境无污染的气体及水蒸气,请写出该类火箭推进剂燃烧的化学方程式:
您最近一年使用:0次
2022-01-03更新
|
440次组卷
|
2卷引用:甘肃省兰州第一中学2021-2022学年高一下学期4月月考化学试题
8 . 已知:还原性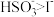 ,氧化性
,氧化性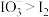 。在含
。在含
 的溶液中逐滴加入
的溶液中逐滴加入 溶液,加入
溶液,加入 和析出
和析出 的物质的量的关系曲线如下图所示。下列说法不正确的是
的物质的量的关系曲线如下图所示。下列说法不正确的是

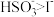 ,氧化性
,氧化性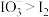 。在含
。在含
 的溶液中逐滴加入
的溶液中逐滴加入 溶液,加入
溶液,加入 和析出
和析出 的物质的量的关系曲线如下图所示。下列说法不正确的是
的物质的量的关系曲线如下图所示。下列说法不正确的是
A. 间发生反应: 间发生反应: |
B.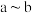 间共消耗 间共消耗 的物质的量为 的物质的量为 |
C.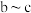 间发生的反应中 间发生的反应中 既是氧化产物,又是还原产物 既是氧化产物,又是还原产物 |
D.当溶液中 与 与 的物质的量之比为 的物质的量之比为 时,加入的 时,加入的 为 为 |
您最近一年使用:0次
名校
解题方法
9 . 厌氧氨氧化(Anammox)法是一种新型的氨氮去除技术,下列说法中正确的是


A.1 mol NH 所含的质子总数为10NA 所含的质子总数为10NA |
B.1 mol NH 经过过程Ⅰ、Ⅱ、Ⅲ,得到氮气的体积约为11.2 L(假设每步转化均完全) 经过过程Ⅰ、Ⅱ、Ⅲ,得到氮气的体积约为11.2 L(假设每步转化均完全) |
C.该方法每处理1 mol NH 需要的NO 需要的NO 为0.5 mol 为0.5 mol |
D.该过程的总反应是NH +NO +NO =N2↑+2H2O =N2↑+2H2O |
您最近一年使用:0次
2022-05-29更新
|
457次组卷
|
13卷引用:甘肃省兰州大学附属中学2022-2023学年高一下学期5月月考(分班考试)化学试题
甘肃省兰州大学附属中学2022-2023学年高一下学期5月月考(分班考试)化学试题【全国百强校】江西省九江第一中学2018-2019学年高一上学期期末考试化学试题江西省山江湖协作体2019-2020学年高一上学期第三次月考(自招班)化学试题(已下线)【南昌新东方】江西省九江市第一中学2018-2019学年高一上学期期末考试化学试题人教版2019必修第二册 第五章 第二~三节综合拔高练江苏省苏州市吴江区震泽中学2020-2021学年高一下学期第一次月考化学试卷浙江省淳安县汾口中学2020-2021学年高一3月月考化学试题安徽省六安市第一中学2021-2022学年高一下学期期中考试化学试题云南省昆明市第三中学2021-2022学年高一下学期期中考试化学试题安徽省亳州市第一中学2022-2023学年高一下学期第一次月考化学试题安徽省阜阳市太和中学2022-2023学年高一下学期第一次质量检测化学试题河北省石家庄市第一中学2022-2023学年高一下学期第一次月考化学试题广东省潮州市饶平县第二中学2020-2021学年高一下学期第一次月考化学试题
名校
解题方法
10 . 对于下列实验,不能正确描述其反应的离子方程式是
A.铝溶于氢氧化钠溶液,有无色气体产生:2Al+2OH-+2H2O=2AlO +3H2↑ +3H2↑ |
| B.向硝酸银溶液中滴加少量碘化钾溶液:Ag++I-=AgI↓ |
C.SO2通入酸性KMnO4溶液中:5SO2+2H2O+2MnO =5SO =5SO +4H++2Mn2+ +4H++2Mn2+ |
D.向次氯酸钙溶液中通入少量二氧化碳气体:ClO-+CO2+H2O=HClO+HCO |
您最近一年使用:0次



