名校
解题方法
1 . 采用废铁屑还原软锰矿(软锰矿主要成分是 ,还含少量
,还含少量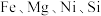 等元素的氧化物杂质)来制备
等元素的氧化物杂质)来制备 的工艺流程如图所示:
的工艺流程如图所示: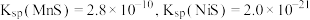 ;
;
②假设溶液中某离子浓度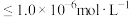 时,该离子沉淀完全;
时,该离子沉淀完全;
③室温时生成氢氧化物的 见下表。
见下表。
回答下列问题:
(1)“酸浸”时,为提高浸取效率,可采取的措施有_____ (任写一点)。
(2)在“浸出液”中加入 时发生反应的离子方程式为
时发生反应的离子方程式为_____ 。
(3)“除杂”过程中有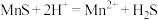 反应发生,其平衡常数
反应发生,其平衡常数 与
与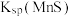 、
、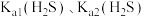 的代数关系式为
的代数关系式为
_____ 。加入 “除杂”后的滤渣为
“除杂”后的滤渣为_____ (填化学式),“除杂”后的滤液中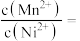
_____ 。
(4)“沉锰”过程中温度和 对
对 和
和 沉淀率的影响如图所示。则“沉锰”的合适条件是
沉淀率的影响如图所示。则“沉锰”的合适条件是_____ 。“沉锰”时发生反应的离子方程式为_____ 。
 ,还含少量
,还含少量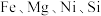 等元素的氧化物杂质)来制备
等元素的氧化物杂质)来制备 的工艺流程如图所示:
的工艺流程如图所示: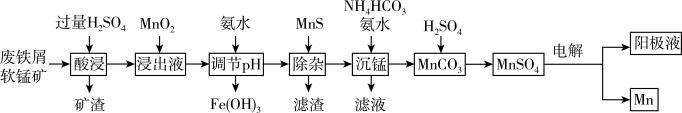
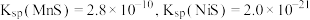 ;
;②假设溶液中某离子浓度
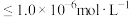 时,该离子沉淀完全;
时,该离子沉淀完全;③室温时生成氢氧化物的
 见下表。
见下表。| 离子 |  |  |  |  |  |
开始沉淀的 | 7.5 | 1.8 | 8.1 | 7.7 | 8.3 |
完全沉淀的 | 9.7 | 3 | 9.4 | 8.4 | 9.8 |
(1)“酸浸”时,为提高浸取效率,可采取的措施有
(2)在“浸出液”中加入
 时发生反应的离子方程式为
时发生反应的离子方程式为(3)“除杂”过程中有
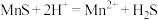 反应发生,其平衡常数
反应发生,其平衡常数 与
与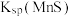 、
、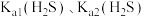 的代数关系式为
的代数关系式为
 “除杂”后的滤渣为
“除杂”后的滤渣为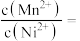
(4)“沉锰”过程中温度和
 对
对 和
和 沉淀率的影响如图所示。则“沉锰”的合适条件是
沉淀率的影响如图所示。则“沉锰”的合适条件是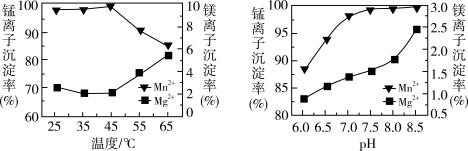
您最近一年使用:0次
2024-03-11更新
|
153次组卷
|
3卷引用:河北省石家庄市河北正定中学2023-2024学年高二下学期第一次月考(3月)化学试题
名校
解题方法
2 . CdS又称镉黄,可用作黄色颜料,也用于制备荧光粉等。以镉铁矿(成分为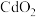 、
、 、FeO及少量的
、FeO及少量的 和
和 )为原料制备CdS的工艺流程如图:
)为原料制备CdS的工艺流程如图:
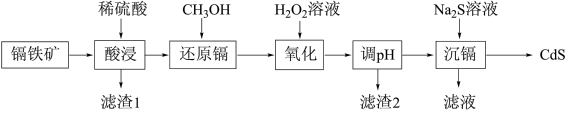
回答下列问题:
(1)Fe在元素周期表中的位置为___________ 。
(2)“滤渣1”的成分是___________ (写化学式)。
(3)“还原镉”时,产生能使澄清石灰水变浑浊的气体,发生反应的离子方程式为___________ 。
(4)加入 溶液的目的是
溶液的目的是___________ 。
(5)实际工业生产中,有时采用阳离子交换树脂法来测定沉镉后溶液中 的含量,其原理是:
的含量,其原理是: ,其中NaR为阳离子交换树脂。常温下,将沉镉后的溶液经过阳离子交换树脂后,测得溶液中的
,其中NaR为阳离子交换树脂。常温下,将沉镉后的溶液经过阳离子交换树脂后,测得溶液中的 比交换前增加了
比交换前增加了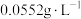 。此时溶液
。此时溶液 ,则该条件下
,则该条件下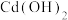 的
的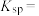
___________ 。
(6)CdS不溶于稀盐酸,可溶于浓盐酸,并生成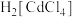 ,反应的化学方程式为
,反应的化学方程式为___________ ;若向反应后的溶液中加水稀释,又出现黄色沉淀,用平衡移动原理解释___________ (已知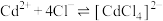 )。
)。
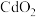 、
、 、FeO及少量的
、FeO及少量的 和
和 )为原料制备CdS的工艺流程如图:
)为原料制备CdS的工艺流程如图:
回答下列问题:
(1)Fe在元素周期表中的位置为
(2)“滤渣1”的成分是
(3)“还原镉”时,产生能使澄清石灰水变浑浊的气体,发生反应的离子方程式为
(4)加入
 溶液的目的是
溶液的目的是(5)实际工业生产中,有时采用阳离子交换树脂法来测定沉镉后溶液中
 的含量,其原理是:
的含量,其原理是: ,其中NaR为阳离子交换树脂。常温下,将沉镉后的溶液经过阳离子交换树脂后,测得溶液中的
,其中NaR为阳离子交换树脂。常温下,将沉镉后的溶液经过阳离子交换树脂后,测得溶液中的 比交换前增加了
比交换前增加了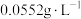 。此时溶液
。此时溶液 ,则该条件下
,则该条件下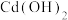 的
的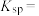
(6)CdS不溶于稀盐酸,可溶于浓盐酸,并生成
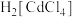 ,反应的化学方程式为
,反应的化学方程式为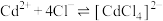 )。
)。
您最近一年使用:0次
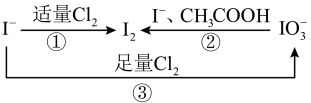
3 . 碘是人体不可缺少的一种微量元素,加碘食盐中的碘元素主要以 的形式存在,
的形式存在, 在一定条件下可发生如图转化,下列说法不正确的
在一定条件下可发生如图转化,下列说法不正确的
 的形式存在,
的形式存在, 在一定条件下可发生如图转化,下列说法不正确的
在一定条件下可发生如图转化,下列说法不正确的
A.①发生反应的离子方程式为: |
B.②发生反应的离子方程式为: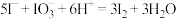 |
C.③发生反应的离子方程式为: |
D.由图可知氧化性的强弱顺序为: |
您最近一年使用:0次
4 . 2023年,我国新能源汽车产销量占全球比重超过60%、连续9年位居世界第一位;新能源汽车出口120.3万辆,这一可喜成绩的获得离不开化学人的辛苦付出.锰酸锂离子蓄电池是第二代锂离子动力电池,性能优良.工业上用某软锰矿(主要成分为 ,还含有少量铁、铝及硅的氧化物)为原料制备锰酸锂
,还含有少量铁、铝及硅的氧化物)为原料制备锰酸锂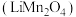 .流程如图:
.流程如图:
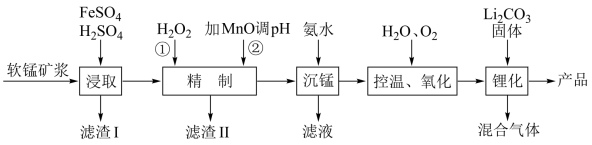
(1)滤渣I的主要成分是___________ 。
(2)已知某离子浓度(用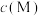 表示)形成沉淀与溶液pH关系,如下图所示
表示)形成沉淀与溶液pH关系,如下图所示
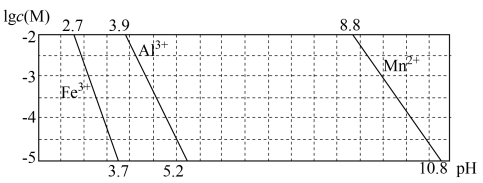
试判断“精制”过程中,加 调节pH的范围是
调节pH的范围是____________ 。
(3)工业上也可以将“精制”后的滤液加入 来合成
来合成 .已知
.已知 的结构式为:
的结构式为: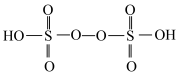 ,其中S的化合价为
,其中S的化合价为____________ .写出该反应的离子方程式_______________
(4)“沉锰”所得溶液回收可用于_____________ 。
(5)“控温、氧化”过程中,溶液温度不宜过高,原因是_______________ 。
(6)“锂化”是将 和
和 按4:1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品.请写出化学反应方程式
按4:1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品.请写出化学反应方程式_____________ 。
 ,还含有少量铁、铝及硅的氧化物)为原料制备锰酸锂
,还含有少量铁、铝及硅的氧化物)为原料制备锰酸锂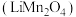 .流程如图:
.流程如图:
(1)滤渣I的主要成分是
(2)已知某离子浓度(用
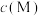 表示)形成沉淀与溶液pH关系,如下图所示
表示)形成沉淀与溶液pH关系,如下图所示
试判断“精制”过程中,加
 调节pH的范围是
调节pH的范围是(3)工业上也可以将“精制”后的滤液加入
 来合成
来合成 .已知
.已知 的结构式为:
的结构式为: ,其中S的化合价为
,其中S的化合价为(4)“沉锰”所得溶液回收可用于
(5)“控温、氧化”过程中,溶液温度不宜过高,原因是
(6)“锂化”是将
 和
和 按4:1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品.请写出化学反应方程式
按4:1的物质的量比配料,球磨3~5h,然后升温至600~750℃,保温24h,自然冷却至室温得产品.请写出化学反应方程式
您最近一年使用:0次
名校
5 . 水合肼(N2H4·H2O)是一种无色透明、具有腐蚀性和强还原性的碱性液体。利用尿素法生产原理为:CO(NH2)2+2NaOH+NaClO=Na2CO3+N2H4·H2O+NaCl。回答下列问题:
实验一:制取水合肼(实验装置如图所示)

(1)①直形冷凝管冷却水的进水口为___________ (用“a”或“b”作答)。
②反应过程中需控制温度,同时将A中溶液缓慢滴入三颈烧瓶,若滴速过快则会导致产品产率降低。仪器A中盛装的溶液是___________ (填字母)。
a.NaOH和NaClO溶液 b.CO(NH2)2溶液
用化学方程式解释产率降低的原因:___________ 。
③充分反应后,加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分
实验二:测定馏分中水合肼(N2H4·H2O)含量
(2)称取馏分0.50g配成250mL待测溶液,取25mL待测溶液加入20.00mL0.1000mol/L单质碘的溶液,再加入适量NaHCO3固体调节pH,待水合肼完全转化为N2后,加盐酸调节溶液pH并加入少量淀粉溶液,立即用0.0200mol/LNa2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液的体积为20.00mL。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O,I2+2S2O =2I-+S4O
=2I-+S4O 。)
。)
①滴定时,Na2S2O3溶液盛放在___________ (填“酸式”或“碱式”)滴定管中,本实验滴定终点的现象为___________ 。
②若滴定管用蒸馏水洗涤后,未润洗直接盛放Na2S2O3溶液,最终测得水合肼的纯度会___________ (填“偏低”、“偏高”或“无影响”)。
③馏分中水合肼(N2H4·H2O)的纯度为___________ 。
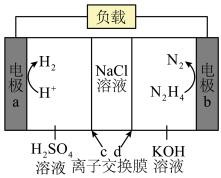
(3)我国科学家以肼(N2H4)为原料设计的新型电池能同时实现H₂制备和海水淡化,装置如图。写出b的电极反应方程式___________ ,离子交换膜c是___________ (填“阴”或“阳”)离子交换膜。
(4)抽滤如图所示,与用普通漏斗过滤相比,抽滤的优点___________ ;其最佳操作顺序是___________ ,确认抽干(填标号)。
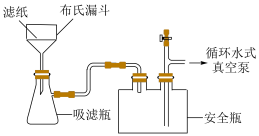
a.打开循环水式真空泵 b.加入少量蒸馏水润湿滤纸 c.转移固液混合物
实验一:制取水合肼(实验装置如图所示)

(1)①直形冷凝管冷却水的进水口为
②反应过程中需控制温度,同时将A中溶液缓慢滴入三颈烧瓶,若滴速过快则会导致产品产率降低。仪器A中盛装的溶液是
a.NaOH和NaClO溶液 b.CO(NH2)2溶液
用化学方程式解释产率降低的原因:
③充分反应后,加热蒸馏三颈烧瓶内的溶液,收集108~114℃馏分
实验二:测定馏分中水合肼(N2H4·H2O)含量
(2)称取馏分0.50g配成250mL待测溶液,取25mL待测溶液加入20.00mL0.1000mol/L单质碘的溶液,再加入适量NaHCO3固体调节pH,待水合肼完全转化为N2后,加盐酸调节溶液pH并加入少量淀粉溶液,立即用0.0200mol/LNa2S2O3溶液滴定至终点。进行三次平行实验,测得平均消耗Na2S2O3溶液的体积为20.00mL。(已知:N2H4·H2O+2I2=N2↑+4HI+H2O,I2+2S2O
 =2I-+S4O
=2I-+S4O 。)
。)①滴定时,Na2S2O3溶液盛放在
②若滴定管用蒸馏水洗涤后,未润洗直接盛放Na2S2O3溶液,最终测得水合肼的纯度会
③馏分中水合肼(N2H4·H2O)的纯度为
(3)我国科学家以肼(N2H4)为原料设计的新型电池能同时实现H₂制备和海水淡化,装置如图。写出b的电极反应方程式

(4)抽滤如图所示,与用普通漏斗过滤相比,抽滤的优点

a.打开循环水式真空泵 b.加入少量蒸馏水润湿滤纸 c.转移固液混合物
您最近一年使用:0次
名校
6 . 工业上以钛铁矿( ,其中Fe为+2价)为主要原料制备金属钛的工艺流程如下图(左)所示,下列说法不正确的是
,其中Fe为+2价)为主要原料制备金属钛的工艺流程如下图(左)所示,下列说法不正确的是
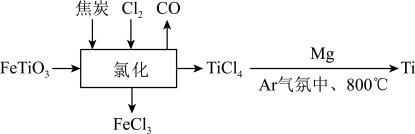

 ,其中Fe为+2价)为主要原料制备金属钛的工艺流程如下图(左)所示,下列说法不正确的是
,其中Fe为+2价)为主要原料制备金属钛的工艺流程如下图(左)所示,下列说法不正确的是

| A.为加快“氯化”速率,可将钛铁矿粉碎并与焦炭混合均匀 |
B.“氯化”过程发生的反应: |
| C.理论上,每制得1molTi,需要2molMg |
| D.在高温超导领域中,钛可以合成钙钛矿,其晶胞如上图(右)所示,该晶体中每个钛离子周围与它最近且相等距离的钛离子有4个 |
您最近一年使用:0次
名校
7 . 能正确表示下列反应的离子方程式是
A.将Na2O2固体投入H218O中: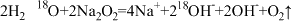 |
B.NaClO溶液中通入少量SO2: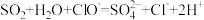 |
C.饱和Na2CO3溶液中通入过量CO2: |
D.四氧化三铁溶于稀硝酸中: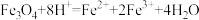 |
您最近一年使用:0次
2024-03-09更新
|
447次组卷
|
4卷引用:重庆市大足中学2023-2024学年高三下学期3月适应性考试化学试题
名校
8 . 完成下列问题
(1)消除汽车尾气中的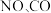 ,有利于减少
,有利于减少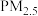 的排放。已知如下信息:
的排放。已知如下信息: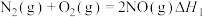

①
___________ 。
②在催化剂作用下 和
和 转化为无毒气体,写出反应的热化学方程式
转化为无毒气体,写出反应的热化学方程式___________ 。
(2)测定汽车尾气常用的方法有两种。
①方法1:电化学气敏传感器法。其中 传感器的工作原理如图所示,则工作电极的电极反应式为
传感器的工作原理如图所示,则工作电极的电极反应式为___________ 。 溶液吸收尾气,将氮氧化物转化为硝酸,用酸碱中和滴定法测定硝酸浓度。写出
溶液吸收尾气,将氮氧化物转化为硝酸,用酸碱中和滴定法测定硝酸浓度。写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式___________ 。
(3)中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分 )可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。查文献得知,可以从硫化砷(As2S3)废渣中提取
)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。查文献得知,可以从硫化砷(As2S3)废渣中提取 ,提取的工艺流程简图如下:
,提取的工艺流程简图如下: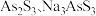 中的S均为-2价,碱浸过程中发生的反应
中的S均为-2价,碱浸过程中发生的反应___________ (填“是”或“是”)氧化还原反应。
②写出过程Ⅲ的离子方程式___________ 。
(4)亚砷酸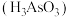 也可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液
也可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液 关系如下图所示。
关系如下图所示。 在
在 之间,用药后人体中含砷元素的主要微粒是
之间,用药后人体中含砷元素的主要微粒是___________ 。
②将 溶液滴入亚砷酸溶液,当
溶液滴入亚砷酸溶液,当 调至11时发生反应的离子方程式是
调至11时发生反应的离子方程式是___________ 。
(1)消除汽车尾气中的
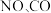 ,有利于减少
,有利于减少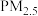 的排放。已知如下信息:
的排放。已知如下信息:Ⅰ.
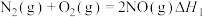

①

②在催化剂作用下
 和
和 转化为无毒气体,写出反应的热化学方程式
转化为无毒气体,写出反应的热化学方程式(2)测定汽车尾气常用的方法有两种。
①方法1:电化学气敏传感器法。其中
 传感器的工作原理如图所示,则工作电极的电极反应式为
传感器的工作原理如图所示,则工作电极的电极反应式为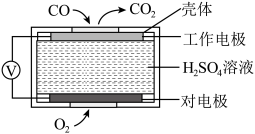
 溶液吸收尾气,将氮氧化物转化为硝酸,用酸碱中和滴定法测定硝酸浓度。写出
溶液吸收尾气,将氮氧化物转化为硝酸,用酸碱中和滴定法测定硝酸浓度。写出 与
与 溶液反应的离子方程式
溶液反应的离子方程式(3)中药在世界医学界越来越受到关注。中药药剂砒霜(主要成分
 )可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。查文献得知,可以从硫化砷(As2S3)废渣中提取
)可用于治疗急性白血病,为此,砷及其化合物的提取再次引起关注。查文献得知,可以从硫化砷(As2S3)废渣中提取 ,提取的工艺流程简图如下:
,提取的工艺流程简图如下:
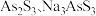 中的S均为-2价,碱浸过程中发生的反应
中的S均为-2价,碱浸过程中发生的反应②写出过程Ⅲ的离子方程式
(4)亚砷酸
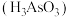 也可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液
也可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液 关系如下图所示。
关系如下图所示。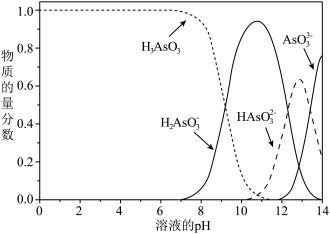
 在
在 之间,用药后人体中含砷元素的主要微粒是
之间,用药后人体中含砷元素的主要微粒是②将
 溶液滴入亚砷酸溶液,当
溶液滴入亚砷酸溶液,当 调至11时发生反应的离子方程式是
调至11时发生反应的离子方程式是
您最近一年使用:0次
2024-03-09更新
|
84次组卷
|
2卷引用:中国人民大学附属中学2023-2024学年高三下学期化学练习6
9 . 废物利用对保护环境、节约资源和带动社会效益起着积极作用。某废旧金属材料主要为铜、铝、铁及其氧化物的混合物,利用该材料得到胆矾的一种流程如下:
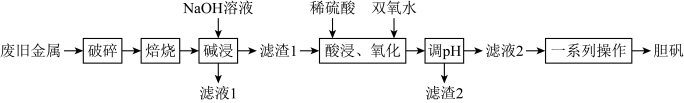
已知:调pH可将Fe2+与Cu2+分离,但不易将Fe2+与Cu2+分离。
请回答下列问题:
(1)流程中“粉碎”的目的是___________ 。
(2)“碱浸”时发生反应的离子方程式为___________ 。
(3)“酸浸”后“氧化”时发生反应的离子方程式为___________ ;该过程温度不宜过高,原因为___________ 。
(4)“滤渣2”的成分为___________ (填化学式);“一系列操作”不能采用直接蒸发结晶的原因为___________ 。
(5)有同学从上述流程中的“氧化”和“调pH”联想到过氧化钠也具有氧化性,且与水反应能生成氢氧化钠。于是向硫酸亚铁溶液中加入一定量的过氧化钠固体,观察到有红褐色固体产生且无气体生成。若过氧化钠与硫酸亚铁反应的物质的量之比为1:2,则该反应的离子方程式为___________ 。

已知:调pH可将Fe2+与Cu2+分离,但不易将Fe2+与Cu2+分离。
请回答下列问题:
(1)流程中“粉碎”的目的是
(2)“碱浸”时发生反应的离子方程式为
(3)“酸浸”后“氧化”时发生反应的离子方程式为
(4)“滤渣2”的成分为
(5)有同学从上述流程中的“氧化”和“调pH”联想到过氧化钠也具有氧化性,且与水反应能生成氢氧化钠。于是向硫酸亚铁溶液中加入一定量的过氧化钠固体,观察到有红褐色固体产生且无气体生成。若过氧化钠与硫酸亚铁反应的物质的量之比为1:2,则该反应的离子方程式为
您最近一年使用:0次
名校
10 . 某课外兴趣小组为拓展对SO2还原性和氧化性的认识,进行了下列两组探究实验。
(1)探究SO2和Fe(NO3)3溶液反应,反应装置如图所示: 的Fe(NO3)3溶液的pH=1;该实验条件下不考虑
的Fe(NO3)3溶液的pH=1;该实验条件下不考虑 被酸性KMnO4溶液氧化。
被酸性KMnO4溶液氧化。
回答下列问题:
①盛装浓硫酸的仪器名称为_______ 。
②Fe(NO3)3的阴离子中,N的sp2杂化轨道与O的2p轨道形成_______ 键。
③如图进行实验,装置B中产生了白色沉淀,其成分是_______ (填化学式)。
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与 反应;
反应;
猜想3:……
④甲同学从装置B中取出少量反应后的溶液,该溶液能使KMnO4溶液褪色。
【得出结论】猜想1成立。该结论正确吗?_______ (填“是”或“否”)。若不正确,理由是_______ (正确无需回答)。
⑤请你设计实验验证猜想2,并完成表中内容(提示: 在不同条件下的还原产物较复杂,有时难以观察到气体产生。除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等。)
在不同条件下的还原产物较复杂,有时难以观察到气体产生。除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等。)
⑥尾气处理装置应选择_______ (填序号)。 水溶液显棕色,
水溶液显棕色,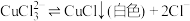
①通过上述两组对比实验,SO2与铜反应的条件是_______ 。
②写出SO2在盐酸中和铜反应的离子方程式:_______ 。
(1)探究SO2和Fe(NO3)3溶液反应,反应装置如图所示:
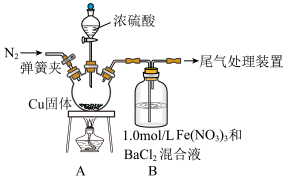
 的Fe(NO3)3溶液的pH=1;该实验条件下不考虑
的Fe(NO3)3溶液的pH=1;该实验条件下不考虑 被酸性KMnO4溶液氧化。
被酸性KMnO4溶液氧化。回答下列问题:
①盛装浓硫酸的仪器名称为
②Fe(NO3)3的阴离子中,N的sp2杂化轨道与O的2p轨道形成
③如图进行实验,装置B中产生了白色沉淀,其成分是
分析B中产生白色沉淀的原因:
猜想1:SO2与Fe3+反应;
猜想2:在酸性条件下SO2与
 反应;
反应;猜想3:……
④甲同学从装置B中取出少量反应后的溶液,该溶液能使KMnO4溶液褪色。
【得出结论】猜想1成立。该结论正确吗?
⑤请你设计实验验证猜想2,并完成表中内容(提示:
 在不同条件下的还原产物较复杂,有时难以观察到气体产生。除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等。)
在不同条件下的还原产物较复杂,有时难以观察到气体产生。除了上述实验提供的试剂外,可供选择的药品有:NaNO3固体和盐酸等。)| 实验步骤 | 预期现象和结论 |
a.配溶液,用NaNO3和盐酸配成pH= 浓度为 浓度为 的溶液,替换装置B中的Fe(NO3)3溶液。 的溶液,替换装置B中的Fe(NO3)3溶液。b.打开弹簧夹,向装置中通入一段时间的N2,关闭弹簧夹。打开分液漏斗活塞,向三颈烧瓶中滴加浓硫酸并加热。 | 若装置B中有白色沉淀生成,猜想2成立。 若装置B中无白色沉淀生成,猜想2不成立。 |
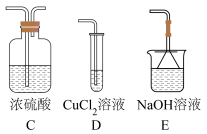
实验I 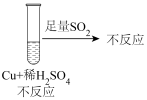
实验Ⅱ 
 水溶液显棕色,
水溶液显棕色,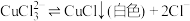
①通过上述两组对比实验,SO2与铜反应的条件是
②写出SO2在盐酸中和铜反应的离子方程式:
您最近一年使用:0次



