1 . Ⅰ.现有下列5种物质:①铝 ;② ;③氢氧化铁胶体;④
;③氢氧化铁胶体;④ ;⑤
;⑤ 。
。
(1)上述物质属于非电解质的是_______ (填序号,下同);属于混合物的是_______ ;可用于治疗胃酸过多的是_______ 。
(2)铝与氢氧化钠反应的化学方程式为_______ 。
(3)制备氢氧化铁胶体的化学方程式为_______ 。
Ⅱ.高铁酸钠( )是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠的一种方法对应的离子方程式为:
)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠的一种方法对应的离子方程式为:
(4)高铁酸钠中铁元素化合价为_______ 。
(5)配平:_______ 。

(6)配制100mL 1.00mol/L NaCl溶液,需要用托盘天平称量_______ g氯化钠,在配制溶液时需要玻璃仪器除了小烧杯、玻璃棒外还需要_______ 。
 ;③氢氧化铁胶体;④
;③氢氧化铁胶体;④ ;⑤
;⑤ 。
。(1)上述物质属于非电解质的是
(2)铝与氢氧化钠反应的化学方程式为
(3)制备氢氧化铁胶体的化学方程式为
Ⅱ.高铁酸钠(
 )是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠的一种方法对应的离子方程式为:
)是一种新型绿色消毒剂,主要用于饮用水处理。工业上制备高铁酸钠的一种方法对应的离子方程式为:
(4)高铁酸钠中铁元素化合价为
(5)配平:

(6)配制100mL 1.00mol/L NaCl溶液,需要用托盘天平称量
您最近一年使用:0次
2 . 历史上纯碱工业的发展经历了三个重要阶段,
Ⅰ.第一阶段是路布兰制碱法,流程如下:_______ 。
(2)“加热融合”过程中还会产生CO,写出该反应的化学方程式_______ 。
Ⅱ.第二和第三阶段分别是索尔维制碱法和侯氏制碱法,两种工艺的差异之一在于对“滤液”的处理方法不同,流程如下:_______ (填“ ”或“
”或“ ”),再通入另一种气体,可析出
”),再通入另一种气体,可析出 固体,该反应的化学方程式为
固体,该反应的化学方程式为_______ 。
(4)索尔维制碱法中能够循环利用的物质有_______ (填化学式)。
(5)制得的纯碱中含有少量NaCl杂质,检验其中 的操作和现象为
的操作和现象为_______ 。
(6)纯碱用途广泛,写出其中一种用途_______ 。
(7)对比索尔维制碱法,侯氏制碱法的优点是_______ (写出一条即可)。
Ⅰ.第一阶段是路布兰制碱法,流程如下:
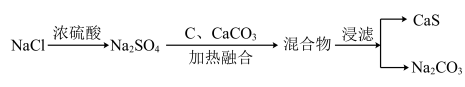
(2)“加热融合”过程中还会产生CO,写出该反应的化学方程式
Ⅱ.第二和第三阶段分别是索尔维制碱法和侯氏制碱法,两种工艺的差异之一在于对“滤液”的处理方法不同,流程如下:
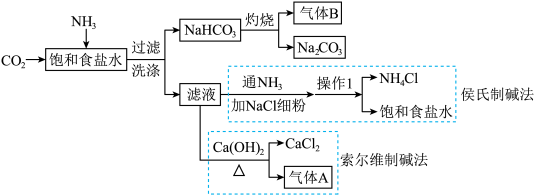
 ”或“
”或“ ”),再通入另一种气体,可析出
”),再通入另一种气体,可析出 固体,该反应的化学方程式为
固体,该反应的化学方程式为(4)索尔维制碱法中能够循环利用的物质有
(5)制得的纯碱中含有少量NaCl杂质,检验其中
 的操作和现象为
的操作和现象为(6)纯碱用途广泛,写出其中一种用途
(7)对比索尔维制碱法,侯氏制碱法的优点是
您最近一年使用:0次
3 . 高铁酸钾( )是一种高效多功能的新型绿色消毒剂,主要用于饮水处理。高铁酸钾具有比高锰酸钾更强的氧化性,且在强碱性溶液中稳定。一种以硝酸铁晶体为原料制备高铁酸钾的工艺如下图所示,有关说法错误的是
)是一种高效多功能的新型绿色消毒剂,主要用于饮水处理。高铁酸钾具有比高锰酸钾更强的氧化性,且在强碱性溶液中稳定。一种以硝酸铁晶体为原料制备高铁酸钾的工艺如下图所示,有关说法错误的是
 )是一种高效多功能的新型绿色消毒剂,主要用于饮水处理。高铁酸钾具有比高锰酸钾更强的氧化性,且在强碱性溶液中稳定。一种以硝酸铁晶体为原料制备高铁酸钾的工艺如下图所示,有关说法错误的是
)是一种高效多功能的新型绿色消毒剂,主要用于饮水处理。高铁酸钾具有比高锰酸钾更强的氧化性,且在强碱性溶液中稳定。一种以硝酸铁晶体为原料制备高铁酸钾的工艺如下图所示,有关说法错误的是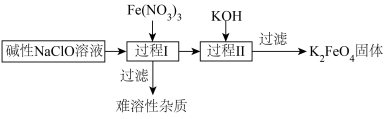
| A.“过程Ⅰ”中氧化剂和还原剂的物质的量之比为3∶2 |
| B.“过程Ⅱ”中用氯化钾代替氢氧化钾也能达到同样的效果 |
C.“过程Ⅱ”中析出 固体的原因是 固体的原因是 在水中的溶解度较小 在水中的溶解度较小 |
| D.高铁酸钾处理水时,既能杀菌、消毒,又能净水 |
您最近一年使用:0次
名校
4 . 三元锂电池主要用于手机、无人机等行业,电池安全性高。电池正极片由镍钴锰酸锂(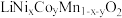 )正极材料和铝片组成,以电池正极片为原料回收各金属的工艺流程如图。
)正极材料和铝片组成,以电池正极片为原料回收各金属的工艺流程如图。________________ (写两种)。
(2)“碱浸”过程中,发生反应的离子方程式为________________ 。
(3)“还原”时, 加入了H2O2写出H2O2的电子式:________________ 。
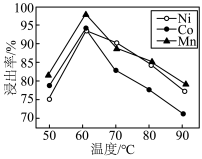
(4)“酸浸、还原”时,保持其他条件相同,搅拌相同时间,测得不同温度下镍、钴、锰的浸出率变化如图所示。60℃时浸出率达到最大,可能的原因是__________________ 。___________ 。
(6)称取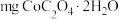 在隔绝空气条件下加热分解,测得固体的失重率(
在隔绝空气条件下加热分解,测得固体的失重率(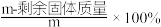 )与温度的关系曲线如图所示。
)与温度的关系曲线如图所示。_________________________ 。
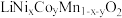 )正极材料和铝片组成,以电池正极片为原料回收各金属的工艺流程如图。
)正极材料和铝片组成,以电池正极片为原料回收各金属的工艺流程如图。
(2)“碱浸”过程中,发生反应的离子方程式为
(3)“还原”时, 加入了H2O2写出H2O2的电子式:
(4)“酸浸、还原”时,保持其他条件相同,搅拌相同时间,测得不同温度下镍、钴、锰的浸出率变化如图所示。60℃时浸出率达到最大,可能的原因是
(6)称取
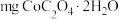 在隔绝空气条件下加热分解,测得固体的失重率(
在隔绝空气条件下加热分解,测得固体的失重率(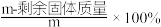 )与温度的关系曲线如图所示。
)与温度的关系曲线如图所示。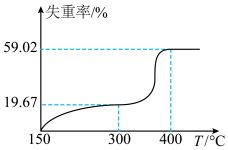
您最近一年使用:0次
名校
解题方法
5 . 氧化还原反应对我们的生产和生活同时具有正负两方面的影响,如果我们能够掌握化学变化的规律,就有可能做到趋利避害,使之更好地为社会发展服务。下面我们逐一分析:
(1)黑火药是我国古代的四大发明之一,黑火药着火时,发生如下氧化还原反应:
 。在此反应中,还原剂为
。在此反应中,还原剂为_______ (填化学式),还原产物是_______ (填化学式),当该反应转移3mol电子时,产生气体的体积为_______ L(标况下)。
(2)湿法制备高铁酸钾( )是在碱性环境中进行,反应体系中有六种反应微粒:
)是在碱性环境中进行,反应体系中有六种反应微粒: 、
、 、
、 、
、 、
、 、
、 。
。
请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:_______ 。
(3)保险粉( )在纺织工业中广泛使用的,其一种制备流程如下:
)在纺织工业中广泛使用的,其一种制备流程如下: 中硫元素的化合价为
中硫元素的化合价为_______ ,合成塔Ⅱ中发生主要反应的化学方程式为_______ 。
(4)汽车剧烈碰撞时,安全气囊中发生反应: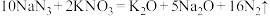 。若反应得到的氧化产物比还原产物多2.8mol,则此过程中转移电子的个数为
。若反应得到的氧化产物比还原产物多2.8mol,则此过程中转移电子的个数为_______ 。
(1)黑火药是我国古代的四大发明之一,黑火药着火时,发生如下氧化还原反应:
 。在此反应中,还原剂为
。在此反应中,还原剂为(2)湿法制备高铁酸钾(
 )是在碱性环境中进行,反应体系中有六种反应微粒:
)是在碱性环境中进行,反应体系中有六种反应微粒: 、
、 、
、 、
、 、
、 、
、 。
。请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:
(3)保险粉(
 )在纺织工业中广泛使用的,其一种制备流程如下:
)在纺织工业中广泛使用的,其一种制备流程如下: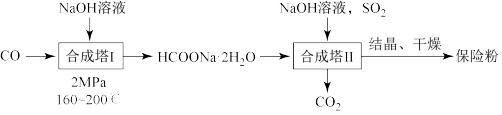
 中硫元素的化合价为
中硫元素的化合价为(4)汽车剧烈碰撞时,安全气囊中发生反应:
 。若反应得到的氧化产物比还原产物多2.8mol,则此过程中转移电子的个数为
。若反应得到的氧化产物比还原产物多2.8mol,则此过程中转移电子的个数为
您最近一年使用:0次
解题方法
6 . 如图为制硝酸的流程图。
(1)工业生产中,物质A应选择_________ (填“空气”或“氧气”)。
(2)下列说法正确的是_________。
(3)以NO2为例,写出尾气处理装置中反应的化学方程式_________ 。
(4)写出足量氨气与光气(COCl2)反应生成尿素[CO(NH2)2]的化学方程式_________ 。
(5)向CuSO4溶液中依次加入氨水和乙醇可得[Cu(NH3)4]SO4⋅H2O晶体,设计实验证明该晶体中含有N元素(已知CuS不溶于氨水)_________ 。
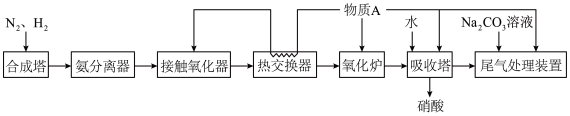
(1)工业生产中,物质A应选择
(2)下列说法正确的是_________。
| A.氨分离器得到的气体可循环使用 |
| B.热交换器可将接触氧化后的气体冷却并预热A |
| C.从氧化炉进入吸收塔的气体主要是NO |
| D.吸收塔中通入A可提高硝酸的产率 |
(3)以NO2为例,写出尾气处理装置中反应的化学方程式
(4)写出足量氨气与光气(COCl2)反应生成尿素[CO(NH2)2]的化学方程式
(5)向CuSO4溶液中依次加入氨水和乙醇可得[Cu(NH3)4]SO4⋅H2O晶体,设计实验证明该晶体中含有N元素(已知CuS不溶于氨水)
您最近一年使用:0次
名校
7 . 碘(紫黑色固体,微溶于水)及其化合物广泛用于医药、染料等方面。回答下列问题:
(1)I2的一种制备方法如下图所示:___________ ,生成的沉淀与硝酸反应,生成___________ 后可循环使用。
②通入Cl2的过程中,若氧化产物只有一种,反应的化学方程式为___________ ;若反应物用量比 时,氧化产物为
时,氧化产物为___________ ;当 ,单质碘的收率会降低,原因是
,单质碘的收率会降低,原因是___________ 。
③“操作I”的目的___________
(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入过量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总反应的离子方程式为___________ 。
(3)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成12.7g I2,消耗的KI至少为___________  。I2在KI溶液中可发生反应
。I2在KI溶液中可发生反应 。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是
。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是___________ 。
(1)I2的一种制备方法如下图所示:
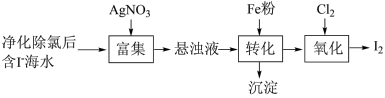
②通入Cl2的过程中,若氧化产物只有一种,反应的化学方程式为
 时,氧化产物为
时,氧化产物为 ,单质碘的收率会降低,原因是
,单质碘的收率会降低,原因是③“操作I”的目的
(2)以NaIO3为原料制备I2的方法是:先向NaIO3溶液中加入过量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反应得到I2,上述制备I2的总反应的离子方程式为
(3)KI溶液和CuSO4溶液混合可生成CuI沉淀和I2,若生成12.7g I2,消耗的KI至少为
 。I2在KI溶液中可发生反应
。I2在KI溶液中可发生反应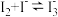 。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是
。实验室中使用过量的KI与CuSO4溶液反应后,过滤,滤液经水蒸气蒸馏可制得高纯碘。反应中加入过量KI的原因是
您最近一年使用:0次
名校
解题方法
8 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示: 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。
回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________ (填化学式)。
(2)水浸渣中主要有SiO2和___________ ,若将该水浸渣溶于NaOH溶液,发生的离子反应方程式为___________ 。
(3)“沉淀”步骤调pH到弱碱性,主要发生的离子反应方程式___________ 。
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致___________ ;pH>9时,会导致___________ 。
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO 或VO3+,在碱性条件下,溶解为VO
或VO3+,在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有___________ (填标号)。
A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为___________ 。
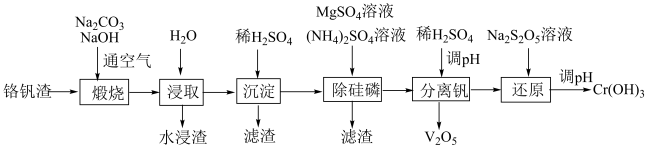
 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。
存在。回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(2)水浸渣中主要有SiO2和
(3)“沉淀”步骤调pH到弱碱性,主要发生的离子反应方程式
(4)“除硅磷”步骤中,使硅、磷分别以MgSiO3和MgNH4PO4的形式沉淀,该步需要控制溶液的pH≈9以达到最好的除杂效果,若pH<9时,会导致
(5)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO
 或VO3+,在碱性条件下,溶解为VO
或VO3+,在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有A.酸性 B.碱性 C.两性
(6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为
您最近一年使用:0次
9 . 氮氧化物(NO、NO2)是当前环境保护研究的热点课题。
(1)氮氧化物大量排放对环境造成的影响有___________ (写出一点)。
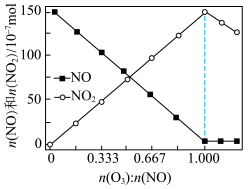
(2)烟气中的NO经O3处理后更易被去除。NO与O3反应的化学方程式为NO+O3=NO2+O2室温下,固定NO的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)和n(NO2)随反应前n(O3):n(NO)|的变化如图所示。当n(O3):n(NO)>1时,反应后NO2的物质的量减少,原因是___________ 。 设计如图所示的方案:
设计如图所示的方案:___________ 。
②装置中每生成2.24L(标准状况)N2,,转移电子的物质的量是___________ mol。
③已知:酸性KMnO4溶液吸收NO后会生成Mn2+、 烧杯中发生反应的离子方程式为
烧杯中发生反应的离子方程式为___________ 。
(4)某含Fe2+化合物的溶液可吸收NO、NO2并使氮氧化物与Fe2+化合物结合。用该溶液处理含NO、NO2的烟气,相同条件下氮氧化物的去除率与烟气中氧气体积分数的关系如图所示。___________ 。与NO相比,NO2更易被溶液吸收去除,原因是___________ 。
②烟气中氧气的体积分数介于2%~8%时,随着O2体积分数的上升,氮氧化物去除率减小,原因是___________ 。
(1)氮氧化物大量排放对环境造成的影响有
(2)烟气中的NO经O3处理后更易被去除。NO与O3反应的化学方程式为NO+O3=NO2+O2室温下,固定NO的物质的量,改变加入O3的物质的量,反应一段时间后体系中n(NO)和n(NO2)随反应前n(O3):n(NO)|的变化如图所示。当n(O3):n(NO)>1时,反应后NO2的物质的量减少,原因是
 设计如图所示的方案:
设计如图所示的方案: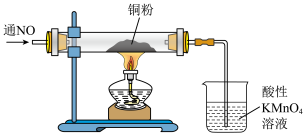
②装置中每生成2.24L(标准状况)N2,,转移电子的物质的量是
③已知:酸性KMnO4溶液吸收NO后会生成Mn2+、
 烧杯中发生反应的离子方程式为
烧杯中发生反应的离子方程式为(4)某含Fe2+化合物的溶液可吸收NO、NO2并使氮氧化物与Fe2+化合物结合。用该溶液处理含NO、NO2的烟气,相同条件下氮氧化物的去除率与烟气中氧气体积分数的关系如图所示。
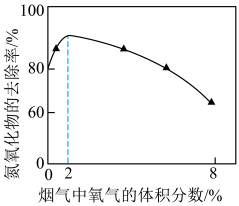
②烟气中氧气的体积分数介于2%~8%时,随着O2体积分数的上升,氮氧化物去除率减小,原因是
您最近一年使用:0次
名校
解题方法
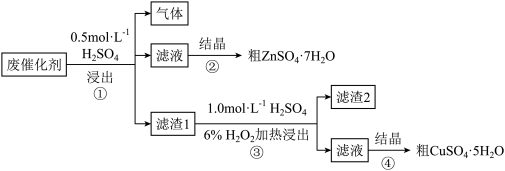
10 . 某废催化剂含58.2%的SiO2、21.0%的ZnO、4.5%的ZnS和12.8%的CuS,某同学以该废催化剂为原料,回收其中的锌和铜。采用的实验方案如图:
(1)滤渣2的主要成分是______ 和S。
(2)加入 溶液的目的是
溶液的目的是______ (用离子方程式表示)。
(3)步骤②和④的“一系列操作”包括______ 、______ 、过滤、洗涤、低温干燥。洗涤晶体时用乙醇代替蒸馏水的目的是______ ,并缩短干燥所需时间。
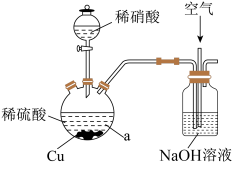
(4)实验室中也可用Cu在如图所示装置(夹持装置省去未画)内发生反应生成硫酸铜,再进一步从所得溶液中获得硫酸铜晶体。 和
和 的物质的量之比为
的物质的量之比为______ 。
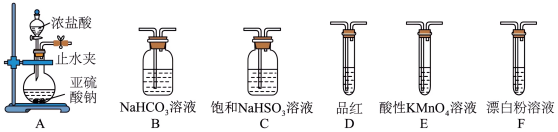
②选用下面的装置探究酸性:H2SO3>HClO,溶液均足量,其连接顺序为A→______ 。能证明H2SO3的酸性强于HClO的实验现为______ 。(已知:H2SO3酸性大于H2CO3)
(1)滤渣2的主要成分是
(2)加入
 溶液的目的是
溶液的目的是(3)步骤②和④的“一系列操作”包括
(4)实验室中也可用Cu在如图所示装置(夹持装置省去未画)内发生反应生成硫酸铜,再进一步从所得溶液中获得硫酸铜晶体。
 和
和 的物质的量之比为
的物质的量之比为②选用下面的装置探究酸性:H2SO3>HClO,溶液均足量,其连接顺序为A→
您最近一年使用:0次



