2016高一·全国·课时练习
解题方法
1 . 根据下表回答问题:

(1)元素⑦在周期表中的位置是_______ 。
(2)元素①和⑤的原子序数相差_______ 。
(3)写出元素⑤形成的常见化合物与元素⑧形成的单质反应的化学方程式_______ 。
(4)写出元素③形成的不同化合价的化合物的化学式(写出四个)_______ ,其中能与元素⑥形成的单质反应的化学方程式为_______ 。

(1)元素⑦在周期表中的位置是
(2)元素①和⑤的原子序数相差
(3)写出元素⑤形成的常见化合物与元素⑧形成的单质反应的化学方程式
(4)写出元素③形成的不同化合价的化合物的化学式(写出四个)
您最近一年使用:0次
2016高一·全国·课时练习
2 . 填空:
(1)________ NH3+_______ O2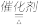
________ NO+______ H2O,该反应中氧化剂是______ ,被氧化的元素是________ ,氧化产物是________ 。
(2)若有1 mol O2参加,则反应中转移电子是______ mol。
(3)配平该反应方程式并用单线桥标出电子转移的方向和数目____________________ 。
(1)
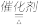
(2)若有1 mol O2参加,则反应中转移电子是
(3)配平该反应方程式并用单线桥标出电子转移的方向和数目
您最近一年使用:0次
2016高一·全国·课时练习
3 . 氮元素有-3、0、+1、+2、+3、+4和+5七种化合价,试据此判断下列四种化合物:
①NO ②N2O4 ③HNO3 ④NH3
(1)氮元素只能作还原剂的是________ (填序号,下同)。
(2)可能是HNO2还原产物的是________ 。
(3)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式。_____________________ 。
①NO ②N2O4 ③HNO3 ④NH3
(1)氮元素只能作还原剂的是
(2)可能是HNO2还原产物的是
(3)已知CuO具有氧化性,能够和氨气反应生成两种单质,请写出在加热条件下CuO和NH3反应的化学方程式。
您最近一年使用:0次
名校
4 . 小明做实验时不小心沾了一些高锰酸钾,皮肤上出现了难看的黑斑,老师告诉他可以用草酸的稀溶液进行清洗,其反应的离子方程式为MnO4-+H2C2O4+H+ CO2↑+Mn2++ ______(未配平),下列说法中正确的是( )
CO2↑+Mn2++ ______(未配平),下列说法中正确的是( )
 CO2↑+Mn2++ ______(未配平),下列说法中正确的是( )
CO2↑+Mn2++ ______(未配平),下列说法中正确的是( )| A.在该反应中有1 mol H2C2O4参加反应,转移电子总数为6NA |
| B.该反应配平后H+的化学计量数为6 |
| C.该反应右边横线上的产物为OH- |
| D.该反应的氧化剂为H2C2O4 |
您最近一年使用:0次
名校
5 . 我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:
KIO3+ KI+ H2SO4═ K2SO4+ I2 + H2O
(1)配平该方程式,并且用双线桥法表示该方程式电子转移的方向与数目:____________________
(2)该反应中氧化剂和还原剂的物质的量之比为______________ ;
(3)如果反应中转移0.5mol电子,则生成I2的物质的量为____________ ;
KIO3+ KI+ H2SO4═ K2SO4+ I2 + H2O
(1)配平该方程式,并且用双线桥法表示该方程式电子转移的方向与数目:
(2)该反应中氧化剂和还原剂的物质的量之比为
(3)如果反应中转移0.5mol电子,则生成I2的物质的量为
您最近一年使用:0次
2017-11-19更新
|
622次组卷
|
7卷引用:江苏省宿迁市沭阳县2017-2018学年高一(上)期中化学试卷
名校
6 . 已知反应:
①SO2+2Fe3++2H2O→SO42-+2Fe2++W
②Cr2O72-+aFe2++bH+→Cr3++Fe3++H2O
下列有关说法正确的 ( )
①SO2+2Fe3++2H2O→SO42-+2Fe2++W
②Cr2O72-+aFe2++bH+→Cr3++Fe3++H2O
下列有关说法正确的 ( )
| A.还原性: Cr3+>SO2 |
| B.方程式②中, a=6, b=7 |
| C.Cr2O72-能将 Na2SO3氧化成 Na2SO4 |
| D.方程式①中 W 为 OH- |
您最近一年使用:0次
2017-11-18更新
|
224次组卷
|
5卷引用:黑龙江省大庆铁人中学2017-2018学年高一上学期期中考试化学试题1
名校
7 . 将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是( )


| A.反应中转移电子的物质的量是0.21mol |
| B.一定有3. 36L氯气参加反应 |
| C.苛性钾溶液中KOH的质量是16.8g |
D.ClO 的生成可能是由于温度升高引起的 的生成可能是由于温度升高引起的 |
您最近一年使用:0次
2017-10-28更新
|
1012次组卷
|
8卷引用:2017届山东省莱州一中高三上第一次质检化学试卷
2017届山东省莱州一中高三上第一次质检化学试卷2018届高三一轮复习化学:微考点26-氯水和常见漂白剂性质探究辽宁省实验中学分校2018届高三10月月考化学试题广东省珠海市珠海二中、斗门一中2018届高三上学期期中联考化学试题(已下线)2019年8月18日 《每日一题》 (一轮复习) 每周一测辽宁省大连海湾高级中学2019-2020学年高三上学期期中考试化学试题(已下线)第02章 海水中的重要元素——钠和氯(B卷能力提高篇)——2020-2021学年高一化学必修第一册同步单元AB卷(新教材人教版)上海市吴淞中学2022-2023学年高一上学期期末学科指标评估化学试题
2017高一·全国·课时练习
8 . HIO4主要以H5IO6形式存在,H5IO6是白色晶体,易溶于水,具有很强的氧化性,在强酸溶液中能氧化Mn2+。
(1)请完成并配平下列离子反应。
__________ Mn2++________ H5IO6
__________  +
+________ 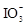 +
+________ H++________
(2)根据以上离子方程式判断H5IO6是________ 电离物质(填“易”或“难”)。
(3)上述反应,被氧化的元素是________ (填元素符号),当1 mol Mn2+参加反应时,转移电子的物质的量为________ 。
(1)请完成并配平下列离子反应。

 +
+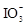 +
+(2)根据以上离子方程式判断H5IO6是
(3)上述反应,被氧化的元素是
您最近一年使用:0次
2017-09-17更新
|
1166次组卷
|
5卷引用:2.3.1 氧化还原反应
9 . 铁有许多重要的化合物,除中学化学常见的三种氧化物和两种氢氧化物外,还有许多盐。FeSO4·7H2O是一种浅绿色晶体,俗称绿矾,常用于处理含有氧化性离子的废水。现用绿矾对某工厂废水(含有强氧化性离子Cr2O72-)进行处理。
(1)绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:_______________________________________ 。
(2)试配平:____ Fe2++_____ Cr2O72- +__ ______ =______ Fe3++______ Cr3++______ H2O
(3)若该废水中Cr3+的含量为1×10-2mol·m-3,理论上83.4 kg绿矾可以处理该废水________ 吨(已知废水的密度为1 g·cm-3)。
(1)绿矾除用铁粉与硫酸反应生成外,工业上还可用空气、水、黄铁矿(主要成分为FeS2)来制取。已知该反应除生成硫酸亚铁,还生成一种中学化学常见的强酸,试写出该反应的化学方程式:
(2)试配平:
(3)若该废水中Cr3+的含量为1×10-2mol·m-3,理论上83.4 kg绿矾可以处理该废水
您最近一年使用:0次
2017-09-07更新
|
263次组卷
|
4卷引用:陕西省黄陵中学2018届高三(普通班)上学期开学考试化学试题
陕西省黄陵中学2018届高三(普通班)上学期开学考试化学试题2018年高一化学(人教版)必修1综合题型练习卷:氧化还原反应(已下线)【走进新高考】(人教版必修一)第二章 化学计量在实验中的应用 单元练习02(已下线)【走进新高考】(人教版必修一)第二章 化学物质及其变化 单元练习01
10 . 在铝和NaOH溶液的反应中,作为氧化剂的是
| A.水 | B.铝 | C.氢氧化钠 | D.氢氧化钠和水 |
您最近一年使用:0次



