11-12高三·河南周口·阶段练习
名校
1 . 氢化亚铜(CuH)是一种不稳定物质,能在氯气中燃烧;也能与酸反应。用CuSO4溶液和“某物质”在40~50 ℃时反应可产生它。下列有关叙述中错误的是
| A.“某物质”具有还原性 |
| B.CuH与盐酸反应,可能产生H2 |
| C.CuH在氯气中燃烧:CuH+Cl2=CuCl+HCl |
| D.CuH与足量的稀硝酸反应:CuH+3H++NO3-=Cu2++NO↑+2H2O |
您最近一年使用:0次
2017-02-17更新
|
240次组卷
|
15卷引用:2013届河南省扶沟县高级中学高三第三次考试化学试卷
(已下线)2013届河南省扶沟县高级中学高三第三次考试化学试卷(已下线)2013届辽宁省沈阳市第二十中学高三高考领航考试(二)化学试卷(已下线)2013-2014学年吉林省吉林一中高一上学期期末考试化学试卷(已下线)2014届上海市徐汇区高三上学期期末(一模)考试化学试卷2016届江西师大附中,九江一中高三上期中化学试卷2016届江西省上饶市余干二中高三上学期教学质检化学试卷2015-2016学年辽宁沈阳市第二中学高二下期末考化学卷2017届广东省中山一中高三上学期第一次统测化学试卷2017届河北省武邑中学高三上学期第二次调研化学试卷2017届广东省深圳市三校高三上学期第一次联考化学卷河南省安阳市第二中学2016-2017学年高二下学期期末考试化学试题(已下线)2019高考备考一轮复习精品资料 第三章 金属及其化合物 第4讲 用途广泛的金属材料及开发利用金属矿物【押题专练】贵州省长顺文博高级中学2020-2021学年高二上学期期中考试化学试题卷一 物质及其变化 2023-2024学年高一上学期化学人教版(2019)必修第一册 期末复习检测卷 河南省周口恒大中学2023-2024学年高一下学期开学化学试题
名校
解题方法
2 . A、B、C、D、E、W为六种前四周期元素,它们的原子序数依次增大. A 与 D 同主族,可形成 DA 型离子化合物,B与C同周期且相邻,C与E同主族,E2-与 Ar 原子具有相同的电子层结构,W 的合金用量最大、用途最广.请回答下列问题:
(1)D 在元素周期表中的位置___________ .
(2)A 分别与 C、E 形成最简单化合物中沸点较高的是________ (填化学式),原因是____________ .
(3)A、C、D三种元素形成的物质中含有的化学键类型______ ,灼热的碳能与 B 的最高价氧化物对应水化物的浓溶液反应,化学反应方程式为_____________ .
(4)向盛有A2C2 溶液的试管中加入几滴酸化的WEC4 溶液,溶液变成棕黄色,发生反应的离子方程式为____________ ;一段时间后,溶液中有气泡出现,并放热,随后有红褐色沉淀生成,产生气泡的原因是_______ ;生成沉淀的原因是____________ (用平衡移动原理解释).
(1)D 在元素周期表中的位置
(2)A 分别与 C、E 形成最简单化合物中沸点较高的是
(3)A、C、D三种元素形成的物质中含有的化学键类型
(4)向盛有A2C2 溶液的试管中加入几滴酸化的WEC4 溶液,溶液变成棕黄色,发生反应的离子方程式为
您最近一年使用:0次
2017-02-17更新
|
459次组卷
|
6卷引用:2017届黑龙江省大庆市高三上学期第一次模拟考试化学试卷
名校
解题方法
3 . 利用硫铁矿(主要成分FeS2)生产硫酸和绿矾(FeSO4·7H2O)的工业流程示意图如下:
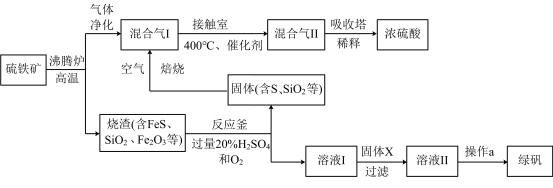
(1)沸腾炉中,硫铁矿进行粉碎处理的目的是______________ 。
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是________________ 。
(3)反应釜中,烧渣经过反应转化为溶液I和固体。
① 烧渣中的FeS在反应中做_______________ 剂(填“氧化”或“还原”)。
② 溶液I中所含溶质的化学式是_____________ 。
(4)操作a的主要步骤是:加热浓缩、______________ 、过滤洗涤。
(5)流程中,固体X可以选择硫铁矿(FeS2)或_______________ ;当固体X为硫铁矿(FeS2)时,将溶液I与固体X发生反应的离子方程式补充完整:
FeS2+
______ +
______ === Fe2++
Fe2++ SO42-+
SO42-+
_______

(1)沸腾炉中,硫铁矿进行粉碎处理的目的是
(2)接触室中,发生的主要反应是SO2与O2的反应,其化学方程式是
(3)反应釜中,烧渣经过反应转化为溶液I和固体。
① 烧渣中的FeS在反应中做
② 溶液I中所含溶质的化学式是
(4)操作a的主要步骤是:加热浓缩、
(5)流程中,固体X可以选择硫铁矿(FeS2)或
FeS2+


 Fe2++
Fe2++ SO42-+
SO42-+
您最近一年使用:0次
2016-12-09更新
|
919次组卷
|
7卷引用:2017届北京市海淀区高三上学期期中化学试卷
2017届北京市海淀区高三上学期期中化学试卷辽宁省沈阳市2019-2020 学年高二下学期期末联考化学试题(已下线)5.1.3 不同价态含硫物质的转化(能力提升)-2020-2021学年高一化学新教材新理念新设计同步课堂(人教2019必修第二册)北京市中央民族大学附属中学2022届高三9月月考化学试题山西省长治市第二中学校2021-2022学年高一下学期第一次月考化学试题河北省承德市围场满族蒙古族自治县卉原中学2022-2023学年高一上学期期末网考化学试题云南省宣威市第三中学2022-2023学年高一下学期第三次月考化学试题
解题方法
4 . 大气污染问题日益引起全民关注.
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物.下列说法不正确的是______ (填字母序号)。
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)某地科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和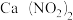
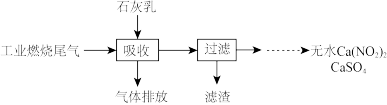
①硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为___________ 、__________ .
②CaSO4可以调节水泥的硬化时间.尾气中2molSO2被石灰乳逐渐吸收最终生成了1molCaSO4,该过程中转移的电子数目为___________ 。
③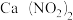 可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成
可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成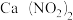 的化学方程式
的化学方程式_________________ .
(3)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:
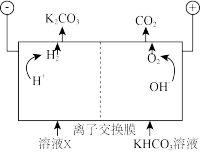
①在阳极区发生的反应包括___________ 和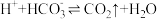 。
。
②简述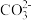 在阴极区再生的原理
在阴极区再生的原理___________ 。
③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25℃,101KPa下:
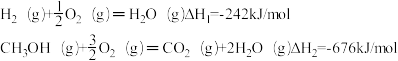
写出CO2和H2生成气态甲醇等产物的热化学方程式____________ .
(1)PM2.5是指大气中直径小于或等于2.5μm(1μm=103nm)的颗粒物.下列说法不正确的是
a.PM2.5主要来源于火力发电、工业生产、汽车尾气排放等过程
b.PM2.5颗粒小,所以对人体无害
c.直径介于1~2.5μm的颗粒物分散到空气中可形成胶体
d.推广使用电动汽车,可以减少PM2.5的污染
(2)某地科研工作者用五年时间研究出利用石灰乳除工业燃煤尾气中的硫(SO2、SO3)和氮(NO、NO2)的新工艺,既能净化尾气,又能获得应用广泛的CaSO4和

①硫酸型酸雨的形成过程是大气中的SO2溶于雨水生成某种弱酸,在空气中经催化氧化生成硫酸,该过程中反应的化学方程式为
②CaSO4可以调节水泥的硬化时间.尾气中2molSO2被石灰乳逐渐吸收最终生成了1molCaSO4,该过程中转移的电子数目为
③
 可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成
可制成混凝土防冻剂、钢筋阻锈剂等。尾气中NO、NO2与石灰乳反应生成 的化学方程式
的化学方程式(3)人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下:

①在阳极区发生的反应包括
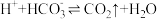 。
。②简述
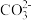 在阴极区再生的原理
在阴极区再生的原理③再生装置中产生的CO2和H2在一定条件下反应生成甲醇,工业上利用该反应合成甲醇。
已知:25℃,101KPa下:
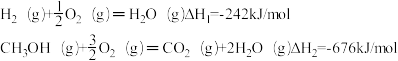
写出CO2和H2生成气态甲醇等产物的热化学方程式
您最近一年使用:0次
2016-12-09更新
|
843次组卷
|
4卷引用:2017届河北省石家庄二中高三上第二期联考化学试卷
5 . 已知某一反应体系有反应物和生成物共三种物质:FeCl3、FeCl2、Fe。完成下列问题:
(1)该反应中的还原产物的化学式是________ ,氧化产物的化学式是________ 。
(2)该反应的离子方程式为____________________________________________ 。
(3)标出该反应中电子转移的方向和数目________________________________ 。
(4)如反应转移了0.3 mol电子,则________ (填“溶解”或“生成”)的铁的质量为________ 。
(1)该反应中的还原产物的化学式是
(2)该反应的离子方程式为
(3)标出该反应中电子转移的方向和数目
(4)如反应转移了0.3 mol电子,则
您最近一年使用:0次
2016-12-09更新
|
349次组卷
|
4卷引用:2015-2016学年山东省淄博市高青一中高一下收心考试化学试卷
2015-2016学年山东省淄博市高青一中高一下收心考试化学试卷(已下线)【走进新高考】(人教版必修一)第二章 化学物质及其变化 单元练习01江西省南昌市进贤一中2020-2021学年高一上学期第二次月考化学试题四川省雅安市汉源县2023-2024学年高一上学期第一次联测化学试题
名校
解题方法
6 . 明胶是水溶性蛋白质混合物、溶于水会形成胶体。工业明胶制成的胶囊中往往含有超标的重金属Cr,因而对人体造成伤害。
(1)用一束光照射明胶水溶液,可观察到______ 现象。
(2)Na2CrO4是工业上常用的氧化剂,工业上可用FeCr2O4(Cr元素的化合价为+3)制Na2CrO4,其反应为FeCr2O4+8Na2CO3+Na2CrO4+7O2 Na2CrO4+Fe2O3+8CO2↑。
Na2CrO4+Fe2O3+8CO2↑。
①FeCr2O4铁元素的化合价为_______ ,用氧化物的形式表示FeCr2O4的化学式:________
②该反应的氧化产物是_______ ;每生成1molNa2CrO4时,转移电子_____ mol。
(1)用一束光照射明胶水溶液,可观察到
(2)Na2CrO4是工业上常用的氧化剂,工业上可用FeCr2O4(Cr元素的化合价为+3)制Na2CrO4,其反应为FeCr2O4+8Na2CO3+Na2CrO4+7O2
 Na2CrO4+Fe2O3+8CO2↑。
Na2CrO4+Fe2O3+8CO2↑。①FeCr2O4铁元素的化合价为
②该反应的氧化产物是
您最近一年使用:0次
2016-12-09更新
|
299次组卷
|
4卷引用:2015-2016学年河北省秦皇岛市高一上学期期末考试化学试卷
名校
解题方法
7 . 用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素。一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
(1)该反应的离子方程式___________________________ 。(已知H2C2O4是二元弱酸)
(2)该实验探究的是_____________ 因素对化学反应速率的影响。相同时间内针筒中所得CO2的体积大小关系是_________________ <_____________ (填实验序号)。
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末, c( )=
)=__________ mol/L(假设混合液体积为50mL)
(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定_____________ 来比较化学反应速率。(一条即可)
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

①__________________________ ;②__________________________ 。
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol·L-1 H2C2O4溶液 | 30mL 0.01mol·L-1 KMnO4溶液 |
| ② | 20mL 0.2mol·L-1 H2C2O4溶液 | 30mL 0.01mol·L-1 KMnO4溶液 |
(1)该反应的离子方程式
(2)该实验探究的是
(3)若实验①在2min末收集了2.24mL CO2(标准状况下),则在2min末, c(
 )=
)=(4)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定
(5)小组同学发现反应速率总是如图,其中t1~t2时间内速率变快的主要原因可能是:

①
您最近一年使用:0次
2016-12-09更新
|
550次组卷
|
8卷引用:2015-2016学年江西省南昌二中高二上第一次月考化学试卷
名校
8 . 关于硅及其化合物的叙述中,正确的是
| A.硅是良好的半导体材料,且是制造光缆的主要材料 |
| B.SiO2不溶于水,也不溶于任何酸 |
C.可以用焦炭还原二氧化硅生产硅:SiO2+C Si + CO2↑ Si + CO2↑ |
| D.SiO2是酸性氧化物,在一定条件下能和氧化钙反应 |
您最近一年使用:0次
2016-12-09更新
|
463次组卷
|
9卷引用:2014-2015河北省正定中学高一上学期期末考试化学试卷
2014-2015河北省正定中学高一上学期期末考试化学试卷云南省曲靖市麒麟高中2017-2018学年高一下学期期末考试化学试题云南省澜沧县民中2018-2019学年高一下学期期末考试化学试题云南省玉溪市江川区二中2019-2020学年高一上学期期末考试化学试题云南省玉溪市通海二中2019-2020学年高一上学期期末考试化学试题(已下线)【南昌新东方】2019 南昌十中 高一下 第一次月考云南省弥勒市第一中学2019-2020学年高一下学期化学期末复习题内蒙古通辽市科尔沁左翼中旗实验高级中学2021-2022学年高一下学期期中考试(A卷)化学试题云南省龙陵县第一中学2022-2023学年高一下学期期末考试化学试题
9-10高二·山东·假期作业
名校
9 . 做实验时不小心沾了一些高锰酸钾,皮肤上的斑很久才能消除,如果用草酸的稀溶液洗涤马上可以复原,其离子方程式为:MnO4-+C2O42-+H+=CO2↑+Mn2++ ,关于此反应的叙述正确的是
,关于此反应的叙述正确的是
 ,关于此反应的叙述正确的是
,关于此反应的叙述正确的是| A.该反应的氧化剂是C2O42- | B.该反应右边方框内的产物是OH- |
| C.该反应电子转移总数是5e- | D.配平该反应式后,H+的系数是16 |
您最近一年使用:0次
2016-12-09更新
|
1146次组卷
|
11卷引用:2010年安丘中学高二暑期练习化学卷(六)
(已下线)2010年安丘中学高二暑期练习化学卷(六)(已下线)09~10年西南师大附中高一下期期末考试化学卷(已下线)2011-2012学年辽宁省实验中学分校高二下学期期末考试化学试卷(已下线)2015届吉林省公主岭市第一中学高三上学期第二次月考化学试卷宁夏育才中学2018届高三上学期第一次月考化学试题辽宁省大连市第一中学2021-2022学年高一上学期第一次阶段性学情反馈化学试题(已下线)1.3.3 氧化还原反应方程式的书写与配平-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)(已下线)【知识图鉴】单元讲练测必修第一册第一单元03巩固练(已下线)专题03 氧化还原反应【考题猜想】(10大题型)-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)(已下线)期中测试卷二【测试范围:第一、二章】-2023-2024学年高一化学上学期期中考点大串讲(人教版2019必修第一册)浙江省嘉兴市八校2023-2024学年高一上学期期中联考化学试题
13-14高一上·广西柳州·期末
名校
解题方法
10 . 请回答下列问题
(1)向H2O2溶液中滴加FeCl3溶液,可发生下列反应:H2O2+2Fe3+=2Fe2++ O2↑+2H+, H2O2+ 2Fe2++2H+=2Fe3++ 2H2O 。在以上反应中Fe3+实际上起着___________ 作用,总反应式为___________ 。
(2)I2与Fe3+一样也可以发生上述类似反应,类比(1)在下面填入合适的化学反应方程式:H2O2+I2=2HIO,___________ 。总反应式为___________ 。
(3)在硫酸和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可使淀粉变蓝色。该反应的离子方程式为:___________ 。
(4)高铁酸钠(Na2FeO4)可作为一种新型净水剂,在反应中Na2FeO4被还原为Fe3+离子,请简述高铁酸钠之所以能净水,除了具有强氧化性,能消毒杀菌外,另一原因是___________ 。
(5)高铁酸钠的制备常用氧化铁在碱性溶液中与硝酸钠反应制得:Fe2O3 + NaNO3 + NaOH → Na2FeO4 + NaNO2 + H2O,配平化学方程式,并标出电子转移的方向和数目___________ 。
(1)向H2O2溶液中滴加FeCl3溶液,可发生下列反应:H2O2+2Fe3+=2Fe2++ O2↑+2H+, H2O2+ 2Fe2++2H+=2Fe3++ 2H2O 。在以上反应中Fe3+实际上起着
(2)I2与Fe3+一样也可以发生上述类似反应,类比(1)在下面填入合适的化学反应方程式:H2O2+I2=2HIO,
(3)在硫酸和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可使淀粉变蓝色。该反应的离子方程式为:
(4)高铁酸钠(Na2FeO4)可作为一种新型净水剂,在反应中Na2FeO4被还原为Fe3+离子,请简述高铁酸钠之所以能净水,除了具有强氧化性,能消毒杀菌外,另一原因是
(5)高铁酸钠的制备常用氧化铁在碱性溶液中与硝酸钠反应制得:Fe2O3 + NaNO3 + NaOH → Na2FeO4 + NaNO2 + H2O,配平化学方程式,并标出电子转移的方向和数目
您最近一年使用:0次



