解题方法
1 . 工业上用某软锰矿(主要成分为 ,还含有少量铁、铝及硅的氧化物)为原料制备尖晶石结构的锰酸锂(
,还含有少量铁、铝及硅的氧化物)为原料制备尖晶石结构的锰酸锂( )。流程如下图:
)。流程如下图:
回答下列问题:
(1)基态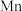 原子的价电子排布式为
原子的价电子排布式为___________ 。
(2)“浸取”得到的浸取液中阳离子主要是 ,生成
,生成 的离子方程式为
的离子方程式为___________ ,滤渣Ⅰ的主要成分是___________ 。(填化学式)。
(3)“精制”时,需调节溶液pH范围为___________ 。
(4)在催化剂存在下,从下表可知升高氧化温度有利于将氢氧化锰氧化为 ,分析工业“控温、氧化”过程中,最适宜选定的氧化温度为
,分析工业“控温、氧化”过程中,最适宜选定的氧化温度为___________ ,原因是___________ 。
(5)“锂化”是将 和
和 按一定的物质的量比配料,球磨
按一定的物质的量比配料,球磨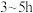 ,然后升温至
,然后升温至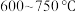 ,保温
,保温 ,自然冷却至室温得产品。所得混合气体的成分是
,自然冷却至室温得产品。所得混合气体的成分是___________ (填化学式)。
(6)一种 晶体的晶胞示意图如图,该长方体晶胞的长和宽均为anm,高为bnm。
晶体的晶胞示意图如图,该长方体晶胞的长和宽均为anm,高为bnm。___________ (填“Mn”或“O”)。
②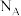 为阿伏加德罗常数,该晶体的密度为
为阿伏加德罗常数,该晶体的密度为___________  (列出计算式即可)。
(列出计算式即可)。
 ,还含有少量铁、铝及硅的氧化物)为原料制备尖晶石结构的锰酸锂(
,还含有少量铁、铝及硅的氧化物)为原料制备尖晶石结构的锰酸锂( )。流程如下图:
)。流程如下图: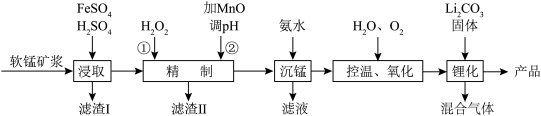
| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 7.5 | 1.7 | 3.4 | 7.1 |
| 完全沉淀的pH | 9.7 | 3.2 | 4.4 | 9.8 |
(1)基态
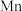 原子的价电子排布式为
原子的价电子排布式为(2)“浸取”得到的浸取液中阳离子主要是
 ,生成
,生成 的离子方程式为
的离子方程式为(3)“精制”时,需调节溶液pH范围为
(4)在催化剂存在下,从下表可知升高氧化温度有利于将氢氧化锰氧化为
 ,分析工业“控温、氧化”过程中,最适宜选定的氧化温度为
,分析工业“控温、氧化”过程中,最适宜选定的氧化温度为| 氧化温度/℃ | 230 | 280 | 300 | 330 | 350 | 400 |
 的质量分数/% 的质量分数/% | 70.8 | 72.3 | 73.4 | 74.9 | 75.1 | 75.5 |
(5)“锂化”是将
 和
和 按一定的物质的量比配料,球磨
按一定的物质的量比配料,球磨 ,然后升温至
,然后升温至 ,保温
,保温 ,自然冷却至室温得产品。所得混合气体的成分是
,自然冷却至室温得产品。所得混合气体的成分是(6)一种
 晶体的晶胞示意图如图,该长方体晶胞的长和宽均为anm,高为bnm。
晶体的晶胞示意图如图,该长方体晶胞的长和宽均为anm,高为bnm。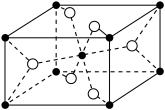
②
 为阿伏加德罗常数,该晶体的密度为
为阿伏加德罗常数,该晶体的密度为 (列出计算式即可)。
(列出计算式即可)。
您最近一年使用:0次
解题方法
2 . CuCl为白色固体,难溶于水和乙醇,潮湿时易被氧化。以海绵铜(主要含Cu和少量CuO)为原料制备CuCl的工艺流程如下,则下列叙述正确的是
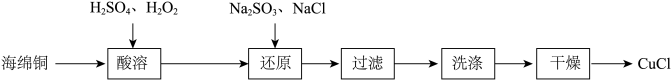
| A.“酸溶”时发生的反应均为非氧化还原反应 |
B.“还原”时反应的离子方程式为 |
| C.“过滤”时搅拌可以加快过滤速度 |
| D.“洗涤”时用蒸馏水洗比用乙醇洗,制得的CuCl纯度更高 |
您最近一年使用:0次
3 . 实验室用下图所示装置制备 。其原理为:先用酸性
。其原理为:先用酸性 溶液将甲醇(
溶液将甲醇( )氧化为甲酸(HCOOH),再用甲酸与稀硫酸、
)氧化为甲酸(HCOOH),再用甲酸与稀硫酸、 反应制备
反应制备 实验步骤如下:
实验步骤如下: 溶液加入仪器A中进行反应。
溶液加入仪器A中进行反应。
步骤Ⅱ:点燃酒精灯进行第一次蒸馏。
步骤Ⅲ:用装置乙替换装置甲,进行第二次蒸馏;蒸馏完成,向锥形瓶中滴加稀硫酸反应结束后,分离提纯获得产品 固体。
固体。
已知:
①甲醇(又称木醇),无色有挥发性的液体,有毒,沸点为65℃:
②甲酸(又称蚁酸),无色有刺激性气味的液体,有腐蚀性,易挥发,沸点为100.6℃,与水形成共沸物的沸点为107℃。
回答下列问题:
(1)仪器A的名称为___________ ,E的作用为___________ 。
(2)第一次蒸馏时锥形瓶内收集到的液体为___________ (填名称)。第二次蒸馏时锥形瓶内应收集温度高于___________ (填“65”或“100.6”)℃的馏分,冷凝管中进水口为___________ (填“n”或“m”)。
(3)步骤Ⅲ中锥形瓶内发生反应的化学方程式为___________ 。
(4)实验获得120.8g 产品,甲醇的有效利用率为
产品,甲醇的有效利用率为___________ 。
 。其原理为:先用酸性
。其原理为:先用酸性 溶液将甲醇(
溶液将甲醇( )氧化为甲酸(HCOOH),再用甲酸与稀硫酸、
)氧化为甲酸(HCOOH),再用甲酸与稀硫酸、 反应制备
反应制备 实验步骤如下:
实验步骤如下: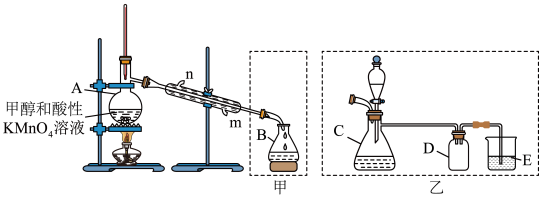
 溶液加入仪器A中进行反应。
溶液加入仪器A中进行反应。步骤Ⅱ:点燃酒精灯进行第一次蒸馏。
步骤Ⅲ:用装置乙替换装置甲,进行第二次蒸馏;蒸馏完成,向锥形瓶中滴加稀硫酸反应结束后,分离提纯获得产品
 固体。
固体。已知:
①甲醇(又称木醇),无色有挥发性的液体,有毒,沸点为65℃:
②甲酸(又称蚁酸),无色有刺激性气味的液体,有腐蚀性,易挥发,沸点为100.6℃,与水形成共沸物的沸点为107℃。
回答下列问题:
(1)仪器A的名称为
(2)第一次蒸馏时锥形瓶内收集到的液体为
(3)步骤Ⅲ中锥形瓶内发生反应的化学方程式为
(4)实验获得120.8g
 产品,甲醇的有效利用率为
产品,甲醇的有效利用率为
您最近一年使用:0次
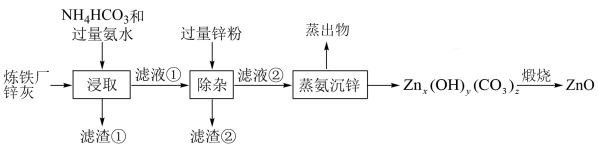
4 . 氧化锌是一种常用的化学添加剂,以钢铁厂锌灰(主要成分为ZnO,含少量的CuO、SiO2、Fe2O3)为原料制备ZnO的工艺流程如图所示: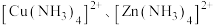
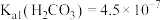 ,
,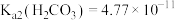 ,
,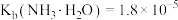 ;
;
③ 和
和 的分解温度分别为
的分解温度分别为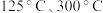 。
。
回答下列问题:
(1)Zn在元素周期表中位于_____ 区。
(2)H-N-H键角:
_____  (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3) 溶液呈
溶液呈_____ 性(填“酸”、“碱”或“中”),其各元素的电负性由大到小的顺序为______ 用“>”表示)。
(4)“浸取”时ZnO转化为 ,若参加反应的
,若参加反应的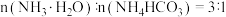 ,则该反应的离子方程式为
,则该反应的离子方程式为_____ 。
(5)“滤渣②”的主要成分为_____ 。
(6)研究发现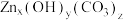 热分解得到ZnO的过程可分为两步。某实验小组称取11.2g
热分解得到ZnO的过程可分为两步。某实验小组称取11.2g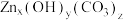 ,固体进行热重分析,第一步的固体失重率为8.0%,第二步的固体失重率为19.6%,则
,固体进行热重分析,第一步的固体失重率为8.0%,第二步的固体失重率为19.6%,则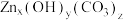 的化学式为
的化学式为_____ 。(固体失重率=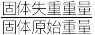 ×100%)
×100%)
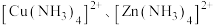
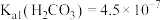 ,
,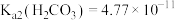 ,
,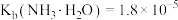 ;
;③
 和
和 的分解温度分别为
的分解温度分别为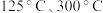 。
。回答下列问题:
(1)Zn在元素周期表中位于
(2)H-N-H键角:

 (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。(3)
 溶液呈
溶液呈(4)“浸取”时ZnO转化为
 ,若参加反应的
,若参加反应的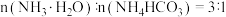 ,则该反应的离子方程式为
,则该反应的离子方程式为(5)“滤渣②”的主要成分为
(6)研究发现
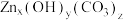 热分解得到ZnO的过程可分为两步。某实验小组称取11.2g
热分解得到ZnO的过程可分为两步。某实验小组称取11.2g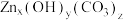 ,固体进行热重分析,第一步的固体失重率为8.0%,第二步的固体失重率为19.6%,则
,固体进行热重分析,第一步的固体失重率为8.0%,第二步的固体失重率为19.6%,则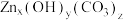 的化学式为
的化学式为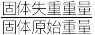 ×100%)
×100%)
您最近一年使用:0次
名校
5 . 硫酸四氨合铜晶体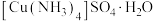 ,是碱性镀铜中电镀液的主要成分。某学习小组在实验室以铜为主要原料合成该物质,设计的合成路线为
,是碱性镀铜中电镀液的主要成分。某学习小组在实验室以铜为主要原料合成该物质,设计的合成路线为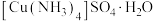 在水中均可溶,在乙醇中难溶。在溶液中存在以下电离(解离)过程:
在水中均可溶,在乙醇中难溶。在溶液中存在以下电离(解离)过程:
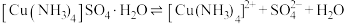 ,
,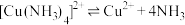
回答下列问题:
(1)实验室通常采用将铜屑浸泡在热的稀硫酸中,然后向其中不断通入热空气的方法来制备 溶液。
溶液。
①写出制备 溶液时发生反应的离子方程式:
溶液时发生反应的离子方程式:___________ 。
②为了使制备过程中稀硫酸的温度保持在50℃,需要对稀硫酸进行加热保温。应该采用的加热方式为___________ ,该加热方式的优点为___________ 。
③写出悬浊液得到溶液2的离子反应:___________ 。
(2)方案2的实验步骤为a.加热蒸发 b.冷却溶液 c.加95%乙醇、结晶。
①若利用方案2得到的产品晶体中往往含有___________ 杂质,产生杂质的原因是___________ 。
②95%乙醇的作用是___________ 。
(3)方案1、2的最后操作步骤均为过滤、洗涤、干燥。
①中学化学中常见的用于固液混合物分离的操作有“倾析法”“普通过滤”和“减压过滤”等,操作示意图如下:___________ 填字母下同。
A.过滤速度相对较快 B.能过滤胶状混合物 C.得到的固体物质相对比较干燥
②洗涤步骤中可选用的洗涤液是___________ 。
A.乙醇与乙醚的混合液 B.蒸馏水
C.乙醇和水的混合液 D.饱和硫酸钠溶液
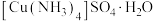 ,是碱性镀铜中电镀液的主要成分。某学习小组在实验室以铜为主要原料合成该物质,设计的合成路线为
,是碱性镀铜中电镀液的主要成分。某学习小组在实验室以铜为主要原料合成该物质,设计的合成路线为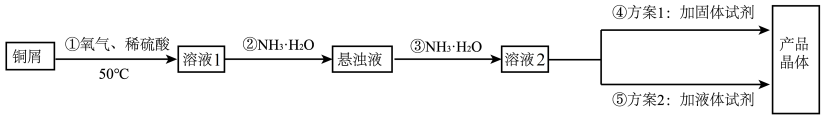
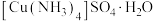 在水中均可溶,在乙醇中难溶。在溶液中存在以下电离(解离)过程:
在水中均可溶,在乙醇中难溶。在溶液中存在以下电离(解离)过程: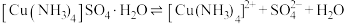 ,
,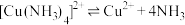
回答下列问题:
(1)实验室通常采用将铜屑浸泡在热的稀硫酸中,然后向其中不断通入热空气的方法来制备
 溶液。
溶液。①写出制备
 溶液时发生反应的离子方程式:
溶液时发生反应的离子方程式:②为了使制备过程中稀硫酸的温度保持在50℃,需要对稀硫酸进行加热保温。应该采用的加热方式为
③写出悬浊液得到溶液2的离子反应:
(2)方案2的实验步骤为a.加热蒸发 b.冷却溶液 c.加95%乙醇、结晶。
①若利用方案2得到的产品晶体中往往含有
②95%乙醇的作用是
(3)方案1、2的最后操作步骤均为过滤、洗涤、干燥。
①中学化学中常见的用于固液混合物分离的操作有“倾析法”“普通过滤”和“减压过滤”等,操作示意图如下:
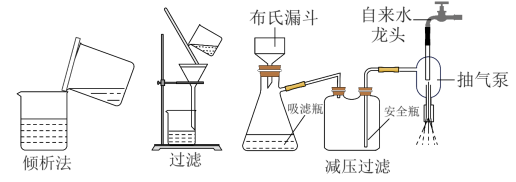
A.过滤速度相对较快 B.能过滤胶状混合物 C.得到的固体物质相对比较干燥
②洗涤步骤中可选用的洗涤液是
A.乙醇与乙醚的混合液 B.蒸馏水
C.乙醇和水的混合液 D.饱和硫酸钠溶液
您最近一年使用:0次
6 . 某科研团队在体积恒定的密闭容器中将 和
和 催化重整制备合成气,该反应为可逆反应,其反应历程示意图如下:
催化重整制备合成气,该反应为可逆反应,其反应历程示意图如下:
(1)制备合成气的化学方程式为_______ 。
(2)历程① ②是
②是_______ (填“吸收”或“放出”)能量的过程。
(3)维持温度和容积不变,下列不能说明该反应达到化学平衡状态的是_______(填标号)。
(4)在体积为 的密闭容器中,按投料比
的密闭容器中,按投料比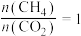 充入
充入 和
和 进行该反应,
进行该反应, 的平衡转化率
的平衡转化率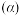 与温度
与温度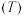 、初始压强
、初始压强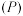 的关系如图所示。
的关系如图所示。 、初始压强为
、初始压强为 时,
时, 点的
点的
_______  (填“>”、“<”或“=”)
(填“>”、“<”或“=”)
②当温度为 、初始压强为
、初始压强为 时,加入
时,加入 和
和 ,反应
,反应 时达到平衡,用
时达到平衡,用 的浓度变化表示
的浓度变化表示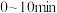 该反应的反应速率为
该反应的反应速率为_______  ,平衡时体系的总压强与初始压强之比为
,平衡时体系的总压强与初始压强之比为_______ 。
③保持温度和容积不变,若起始时提高投料比 的值,则起始速率
的值,则起始速率_______ (填“加快”、“减慢”或“无法判断”)。
 和
和 催化重整制备合成气,该反应为可逆反应,其反应历程示意图如下:
催化重整制备合成气,该反应为可逆反应,其反应历程示意图如下: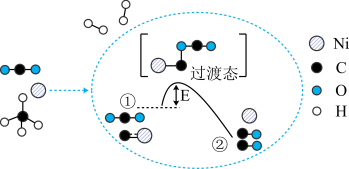
(1)制备合成气的化学方程式为
(2)历程①
 ②是
②是(3)维持温度和容积不变,下列不能说明该反应达到化学平衡状态的是_______(填标号)。
| A.混合气体的总压强不再变化 | B.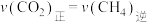 |
| C.混合气体的密度不再变化 | D. 的体积分数不再变化 的体积分数不再变化 |
(4)在体积为
 的密闭容器中,按投料比
的密闭容器中,按投料比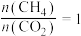 充入
充入 和
和 进行该反应,
进行该反应, 的平衡转化率
的平衡转化率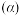 与温度
与温度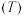 、初始压强
、初始压强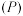 的关系如图所示。
的关系如图所示。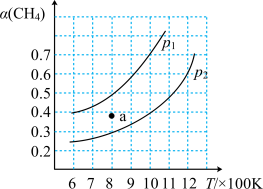
 、初始压强为
、初始压强为 时,
时, 点的
点的
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)②当温度为
 、初始压强为
、初始压强为 时,加入
时,加入 和
和 ,反应
,反应 时达到平衡,用
时达到平衡,用 的浓度变化表示
的浓度变化表示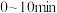 该反应的反应速率为
该反应的反应速率为 ,平衡时体系的总压强与初始压强之比为
,平衡时体系的总压强与初始压强之比为③保持温度和容积不变,若起始时提高投料比
 的值,则起始速率
的值,则起始速率
您最近一年使用:0次
名校
7 . 某工厂采用如下工艺处理镍钴矿硫酸浸取液(含 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。
回答下列问题:
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为___________ (答出两条即可)。
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸 ,该物质含有类似
,该物质含有类似 的过氧键,1mol
的过氧键,1mol  中过氧键的数目为
中过氧键的数目为___________ 。
(3)“氧化”中,用石灰乳调节pH=4, 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为___________ ( 的电离第一步完全,第二步微弱);滤渣的成分为
的电离第一步完全,第二步微弱);滤渣的成分为 、
、___________ (填化学式)。
(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如下, 体积分数为
体积分数为___________ 时,Mn(Ⅱ)氧化速率最大;继续增大 体积分数时,Mn(Ⅱ)氧化速率减小的原因是
体积分数时,Mn(Ⅱ)氧化速率减小的原因是___________ 。___________ 。
(6)常温下,“沉镁”中为使Mg2+沉淀完全,需控制pH不低于___________ 。
 、
、 、
、 、
、 和
和 ),实现镍、钴、镁元素的回收。
),实现镍、钴、镁元素的回收。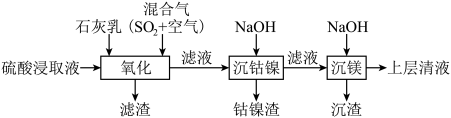
| 物质 |  |  |  |  |
 |  |  |  | 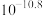 |
(1)用硫酸浸取镍钴矿时,提高浸取速率的方法为
(2)“氧化”中,混合气在金属离子的催化作用下产生具有强氧化性的过一硫酸
 ,该物质含有类似
,该物质含有类似 的过氧键,1mol
的过氧键,1mol  中过氧键的数目为
中过氧键的数目为(3)“氧化”中,用石灰乳调节pH=4,
 被
被 氧化为
氧化为 ,该反应的离子方程式为
,该反应的离子方程式为 的电离第一步完全,第二步微弱);滤渣的成分为
的电离第一步完全,第二步微弱);滤渣的成分为 、
、(4)“氧化”中保持空气通入速率不变,Mn(Ⅱ)氧化率与时间的关系如下,
 体积分数为
体积分数为 体积分数时,Mn(Ⅱ)氧化速率减小的原因是
体积分数时,Mn(Ⅱ)氧化速率减小的原因是
(6)常温下,“沉镁”中为使Mg2+沉淀完全,需控制pH不低于
您最近一年使用:0次
解题方法
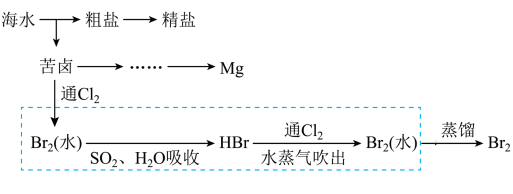
8 . 我国海洋资源丰富,从海水中获取某些物质的流程示意图如下。
① 粗盐中含有泥沙、 、
、 以及可溶性硫酸盐等杂质,可以依次通过溶解、过滤、
以及可溶性硫酸盐等杂质,可以依次通过溶解、过滤、_____ (选填字母序号;所加试剂均过量)、结晶等一系列流程得到精盐。
a. 加入 溶液→加入NaOH 溶液→加入
溶液→加入NaOH 溶液→加入 溶液→过滤→加入稀盐酸
溶液→过滤→加入稀盐酸
b. 加入NaOH溶液→加入 溶液→加入
溶液→加入 溶液→加入稀盐酸→过滤
溶液→加入稀盐酸→过滤
c. 加入 溶液→加入
溶液→加入 溶液→加入NaOH溶液→过滤→加入稀盐酸
溶液→加入NaOH溶液→过滤→加入稀盐酸
② 检验精盐中硫酸根是否除尽的方法是_______ (简述操作、现象及结论)。
③得到的精盐可用于冶炼金属钠,该反应的化学方程式是_______ 。
(2)海水提镁
已知苦卤的主要成分如下:
理论上,1L苦卤最多可得到 的质量为
的质量为_______ g。
(3)海水提溴
① 图中虚线框内流程的主要目的是_______ 。
(4)工业中可将以上工艺进行联合生产,从资源利用角度说明联合生产的优点_______ 。
① 粗盐中含有泥沙、
 、
、 以及可溶性硫酸盐等杂质,可以依次通过溶解、过滤、
以及可溶性硫酸盐等杂质,可以依次通过溶解、过滤、a. 加入
 溶液→加入NaOH 溶液→加入
溶液→加入NaOH 溶液→加入 溶液→过滤→加入稀盐酸
溶液→过滤→加入稀盐酸b. 加入NaOH溶液→加入
 溶液→加入
溶液→加入 溶液→加入稀盐酸→过滤
溶液→加入稀盐酸→过滤c. 加入
 溶液→加入
溶液→加入 溶液→加入NaOH溶液→过滤→加入稀盐酸
溶液→加入NaOH溶液→过滤→加入稀盐酸② 检验精盐中硫酸根是否除尽的方法是
③得到的精盐可用于冶炼金属钠,该反应的化学方程式是
(2)海水提镁
已知苦卤的主要成分如下:
| 离子 | Na⁺ | Mg²⁺ | Cl⁻ |  |
| 浓度/(g·L⁻¹) | 63.7 | 28.8 | 144.6 | 46.4 |
 的质量为
的质量为(3)海水提溴
① 图中虚线框内流程的主要目的是
② 图中虚线框内流程也可用低浓度  替代 ,请将Br2与
替代 ,请将Br2与 反应的化学方程式补充完整:
反应的化学方程式补充完整:

(4)工业中可将以上工艺进行联合生产,从资源利用角度说明联合生产的优点
您最近一年使用:0次
名校
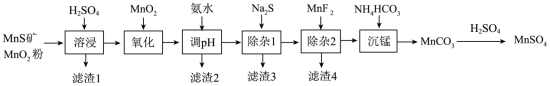
9 . 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
(1)为了加快溶浸效果,可采取的措施有____ (任写两条)。
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+,写出该反应的离子方程式____ 。
(3)调pH的范围为____ ,滤渣2除了含有Al(OH)3还含有____ 。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣4”的主要成分是___ 。
(5)写出“沉锰”的离子方程式___ 。
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4.当x=y= 时,z=
时,z=____ 。
| 金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
| 开始沉淀的pH | 8.1 | 8.3 | 1.5 | 3.4 | 8.9 | 8.2 | 8.4 |
| 沉淀完全的pH | 10.1 | 9.3 | 2.8 | 4.7 | 10.9 | 8.6 | 9.1 |
(2)“氧化”中添加适量的MnO2的作用是将Fe2+氧化为Fe3+,写出该反应的离子方程式
(3)调pH的范围为
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣4”的主要成分是
(5)写出“沉锰”的离子方程式
(6)层状镍钴锰三元材料可作为锂离子电池正极材料,其化学式为LiNixCoyMnzO2,其中Ni、Co、Mn的化合价分别为+2、+3、+4.当x=y=
 时,z=
时,z=
您最近一年使用:0次
解题方法
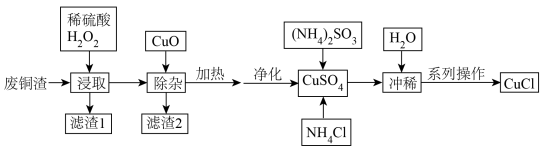
10 . 氯化亚铜(CuCl)广泛应用于冶金工业,用作催化剂和杀菌剂。以工业废铜渣(主要含CuO,还有CuS、Al2O3、CaO、SiO2、CuFeS2和FeO等)为原料制备CuCl,工业流程如下: 体系,存在溶解平衡:
体系,存在溶解平衡: 。
。
②常温下,部分金属离子开始沉淀和完全沉淀(当离子浓度小于 ,视为完全沉淀)时的pH如下表:
,视为完全沉淀)时的pH如下表:
回答下列问题:
(1)为了提高铜的浸取效果,可采取的措施_______ (举1例)。
(2)滤渣1含有淡黄色固体,浸取步骤中CuS参与反应的离子方程式_______ 。
(3)用CuO除杂调pH至_______ 的范围内。
(4)除杂后对滤液进行加热的目的是_______ 。
(5)依据平衡移动原理解释用H2O冲稀的目的是_______ 。
(6)①CuCl晶体的熔点为326℃,液态时不导电,推知CuCl晶体属于_______ (填晶体类型)。
②通过分析CuCl的X射线衍射图谱,发现CuCl晶胞与金刚石晶胞类似如图所示,晶胞参数为anm,该晶体密度ρ=_______  (设
(设 为阿伏伽德罗的值)。
为阿伏伽德罗的值)。
 体系,存在溶解平衡:
体系,存在溶解平衡: 。
。②常温下,部分金属离子开始沉淀和完全沉淀(当离子浓度小于
 ,视为完全沉淀)时的pH如下表:
,视为完全沉淀)时的pH如下表:| 金属离子 |  |  |  |  |
| 开始沉淀的pH | 1.6 | 3.2 | 5.2 | 6.8 |
| 完全沉淀的pH | 3.1 | 4.7 | 6.7 | 8.3 |
(1)为了提高铜的浸取效果,可采取的措施
(2)滤渣1含有淡黄色固体,浸取步骤中CuS参与反应的离子方程式
(3)用CuO除杂调pH至
(4)除杂后对滤液进行加热的目的是
(5)依据平衡移动原理解释用H2O冲稀的目的是
(6)①CuCl晶体的熔点为326℃,液态时不导电,推知CuCl晶体属于
②通过分析CuCl的X射线衍射图谱,发现CuCl晶胞与金刚石晶胞类似如图所示,晶胞参数为anm,该晶体密度ρ=
 (设
(设 为阿伏伽德罗的值)。
为阿伏伽德罗的值)。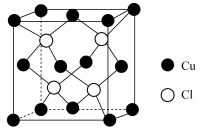
您最近一年使用:0次



