名校
解题方法
1 . 已知离子方程式:As2S3+H2O+ →
→ +
+ +NO↑+___(未配平),下列说法错误的是
+NO↑+___(未配平),下列说法错误的是
 →
→ +
+ +NO↑+___(未配平),下列说法错误的是
+NO↑+___(未配平),下列说法错误的是| A.配平后水的化学计量数为4 |
| B.反应后的溶液呈酸性 |
| C.配平后氧化剂与还原剂的分子数之比为3∶28 |
D.氧化产物为 和 和 |
您最近一年使用:0次
2021-12-27更新
|
214次组卷
|
15卷引用:甘肃省武威市第六中学2018届高三第一次阶段性过关考试化学试题
甘肃省武威市第六中学2018届高三第一次阶段性过关考试化学试题甘肃省武威第十八中学2020届高三上学期第一次诊断考试化学试题2016届河北省衡水中学高三上学期四调考试化学试卷江西省南康中学2020届高三上学期第二次月考化学试题江西省抚州市临川区第二中学2019-2020学年高一上学期第二次月考化学试题河北省衡水中学2020届高三七调考试化学试题河南省新蔡县第一高级中学2020-2021学年高一上学期1月月考化学试题(已下线)2019高考备考一轮复习精品资料 第二章 化学物质及其变化第3讲 氧化还原反应【押题专练】安徽省阜阳市第三中学2019-2020学年高一上学期期末考试化学试题(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点05 氧化还原反应-备战2022年高考化学一轮复习考点帮(浙江专用)(已下线)4.2.2 氧化还原反应方程式的配平(备作业)-【上好课】2021-2022学年高一化学同步备课系列(苏教版2019必修第一册)(已下线)第11讲 氧化还原反应的应用和配平-【暑假自学课】2022年新高一化学暑假精品课(鲁科版2019必修第一册)(已下线)1.3.3 氧化还原反应方程式配平(好题帮)-备战2023年高考化学一轮复习考点帮(新教材新高考)河北省沧州市2022-2023学年高一上学期期末考试化学试题
2 . (I)现有①硫酸铜晶体,②碳酸钙固体,③纯磷酸,④硫化氢,⑤三氧化硫,⑥金属镁,⑦石墨,⑧固态苛性钾,⑨氨水,⑩熟石灰固体,其中:
(1)属于强电解质的是___________ (填序号,下同)
(2)属于弱电解质的是___________ ;
(3)属于非电解质的是___________ ;
(II)已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性。请回答下列问题:
(4)高碘酸是___________ (填写“强酸”或“弱酸”),理由是___________ 。
(5)已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸,碘酸和硫酸,此反应的氧化剂是___________ ,反应的离子方程式可表示为___________ 。
(Ⅲ)在中和滴定操作过程中,有以下各项因操作不当而引起的实验误差,用“偏高”“偏低”或“无影响”等填空:
(6)滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定过程中气泡消失,使滴定结果___________ 。
(7)用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度___________ 。
(8)用含Na2CO3杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度___________ 。
(1)属于强电解质的是
(2)属于弱电解质的是
(3)属于非电解质的是
(II)已知pH=2的高碘酸(H5IO6)溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol/L的碘酸(HIO3)或高锰酸(HMnO4)溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性。请回答下列问题:
(4)高碘酸是
(5)已知高碘酸和硫酸锰(MnSO4)在溶液中反应生成高锰酸,碘酸和硫酸,此反应的氧化剂是
(Ⅲ)在中和滴定操作过程中,有以下各项因操作不当而引起的实验误差,用“偏高”“偏低”或“无影响”等填空:
(6)滴定管(装标准溶液)在滴定前尖嘴处有气泡,滴定过程中气泡消失,使滴定结果
(7)用含Na2O杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度
(8)用含Na2CO3杂质的NaOH固体来配制已知浓度的标准溶液,用于滴定未知浓度的盐酸,使测得盐酸的浓度
您最近一年使用:0次
名校
3 . 零价铁还原性强、活性高,对很多重金属离子及含磷、砷离子都有较好的去除和富集作用。
Ⅰ.零价铁的制备。
(1)富铁矿石经破碎、筛分到微米级后,在氢气氛围下600℃高温还原1h可以制备微米级零价铁。请写出磁铁矿与氢气反应制备零价铁的化学方程式___________ 。
(2)采用 还原铁盐,可以制备出纳米级的零价铁。
还原铁盐,可以制备出纳米级的零价铁。
已知:B的电负性是2.0,H的电负性是2.1
①请写出 的电子式
的电子式___________ 。
②请写出 与硫酸反应的离子方程式
与硫酸反应的离子方程式___________ 。
③补充完整下列离子方程式___________
___________ ___________
___________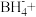 ___________
___________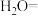 ___________Fe+___________
___________Fe+___________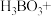 ___________
___________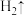
Ⅱ.零价铁的结构和作用机理。
研究发现,纳米级和微米级的零价铁,均具有“核—壳”结构。
已知:①壳层可以导电;
②当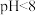 时,铁的氧化物质子化,壳层表面带正电;当
时,铁的氧化物质子化,壳层表面带正电;当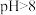 时,铁的氧化物去质子化,壳层表面带负电;
时,铁的氧化物去质子化,壳层表面带负电;
③磷酸盐溶解度一般较小。
(3)去离子水中加入零价铁,pH从6上升到9.5左右。检测壳层物质,发现有 、
、 、
、 、
、 等。导致产生壳层微粒的氧化剂是
等。导致产生壳层微粒的氧化剂是 、
、___________ 。
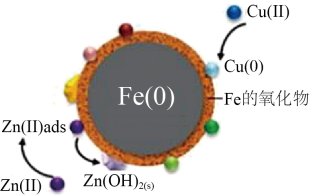
(4)部分金属阳离子去除机理如图所示。纳米零铁去除污水中Cu(Ⅱ)、Zn(Ⅱ)主要机理不同,请简述两者的区别并解释原因___________ 。
(5)去除含磷( )微粒:
)微粒:
①控制pH___________ 8。
②通过形成___________ (填化学式)进一步去除 。
。
(6)综上所述,零价铁去除重金属离子及含磷微粒的主要机理有___________ 。
Ⅰ.零价铁的制备。
(1)富铁矿石经破碎、筛分到微米级后,在氢气氛围下600℃高温还原1h可以制备微米级零价铁。请写出磁铁矿与氢气反应制备零价铁的化学方程式
(2)采用
 还原铁盐,可以制备出纳米级的零价铁。
还原铁盐,可以制备出纳米级的零价铁。已知:B的电负性是2.0,H的电负性是2.1
①请写出
 的电子式
的电子式②请写出
 与硫酸反应的离子方程式
与硫酸反应的离子方程式③补充完整下列离子方程式
___________
 ___________
___________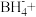 ___________
___________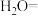 ___________Fe+___________
___________Fe+___________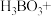 ___________
___________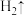
Ⅱ.零价铁的结构和作用机理。
研究发现,纳米级和微米级的零价铁,均具有“核—壳”结构。
已知:①壳层可以导电;
②当
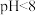 时,铁的氧化物质子化,壳层表面带正电;当
时,铁的氧化物质子化,壳层表面带正电;当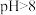 时,铁的氧化物去质子化,壳层表面带负电;
时,铁的氧化物去质子化,壳层表面带负电;③磷酸盐溶解度一般较小。
(3)去离子水中加入零价铁,pH从6上升到9.5左右。检测壳层物质,发现有
 、
、 、
、 、
、 等。导致产生壳层微粒的氧化剂是
等。导致产生壳层微粒的氧化剂是 、
、(4)部分金属阳离子去除机理如图所示。纳米零铁去除污水中Cu(Ⅱ)、Zn(Ⅱ)主要机理不同,请简述两者的区别并解释原因

(5)去除含磷(
 )微粒:
)微粒:①控制pH
②通过形成
 。
。(6)综上所述,零价铁去除重金属离子及含磷微粒的主要机理有
您最近一年使用:0次
2021-12-12更新
|
424次组卷
|
2卷引用:甘肃省张掖市高台县第一中学2022-2023学年高三上学期第三次检测化学试题
名校
4 . 下列离子方程式书写不正确的是
A.向一定体积明矾溶液中滴加 溶液,使硫酸根离子浓度降低到最小时: 溶液,使硫酸根离子浓度降低到最小时: |
B.在硫酸酸化的 溶液中滴入双氧水,溶液褪色: 溶液中滴入双氧水,溶液褪色: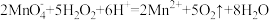 |
C.向碘化亚铁溶液中滴加少量稀硝酸: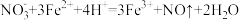 |
D.已知酸性的强弱: ,则向NaCN溶液中通入少量 ,则向NaCN溶液中通入少量 时, 时, |
您最近一年使用:0次
2021-12-12更新
|
597次组卷
|
2卷引用:甘肃省张掖市高台县第一中学2022-2023学年高三上学期第三次检测化学试题
5 . 氯酸钾和浓盐酸在一定温度下反应会生成绿黄色的易爆物二氧化氯(ClO2),ClO2是一种优良消毒剂。
(1)请补充空白并配平化学方程式。___________KClO3+___________HCl(浓) → ___________KCl+___________ClO2↑___________Cl2↑+ ___________ ,
,___________
(2)浓盐酸在反应中显示出来的性质是___________。
(3)若反应中生成标准状况下13.44 L气体,则消耗还原剂的物质的量为___________ 。
(4)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式___________ 。取2.76 g CaO2·8H2O样品受热脱水过程的热重曲线(140 ℃时完全脱水,杂质受热不分解)如图所示。
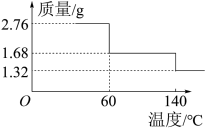
①试确定60 ℃时CaO2·xH2O中x=___________ 。
②该样品中CaO2的质量分数为___________ (精确到0.1%)。
(1)请补充空白并配平化学方程式。___________KClO3+___________HCl(浓) → ___________KCl+___________ClO2↑___________Cl2↑+ ___________
 ,
,(2)浓盐酸在反应中显示出来的性质是___________。
| A.只有还原性 | B.还原性和酸性 | C.只有氧化性 | D.氧化性和酸性 |
(4)过氧化钙也是一种优良消毒剂,供氧剂。通常情况下用CaCl2在稀氨水条件下与H2O2反应得到CaO2·8H2O沉淀,请写出该反应的化学方程式

①试确定60 ℃时CaO2·xH2O中x=
②该样品中CaO2的质量分数为
您最近一年使用:0次
2021-10-25更新
|
163次组卷
|
2卷引用:甘肃省民乐县第一中学2021-2022学年高三上学期10月诊断考试化学试题
名校
6 . 在明代宋应星所著的《天工开物》中,有关火法炼锌的工艺记载:“每炉甘石十斤,装载入一泥罐内,……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,罐中炉甘石熔化成球。冷定毁罐取出。……即倭铅也。……以其似铅而性猛,故名之曰‘倭’云。”(注:炉甘石的主要成分是碳酸锌。)
(1)请完成上述火法炼锌反应的化学方程式:ZnCO3+ _______ _______ + _______ CO↑
_______ + _______ CO↑
_______
(2)在该反应中,还原剂是_______ (填化学式,下同),被还原的是_______ 。
(1)请完成上述火法炼锌反应的化学方程式:ZnCO3+ _______
 _______ + _______ CO↑
_______ + _______ CO↑(2)在该反应中,还原剂是
您最近一年使用:0次
2021-10-25更新
|
913次组卷
|
5卷引用:甘肃省庆阳市第六中学2021-2022学年高一上学期第一次月考化学试题
甘肃省庆阳市第六中学2021-2022学年高一上学期第一次月考化学试题人教2019版必修第一册课后习题 第一章 物质及其变化复习与提高(已下线)第04练 第一章章末质量检测-2022年【寒假分层作业】高一化学(人教版2019)广东省江门市新会陈经纶中学2020-2021学年高一上学期期中考试化学试题北京市第八中学2023-2024学年高一上学期11月期中考试化学试题
7 . 回答下列问题
(1)已知某反应体系中有如下反应物和生成物: ,和一种未知物质X,X是一种气态单质,其密度是相同条件下H2密度的35.5倍
,和一种未知物质X,X是一种气态单质,其密度是相同条件下H2密度的35.5倍
①已知KMnO4 在反应中得电子,写出该反应的化学方程式_________
②已知当生成标准状况下2.24L气体X时,消耗的氧化剂的物质的量为_________
③根据该反应事实可知_________
A.氧化性:X>KMnO4 B.氧化性:KMnO4 >X
C.还原性:HCl>MnCl2 D.还原性:MnCl2 > HCl
(2)配平下列离子反应方程式
①_____KI+_____KIO3+_____H2SO4___________I2+_____K2SO4+_____H2O;____
②_____S+_____KOH___________K2S+_____K2SO3+_____H2O;_________
③_____ClO +_____Fe2++________Cl-+_____Fe3++______________;
+_____Fe2++________Cl-+_____Fe3++______________;_________
(1)已知某反应体系中有如下反应物和生成物:
 ,和一种未知物质X,X是一种气态单质,其密度是相同条件下H2密度的35.5倍
,和一种未知物质X,X是一种气态单质,其密度是相同条件下H2密度的35.5倍①已知KMnO4 在反应中得电子,写出该反应的化学方程式
②已知当生成标准状况下2.24L气体X时,消耗的氧化剂的物质的量为
③根据该反应事实可知
A.氧化性:X>KMnO4 B.氧化性:KMnO4 >X
C.还原性:HCl>MnCl2 D.还原性:MnCl2 > HCl
(2)配平下列离子反应方程式
①_____KI+_____KIO3+_____H2SO4___________I2+_____K2SO4+_____H2O;
②_____S+_____KOH___________K2S+_____K2SO3+_____H2O;
③_____ClO
 +_____Fe2++________Cl-+_____Fe3++______________;
+_____Fe2++________Cl-+_____Fe3++______________;
您最近一年使用:0次
名校
8 .  (主要指
(主要指 和
和 )是大气主要污染物之一、有效去除大气中的
)是大气主要污染物之一、有效去除大气中的 是环境保护的重要课题。
是环境保护的重要课题。
(1)在催化剂作用下, 可与
可与 发生如下反应:
发生如下反应:
①该反应的氧化剂是_____ (填化学式)。
②用单线桥表示该反应中电子转移的方向和数目_____ 。
③为研究哪些物质能将 转化为
转化为 以消除污染,根据氧化还原反应的知识可知,下列物质中不适宜选用的是
以消除污染,根据氧化还原反应的知识可知,下列物质中不适宜选用的是_____ (填序号)
A. B.
B. C.
C.
(2)水体中含有较多的硝酸盐会污染水质。一种用铁粉处理水体中的硝酸盐的反应如下: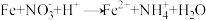 (未配平)
(未配平)
①配平后的反应中 和
和 前的化学计量数比为
前的化学计量数比为_____ 。
②由反应可知酸性条件下粒子的氧化性大小___________ 
___________ 。
 (主要指
(主要指 和
和 )是大气主要污染物之一、有效去除大气中的
)是大气主要污染物之一、有效去除大气中的 是环境保护的重要课题。
是环境保护的重要课题。(1)在催化剂作用下,
 可与
可与 发生如下反应:
发生如下反应:
①该反应的氧化剂是
②用单线桥表示该反应中电子转移的方向和数目
③为研究哪些物质能将
 转化为
转化为 以消除污染,根据氧化还原反应的知识可知,下列物质中不适宜选用的是
以消除污染,根据氧化还原反应的知识可知,下列物质中不适宜选用的是A.
 B.
B. C.
C.
(2)水体中含有较多的硝酸盐会污染水质。一种用铁粉处理水体中的硝酸盐的反应如下:
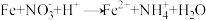 (未配平)
(未配平)①配平后的反应中
 和
和 前的化学计量数比为
前的化学计量数比为②由反应可知酸性条件下粒子的氧化性大小

您最近一年使用:0次
名校
解题方法
9 . 某化学小组探究“NO2能与赤热的铜反应生成氧化铜和氮气”。已知:
Ⅰ.NO和Cu不反应
Ⅱ.NO和FeSO4溶液反应:NO + FeSO4= FeSO4·NO(棕色)
Ⅲ.NO和酸性KMnO4溶液反应生成NO 和Mn2+
和Mn2+
设计实验装置如图所示(各装置中液态试剂均足量 )。

回答下列问题:
(1)写出A中发生反应的离子方程式:____________ 。
(2)关闭K1、K3、打开K2,滴加浓硝酸一段时间后关闭K2、打开K3,再点燃C处酒精灯,这样操作的目的是___________ 。
(3)实验过程中观察到下列现象:
①D中浅绿色溶液变成棕色,得出实验结论-NO2的还原产物________ (填代号)。
a.一定是NO和N2b.一定有NO c.一定无NO d.可能有NO
②E中有明显现象,该现象是____________ ,写出发生反应的离子方程式:____________ 。
(4)实验结束时关闭K3,打开K2、将导管末端插入NaOH溶液中,然后熄灭酒精灯,再__________ (填操作),打开K1鼓入大量空气处理装置内污染气体。若实验探究结论成立,E中针筒活塞显示V mL(已换算成标准状况)不再发生变化,此时铜全部被氧化为CuO,则V=____________ (用含 m的代数式表示)。
Ⅰ.NO和Cu不反应
Ⅱ.NO和FeSO4溶液反应:NO + FeSO4= FeSO4·NO(棕色)
Ⅲ.NO和酸性KMnO4溶液反应生成NO
 和Mn2+
和Mn2+设计实验装置如图所示(各装置中

回答下列问题:
(1)写出A中发生反应的离子方程式:
(2)关闭K1、K3、打开K2,滴加浓硝酸一段时间后关闭K2、打开K3,再点燃C处酒精灯,这样操作的目的是
(3)实验过程中观察到下列现象:
①D中浅绿色溶液变成棕色,得出实验结论-NO2的还原产物
a.一定是NO和N2b.一定有NO c.一定无NO d.可能有NO
②E中有明显现象,该现象是
(4)实验结束时关闭K3,打开K2、将导管末端插入NaOH溶液中,然后熄灭酒精灯,再
您最近一年使用:0次
2021-10-21更新
|
273次组卷
|
2卷引用:甘肃省兰州市第二十七中学2022届高三上学期第一次月考化学试题
名校
解题方法
10 . 含C、N化合物在生产、生活中有着重要的作用。请按要求回答下列问题。
I.氨气应用于侯德榜制碱工艺,原理如下图所示:

(1)N在元素周期表中的位置:______________ 。
(2)过程i通入NH3和CO2的顺序是_____________________ 。
(3)用平衡移动原理解释过程ii加NaCl(s)有利于析出更多NH4Cl(s)的原因是___________ 。
(4)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为________ 。
Ⅱ.电镀工业中含CN-的废水在排放前的处理过程如下:
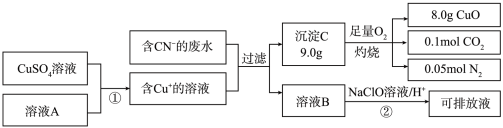
(5)溶液A具有的性质是(填“氧化性”或“还原性”)_______ . C的化学式为:______ 。
(6)反应② 可将CN-转化为无害物质,其离子方程式为:_____________ 。
I.氨气应用于侯德榜制碱工艺,原理如下图所示:

(1)N在元素周期表中的位置:
(2)过程i通入NH3和CO2的顺序是
(3)用平衡移动原理解释过程ii加NaCl(s)有利于析出更多NH4Cl(s)的原因是
(4)制碱副产品NH4Cl可用于生产NH3和HCl。但直接加热分解NH4Cl, NH3和HCl的产率很低,而采用在N2氛围中,将MgO与NH4Cl混合加热至300℃,可获得高产率的NH3,该反应的化学方程式为
Ⅱ.电镀工业中含CN-的废水在排放前的处理过程如下:

(5)溶液A具有的性质是(填“氧化性”或“还原性”)
(6)反应② 可将CN-转化为无害物质,其离子方程式为:
您最近一年使用:0次
2021-10-21更新
|
102次组卷
|
2卷引用:甘肃省兰州市第二十七中学2022届高三上学期第一次月考化学试题



