名校
解题方法
1 . “84”消毒液是一种常见的含氯消毒剂,化学实验小组同学对“84”消毒液的制备、保存及性质等进行如下探究,请回答下列问题:
(1)实验小组欲利用Cl2与NaOH溶液反应制备“84”消毒液,选择实验装置如下:

①A中发生反应的离子方程式为___________ 。
②C中盛装试剂为___________ 。
③仪器的连接顺序为a→___________ 气流方向,用小写字母表示)。
(2)D装置的作用是___________ ,若用如图E装置代替D装置,则E中溶液可选下列试剂中的___________ 。
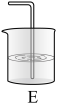
A.NaOH溶液 B.饱和NaCl溶液 C.H2SO4溶液 D.KI溶液
(3)“84”消毒液需要避光密封保存,否则容易变质而失效,用化学方程式解释其原因:
①NaClO+H2O+CO2=NaHCO3+HClO;
②___________ 。
(4)将Cl2通入到热的KOH溶液中可制得KClO3,该反应的离子方程式为___________ 。
(5)四氯化锡常用作合成有机锡化合物的原料。利用下图装置使含锡硫渣与氯气反应制备四氯化锡并进行尾气处理。已知:①无水四氯化锡的熔点为-33°C、沸点为114.1°C;②四氯化锡易水解。下列说法正确的是___________。

(1)实验小组欲利用Cl2与NaOH溶液反应制备“84”消毒液,选择实验装置如下:

①A中发生反应的离子方程式为
②C中盛装试剂为
③仪器的连接顺序为a→
(2)D装置的作用是

A.NaOH溶液 B.饱和NaCl溶液 C.H2SO4溶液 D.KI溶液
(3)“84”消毒液需要避光密封保存,否则容易变质而失效,用化学方程式解释其原因:
①NaClO+H2O+CO2=NaHCO3+HClO;
②
(4)将Cl2通入到热的KOH溶液中可制得KClO3,该反应的离子方程式为
(5)四氯化锡常用作合成有机锡化合物的原料。利用下图装置使含锡硫渣与氯气反应制备四氯化锡并进行尾气处理。已知:①无水四氯化锡的熔点为-33°C、沸点为114.1°C;②四氯化锡易水解。下列说法正确的是___________。

| A.装置A中KClO3可用MnO2替代 |
| B.装置B的作用是吸收HCl |
| C.装置E的作用是吸收Cl2尾气,同时可防止空气中水蒸气进入装置D干扰实验 |
| D.装置E中的试剂为无水氯化钙 |
您最近一年使用:0次
名校
解题方法
2 . 镍是重要的战略金属资源,一种从某高镁低品位铜镍矿(主要成分为CuFeS2、FeS2、3NiO●4SiO2●H2O、3MgO●4SiO2●H2O等)中回收Cu、Ni的工艺流程如图所示:
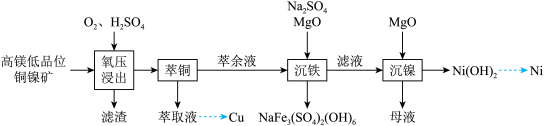
回答下列问题:
(1)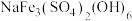 中,
中, 元素的化合价为
元素的化合价为_______ 。
(2)为提高“氧压浸出”的速率,可行的操作有_______ (任填一个)。
(3)“氧压浸出”的滤渣有S和_______ ,该环节中 发生的化学反应方程式为
发生的化学反应方程式为_______ 。
(4)“萃铜”时的反应为: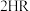 (有机相)
(有机相)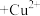 (水相)
(水相)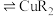 (有机相)
(有机相) (水相),下列说法正确的有_______。
(水相),下列说法正确的有_______。
(5)已知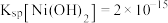 ,“滤液”中
,“滤液”中 ,“沉镍”时,控制
,“沉镍”时,控制 为8.50,此时
为8.50,此时 的沉淀率为
的沉淀率为_______ ,“沉镍”后的母液,含有的主要溶质为_______ (填化学式)。

回答下列问题:
(1)
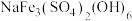 中,
中, 元素的化合价为
元素的化合价为(2)为提高“氧压浸出”的速率,可行的操作有
(3)“氧压浸出”的滤渣有S和
 发生的化学反应方程式为
发生的化学反应方程式为(4)“萃铜”时的反应为:
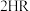 (有机相)
(有机相)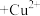 (水相)
(水相)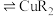 (有机相)
(有机相) (水相),下列说法正确的有_______。
(水相),下列说法正确的有_______。A.向萃取液中加入稀硫酸进行“反萃取”,可得到单质 |
B.萃余液中的阳离子为: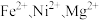 |
C.一定条件下,萃取平衡时,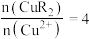 ,则 ,则 的萃取率为80% 的萃取率为80% |
D.为提高 的萃取率,可适当提高溶液 的萃取率,可适当提高溶液 |
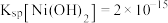 ,“滤液”中
,“滤液”中 ,“沉镍”时,控制
,“沉镍”时,控制 为8.50,此时
为8.50,此时 的沉淀率为
的沉淀率为
您最近一年使用:0次
2023-02-09更新
|
1298次组卷
|
3卷引用:甘肃省会宁县第一中学2023-2024学年高三下学期第一次月考化学试题
9-10高三·湖南衡阳·阶段练习
名校
解题方法
3 . 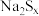 在碱性溶液中可被
在碱性溶液中可被 氧化为
氧化为 ,而
,而 被还原为
被还原为 ,若反应中
,若反应中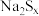 ,与
,与 的物质的量之比为
的物质的量之比为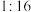 ,则x的值为
,则x的值为
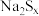 在碱性溶液中可被
在碱性溶液中可被 氧化为
氧化为 ,而
,而 被还原为
被还原为 ,若反应中
,若反应中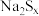 ,与
,与 的物质的量之比为
的物质的量之比为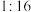 ,则x的值为
,则x的值为| A.2 | B.3 | C.4 | D.5 |
您最近一年使用:0次
2023-02-08更新
|
645次组卷
|
36卷引用:甘肃省张掖市第二中学2020-2021学年高一上学期期中考试化学试题
甘肃省张掖市第二中学2020-2021学年高一上学期期中考试化学试题(已下线)湖南省衡阳市第八中学2010届高三年级第五次月考化学试题(已下线)2013届河北省邯郸一中高三9月月考化学化学试卷(已下线)2014届浙江省湖州市八校高三上学期第二次联考化学试卷福建省德化一中、永安一中、漳平一中2018届高三上学期三校联考化学试题安徽省六安市霍邱县第二中学2019-2020学年高一上学期段考化学试题辽宁省辽河油田第二高级中学2020届高三12月考试化学试题辽宁省丹东市2020届高三总复习阶段测试化学试题黑龙江省哈尔滨市三中2020届高三第二次月考化学试题辽宁省东北育才学校科学高中部2020-2021学年高一上学期第一学段检测化学试题河南省周口市中英文学校2020-2021学年高三上学期第一次月考化学试题山东省济南市历城第一中学2021届高三上学期10月月考化学试题吉林省松原市乾安七中2020-2021学年高二下学期第七次质量检测化学试题山西省运城市稷山中学2022届高三上学期月考(一)化学试题陕西省韩城市西庄中学2021-2022学年高三上学期9月月考化学试题重庆市南开中学校2021-2022学年高一上学期阶段性测试化学试题吉林省吉林市第一中学2021-2022学年高二6月月考(平行班)化学试题(已下线)2012届高三上学期一轮复习化学单元验收试卷(4)(新人教版)(已下线)2012届黑龙江省大庆实验中学高三上学期期中考试化学试卷(已下线)2011-2012学年湖南衡阳一、八中高一下学期期中联考化学试卷黑龙江省齐齐哈尔市实验中学2017-2018学年高一上学期期中考试化学试题2019年秋高三化学复习强化练习—— 氧化还原反应(强化练)2020届高三化学二轮复习 氧化还原反应过关检测(强化训练)湖南省岳阳市岳阳楼区岳阳楼市第一中学2020届高三考前模拟理科综合化学试题(已下线)【南昌新东方】2019 南昌五中 高一上期中山西省临汾市县底中学校2020-2021学年高三上学期开学考试化学试题(已下线)专题05 氧化还原反应 (热点讲义)-2022届高考化学一轮复习热点题型归纳与变式训练河北省沧州市第一中学2020-2021学年高一下学期开学测试化学试题江苏省常州市第一中学2021-2022学年高一上学期期中考试化学试题四川省成都市树德中学2021-2022学年高一上学期11月阶段性测试(期中)化学试题重庆市璧山中学校2021-2022学年高一上学期期中考试化学试题陕西省宝鸡市千阳县千阳中学2020-2021学年高一上学期期中考试化学试题湖北省武汉中学2022-2023学年高一上学期期中阶段性考试化学试题第一章 化学物质及其变化 第5讲 氧化还原反应的计算与方程式的配平(已下线)题型18 氧化还原反应规律的应用(已下线)专题05 氧化还原反应方程式的配平与计算(一题多问)
4 . 科学家最近发现了一种利用水催化促进NO2和SO2转化的化学新机制。如图所示,电子传递可以促进HSO 中O-H键的解离,进而形成中间体SO
中O-H键的解离,进而形成中间体SO ,通过“水分子桥”,处于纳米液滴中的SO
,通过“水分子桥”,处于纳米液滴中的SO 或HSO
或HSO 可以将电子快速转移给周围的气相NO2分子。下列叙述错误的是
可以将电子快速转移给周围的气相NO2分子。下列叙述错误的是

 中O-H键的解离,进而形成中间体SO
中O-H键的解离,进而形成中间体SO ,通过“水分子桥”,处于纳米液滴中的SO
,通过“水分子桥”,处于纳米液滴中的SO 或HSO
或HSO 可以将电子快速转移给周围的气相NO2分子。下列叙述错误的是
可以将电子快速转移给周围的气相NO2分子。下列叙述错误的是
| A.观察图可知“水分子桥”与氢键形成有关 |
| B.转化过程中没有生成硫氧键 |
C.HSO 与NO2间发生的总反应的离子方程式为:HSO 与NO2间发生的总反应的离子方程式为:HSO +2NO2+H2O=2HNO2+HSO +2NO2+H2O=2HNO2+HSO |
| D.在标准状况下,5.6L气相NO2分子在图示的转化过程中得到0.25mol电子 |
您最近一年使用:0次
2023-02-03更新
|
559次组卷
|
4卷引用:甘肃省会宁县第一中学2023-2024学年高三下学期第一次月考化学试题
2023高三·全国·专题练习
5 . 已知Na2SO3具有强还原性,能够被Cl2氧化。某化工厂排出的废水中含0.014mol·L-1 Cl2、0.001mol·L-1 H+,废水排出的速度为10.0mL·s-1,为了除去此废水中的游离氯分子,并使废水变为中性,有人提出如下建议:在废水排出管A和B处分别注入一定流量的Na2SO3溶液(0.10mol·L-1)和烧碱溶液(0.10mol·L-1)。下列说法错误的是
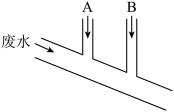

A.排出管A处发生的反应为 +Cl2+H2O= +Cl2+H2O= +2Cl-+2H+ +2Cl-+2H+ |
| B.废水排出管B处发生的反应为Cl2+2OH-=Cl-+ClO-+H2O |
| C.A处溶液的流量为1.4mL·s-1 |
| D.B处溶液的流量为2.8mL·s-1 |
您最近一年使用:0次
6 . 氧化剂和还原剂在生产生活中应用非常广泛。
(1)我国古代四大发明之一的黑火药是由硫磺粉、硝石(KNO3)、木炭粉按一定比例混合而成,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。在该反应中,氧化剂是_______ ,还原剂是_______ ,氧化产物是_______ ,还原产物是_______ 。
(2)水是生命之源,在常温常压下为无色无味液体,作为一种化学物质,水也会参与很多化学反应,如:
①2Na+2H2O=2NaOH+H2↑
②3NO2+H2O=2HNO3+NO
③2F2+2H2O=4HF+O2
④2H2O=2H2↑+O2↑
以上反应中,H2O只作氧化剂的是_______ ;H2O只作还原剂的是_______ ;H2O既作氧化剂,又作还原剂的是_______ ;H2O既不作氧化剂,又不作还原剂的是_______ 。
(3)高锰酸钾和浓盐酸可以发生如下反应制备氯气(Cl2):2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①已知KMnO4和MnCl2皆属于可溶盐,写出该反应的离子方程式_______ ;
②抄写化学方程式,用单线桥法标出电子转移的方向和数目_______ ;
③其中,氧化剂和还原剂的个数比为_______ 。
④在酸性溶液中,氧化性:KMnO4_______ Cl2(填大于或小于)。
(4)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2的化学方程式:_______ 。
(1)我国古代四大发明之一的黑火药是由硫磺粉、硝石(KNO3)、木炭粉按一定比例混合而成,爆炸时的反应为:S+2KNO3+3C=K2S+N2↑+3CO2↑。在该反应中,氧化剂是
(2)水是生命之源,在常温常压下为无色无味液体,作为一种化学物质,水也会参与很多化学反应,如:
①2Na+2H2O=2NaOH+H2↑
②3NO2+H2O=2HNO3+NO
③2F2+2H2O=4HF+O2
④2H2O=2H2↑+O2↑
以上反应中,H2O只作氧化剂的是
(3)高锰酸钾和浓盐酸可以发生如下反应制备氯气(Cl2):2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
①已知KMnO4和MnCl2皆属于可溶盐,写出该反应的离子方程式
②抄写化学方程式,用单线桥法标出电子转移的方向和数目
③其中,氧化剂和还原剂的个数比为
④在酸性溶液中,氧化性:KMnO4
(4)次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2的化学方程式:
您最近一年使用:0次
7 . 家庭用的洗涤去污剂有下列几种,其含有的有效成分如下:
(1)管道疏通剂可用于疏通管道中因毛发、残渣等造成的堵塞,使用时会产生大量气泡,且要防止明火,以免发生爆炸,则疏通时反应的离子方程式为___________ ,在该反应中每生成1mol气体,被还原的物质的质量为___________ g.也不能与“洁厕灵”混合使用,降低疏通效果,其原因是___________ 。
(2)洁厕灵与84消毒液混合使用会产生黄绿色的有毒气体,易造成危险,反应的离子方程式为___________ 。
(3)彩漂剂使用时会释放出一种无色无味的气体,使污垢活化,易于洗涤。但是不能长期存放,会降低彩漂效果,则发生的反应的还原产物为___________ (写化学式)。
(4)某兴趣小组做如下探究实验,请回答下列问题:
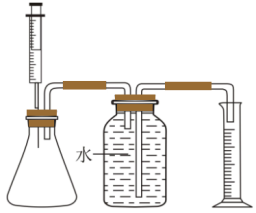
①如图组装实验装置,并___________ ;
②向锥形瓶加入10mL的84消毒液,注射器中吸入10mL的彩漂剂,
③将注射器中的彩漂剂慢慢注入锥形瓶中,产生无色无味的气体,发生的化学方程式为___________ 。
④直至不再产生气泡。
| 示例 |  |  |  |  |
| 名称 | 管道疏通剂 | 洁厕灵 | 彩漂剂 | 84消毒液 |
| 有效成分 | 氢氧化物和铝粉 | 浓盐酸 | 双氧水 | NaClO溶液 |
| 用途 | 清理管道污垢,防堵塞 | 清理马桶污垢,除异味 | 漂洗衣物,使色彩鲜艳 | 消毒漂白 |
(2)洁厕灵与84消毒液混合使用会产生黄绿色的有毒气体,易造成危险,反应的离子方程式为
(3)彩漂剂使用时会释放出一种无色无味的气体,使污垢活化,易于洗涤。但是不能长期存放,会降低彩漂效果,则发生的反应的还原产物为
(4)某兴趣小组做如下探究实验,请回答下列问题:

①如图组装实验装置,并
②向锥形瓶加入10mL的84消毒液,注射器中吸入10mL的彩漂剂,
③将注射器中的彩漂剂慢慢注入锥形瓶中,产生无色无味的气体,发生的化学方程式为
④直至不再产生气泡。
您最近一年使用:0次
名校
解题方法
8 . 刚玉在工业上有广泛的用途,其主要成分为 氧化铝。利用铝灰(主要成分为
氧化铝。利用铝灰(主要成分为 ,含少量杂质
,含少量杂质 、
、 、
、 )制备刚玉的工艺流程如下:
)制备刚玉的工艺流程如下:
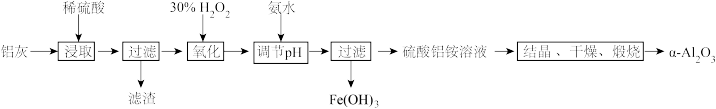
已知: 是酸性氧化物,且不与水反应。
是酸性氧化物,且不与水反应。
回答下列问题:
(1)滤渣的主要成分是_______ (填化学式);过滤时用到的玻璃仪器有漏斗、烧杯和_______ 。
(2)“氧化”操作的目的为_______ ,该过程中发生反应的离子方程式为_______ 。
(3)已知:生成氢氧化物沉淀的 如下表所示。
如下表所示。
用氨水“调节 ”,
”, 的范围是
的范围是_______ 。
(4)写出用氨水调节 生成
生成 沉淀的离子方程式:
沉淀的离子方程式:_______ 。
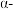 氧化铝。利用铝灰(主要成分为
氧化铝。利用铝灰(主要成分为 ,含少量杂质
,含少量杂质 、
、 、
、 )制备刚玉的工艺流程如下:
)制备刚玉的工艺流程如下:
已知:
 是酸性氧化物,且不与水反应。
是酸性氧化物,且不与水反应。回答下列问题:
(1)滤渣的主要成分是
(2)“氧化”操作的目的为
(3)已知:生成氢氧化物沉淀的
 如下表所示。
如下表所示。| 氢氧化物 |  |  |  |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 |
 ”,
”, 的范围是
的范围是(4)写出用氨水调节
 生成
生成 沉淀的离子方程式:
沉淀的离子方程式:
您最近一年使用:0次
2022-12-18更新
|
124次组卷
|
2卷引用:甘肃省武威市天祝一中、古浪一中、民勤一中联考2022-2023学年高一下学期3月月考化学试题
名校
9 . 亚硝酸( )是一种不稳定的酸,易分解为
)是一种不稳定的酸,易分解为 和
和 。亚硝酸钠是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质,常用作漂白剂、媒染剂。回答下列问题:
。亚硝酸钠是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质,常用作漂白剂、媒染剂。回答下列问题:
(1)亚硝酸钠会与人体中的血红蛋白作用,将二价铁氧化为三价铁,使血红蛋白丧失输送氧气的功能而使人体中毒。一旦发生亚硝酸盐中毒,应立即注射美蓝溶液进行治疗,据此可推断美蓝溶液具有___________ (填“氧化”或“还原”)性。
(2)亚硝酸钠外观极像食盐,且和食盐一样有咸味。工业上常用下列两种方法检验食盐中是否混有亚硝酸钠。
①取样品,加稀硫酸,若观察到___________ (填现象),则说明样品中含有亚硝酸钠。
②取样品,加___________ (填试剂名称),酸化后溶液变蓝,则说明样品中含有亚硝酸钠。
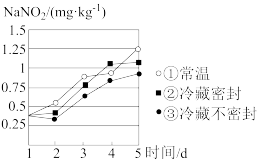
(3)研究不同条件下保存萝卜,得到萝卜中亚硝酸钠含量随时间变化的关系如图所示,若要保证在亚硝酸钠含量低于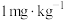 时食用,则三种条件下保存时间由长到短的顺序是
时食用,则三种条件下保存时间由长到短的顺序是___________ (填序号)。
(4)鱼塘中亚硝酸钠浓度过高,会导致鱼不吃食甚至死亡。可用适量二氧化氯( )处理亚硝酸钠,
)处理亚硝酸钠, 被还原为
被还原为 ,反应的离子方程式为
,反应的离子方程式为___________ ;若有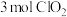 参与反应,则转移的电子数是
参与反应,则转移的电子数是___________ ( 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
 )是一种不稳定的酸,易分解为
)是一种不稳定的酸,易分解为 和
和 。亚硝酸钠是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质,常用作漂白剂、媒染剂。回答下列问题:
。亚硝酸钠是一种重要的化工原料,酸性条件下能氧化碘离子等还原性物质,常用作漂白剂、媒染剂。回答下列问题:(1)亚硝酸钠会与人体中的血红蛋白作用,将二价铁氧化为三价铁,使血红蛋白丧失输送氧气的功能而使人体中毒。一旦发生亚硝酸盐中毒,应立即注射美蓝溶液进行治疗,据此可推断美蓝溶液具有
(2)亚硝酸钠外观极像食盐,且和食盐一样有咸味。工业上常用下列两种方法检验食盐中是否混有亚硝酸钠。
①取样品,加稀硫酸,若观察到
②取样品,加
(3)研究不同条件下保存萝卜,得到萝卜中亚硝酸钠含量随时间变化的关系如图所示,若要保证在亚硝酸钠含量低于
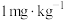 时食用,则三种条件下保存时间由长到短的顺序是
时食用,则三种条件下保存时间由长到短的顺序是
(4)鱼塘中亚硝酸钠浓度过高,会导致鱼不吃食甚至死亡。可用适量二氧化氯(
 )处理亚硝酸钠,
)处理亚硝酸钠, 被还原为
被还原为 ,反应的离子方程式为
,反应的离子方程式为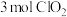 参与反应,则转移的电子数是
参与反应,则转移的电子数是 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
您最近一年使用:0次
名校
解题方法
10 . 黄色固体X是由四种元素组成的化合物,用作颜料和食品的抗结剂,为测定其组成,进行如下实验。已知气体D能使澄清石灰水变浑浊,溶液F中只含有一种溶质。回答下列问题:
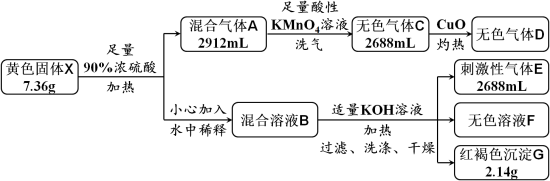
(1)固体X的组成元素是_______ 。
(2)混合气体A中所含物质的化学式为_______ 。
(3)实验中溶液B由X转化而来的溶质与KOH反应的总离子方程式为_______ 。
(4)证明沉淀G中的金属元素已完全沉淀的方法是_______ 。
(5)X与酸性KMnO4溶液反应,可生成一种与X组成元素相同,但式量比其小39的化合物,该反应的化学方程式为_______ 。

(1)固体X的组成元素是
(2)混合气体A中所含物质的化学式为
(3)实验中溶液B由X转化而来的溶质与KOH反应的总离子方程式为
(4)证明沉淀G中的金属元素已完全沉淀的方法是
(5)X与酸性KMnO4溶液反应,可生成一种与X组成元素相同,但式量比其小39的化合物,该反应的化学方程式为
您最近一年使用:0次
2022-12-09更新
|
426次组卷
|
4卷引用:甘肃省两县高中联考2023-2024学年高三上学期12月月考化学试题
甘肃省两县高中联考2023-2024学年高三上学期12月月考化学试题浙江省诸暨海亮高级中学2021-2022学年高三12月份选考模拟化学试题浙江省舟山中学2022-2023学年高三上学期首考模拟卷(三)化学试题(已下线)浙江省温州市普通高中2023届高三下学期第二次适应性考试化学试题变式题(无机推断题)



