名校
解题方法
1 . NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下,回答下列问题
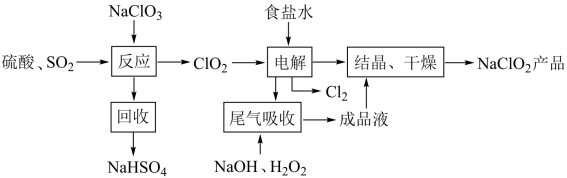
(1)NaClO2中Cl的化合价为______________________ .
(2)写出“反应”步骤中生成ClO2的化学方程式._______________________________ 。
(3)“电解”所用食盐水由粗盐水精制而成。粗盐精制时,为除去其中的Mg 2+和Ca 2+,要加入的试剂分别为_____________________ 、______________________ 。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应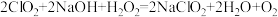 ,氧化剂与氧化产物的质量之比为
,氧化剂与氧化产物的质量之比为_________________ ,在标况下生成44.8LO2则转移电子的物质的量是____ .
(5)双氧水是中学常见的绿色化学试剂,既可以表现氧化性,又可以表现还原性。向双氧水中滴加酸性高锰酸钾溶液,产生气泡,紫红色褪去(已知Mn2+为无色),根据现象写出离子方程式._____________________________ 。

(1)NaClO2中Cl的化合价为
(2)写出“反应”步骤中生成ClO2的化学方程式.
(3)“电解”所用食盐水由粗盐水精制而成。粗盐精制时,为除去其中的Mg 2+和Ca 2+,要加入的试剂分别为
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应
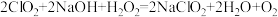 ,氧化剂与氧化产物的质量之比为
,氧化剂与氧化产物的质量之比为(5)双氧水是中学常见的绿色化学试剂,既可以表现氧化性,又可以表现还原性。向双氧水中滴加酸性高锰酸钾溶液,产生气泡,紫红色褪去(已知Mn2+为无色),根据现象写出离子方程式.
您最近一年使用:0次
名校
2 . 请按题目要求完成相应问题:
(1)K2FeO4在溶液中的电离方程式为_____________ 。
(2)除去杂质(括号的物质为杂质)Na2CO3溶液(NaHCO3) 离子方程式为_________________________ 。
(3)可溶性铁盐与足量氨水反应的离子方程式_______________________________________ 。
(4)氧化铁与强酸反应的离子反应方程式:_____________________________________ 。
(5)配平氧化还原反应:□C + □K2Cr2O7 + □H2SO4(稀) △□CO2↑+□K2SO4+□Cr2(SO4)3+□H2O___
(1)K2FeO4在溶液中的电离方程式为
(2)除去杂质(括号的物质为杂质)Na2CO3溶液(NaHCO3) 离子方程式为
(3)可溶性铁盐与足量氨水反应的离子方程式
(4)氧化铁与强酸反应的离子反应方程式:
(5)配平氧化还原反应:□C + □K2Cr2O7 + □H2SO4(稀) △□CO2↑+□K2SO4+□Cr2(SO4)3+□H2O
您最近一年使用:0次
名校
3 . (Ⅰ)如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:
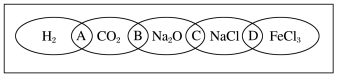
(1)请将分类依据代号填入相应的括号内:
( ) 两种物质都不是电解质
( ) 两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色。
①物质M的化学式为________________ 。
②证明有红褐色胶体生成的实验操作是____ 。
(Ⅱ)反应:
A.2F2+2H2O=4HF+O2↑; B.2Na+2H2O=2NaOH+H2↑;
C.CaO+H2O=Ca(OH)2; D.2H2O=2H2↑+O2↑。
其中水只是氧化剂的是______ (填序号),反应B中被氧化的元素名称是________ 。
(Ⅲ)反应:3Cu + 8HNO3 = 3Cu(NO3)2+2NO↑+4H2O, 硝酸在该反应中的作用是______ 还原剂与氧化剂的物质的量之比:__________

(1)请将分类依据代号填入相应的括号内:
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入饱和的图中某种物质M的溶液加热至呈红褐色。
①物质M的化学式为
②证明有红褐色胶体生成的实验操作是
(Ⅱ)反应:
A.2F2+2H2O=4HF+O2↑; B.2Na+2H2O=2NaOH+H2↑;
C.CaO+H2O=Ca(OH)2; D.2H2O=2H2↑+O2↑。
其中水只是氧化剂的是
(Ⅲ)反应:3Cu + 8HNO3 = 3Cu(NO3)2+2NO↑+4H2O, 硝酸在该反应中的作用是
您最近一年使用:0次
名校
解题方法
4 . 一种以辉铜矿(主要成分为Cu2S,含少量SiO2)为原料制备硝酸铜的工艺流程如图所示:
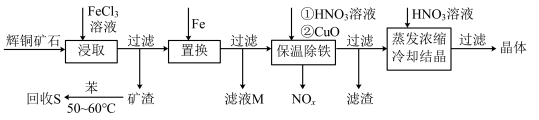
(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:___ 。
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②___ 。
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是___ 。
(4)向滤液M中加入(或通入)___ (填字母),可得到一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是__ ;“蒸发浓缩、冷却结晶”过程中,要用HNO3溶液调节溶液的pH,其理由_ 。
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S___ mol。


(1)写出“浸取”过程中Cu2S溶解时发生反应的离子方程式:
(2)恒温“浸取”的过程中发现铜元素的浸取速率先增大后减少,有研究指出CuCl2是该反应的催化剂,该过程的反应原理可用化学方程式表示为:①Cu2S +2CuCl2=4CuCl+S;②
(3)“回收S”过程中温度控制在50~60℃之间,不宜过高的原因是
(4)向滤液M中加入(或通入)
a.铁 b.氯气 c.高锰酸钾 d.氯化氢
(5)“保温除铁”过程中,加入CuO的目的是
(6)辉铜矿可由黄铜矿(主要成分为CuFeS2)通过电化学反应转变而成,有关转化见图,转化时转移0.2mol电子,生成Cu2S

您最近一年使用:0次
2019-12-19更新
|
1285次组卷
|
10卷引用:宁夏石嘴山市第三中学2020届高三第五次模拟考试理综化学试题
宁夏石嘴山市第三中学2020届高三第五次模拟考试理综化学试题广东省六校联盟(深圳实验,广州二中,珠海一中,惠州一中,东莞中学,中山纪中)2020届高三第二次联考理综化学试题宁夏六盘山高级中学2020届高三下学期第二次模拟考试理综化学试题江西省南昌市第二中学2020届高三5月模拟理综化学试题江西省南昌市第二中学2021届高三上学期第四次考试理综化学试题江西省新余市第四中学2021届高三化学上学期第四次考试试题2020届高三《新题速递·化学》1月第01期(考点11-13)2022届陕西省宝鸡市陈仓区高考模拟检测(二)理综化学试题天津市河东区2022-2023学年高三上学期期中检测化学试题(已下线)第三章 金属及其化合物 第15练 金属材料 金属冶炼
2011·山东济南·一模
5 . 已知Co2O3在酸性溶液中易被还原成Co2+,且Co2O3、Cl2、FeCl3、I2的氧化性依次减弱。下列叙述中,正确的是( )
| A.FeCl3溶液能使淀粉-KI试纸变蓝 |
| B.Cl2通入FeI2溶液中,可存在反应3Cl2+6FeI2═2FeCl3+4FeI3 |
| C.每1 mol Co2O3在酸性溶液中被氧化生成Co2+时转移2 mol e-电子 |
| D.I2是ⅦA族元素单质,具有较强的氧化性,可以将Co2+氧化成Co2O3 |
您最近一年使用:0次
2019-12-16更新
|
99次组卷
|
9卷引用:宁夏回族自治区吴忠市青铜峡市高级中学2020届高三上学期第二次月考化学试题
宁夏回族自治区吴忠市青铜峡市高级中学2020届高三上学期第二次月考化学试题【全国百强校】福建省三明市第一中学2019届高三上学期第一次月考化学试题陕西省榆林市第十二中学2021届高三上学期第二次月考化学试题(已下线)2011届山东省济南市高三教学质量调研(一模)化学试卷2016-2017学年浙江省余姚中学高一上期中化学试卷福建省长汀、连城一中等六校2020届高三上学期期中考联考化学试题广西桂林市龙胜中学2020届高三上学期期中考试化学试题(已下线)【新东方】【2019】【高一上】【期中考】【JYZ】【化学】第25届(2011年)高中生化学竞赛(河北赛区)初赛试题
名校
解题方法
6 . 利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(Ⅲ)回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+、Mg2+):
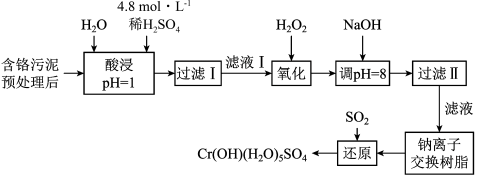
部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
(1)实验室用18.4 mol·L-1的浓硫酸配制250 mL 4.8 mol·L-1的硫酸溶液,所用的玻璃仪器除烧杯、玻璃棒和吸量管(一种能精确量取一定体积液体的仪器)外,还需 ______________________ 。
(2)酸浸时,为了提高浸取率可采取的措施有___________________________ 。(写出两个措施)
(3)加入H2O2的作用是_____________________________________ 。
(4)加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有______ ;但溶液的pH不能超过8,其理由是_______________ 。
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是___________________ 。
(6)写出上述流程中用SO2进行还原的离子方程式___________________________ 。

部分阳离子常温下以氢氧化物形式沉淀时溶液的pH见下表:
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | —— | —— | 4.7 | —— |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
(2)酸浸时,为了提高浸取率可采取的措施有
(3)加入H2O2的作用是
(4)加入NaOH溶液使溶液呈碱性,Cr2O72―转化为CrO42―。滤液Ⅱ中阳离子主要有
(5)钠离子交换树脂的反应原理为:Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是
(6)写出上述流程中用SO2进行还原的离子方程式
您最近一年使用:0次
2019-12-09更新
|
139次组卷
|
2卷引用:宁夏回族自治区银川市兴庆区长庆高级中学2020届高三上学期第四次月考理综化学试题
名校
7 . (1)配平下列方程式(不需写出配平过程)
________ H2S+_______ HNO3 =________ S↓ +________ NO↑ +_______ H2O
________ S+________ KOH=________ K2S+________ K2SO3 +________ H2O
________ KMnO4+________ HCl(浓)=________ KCl+________ MnCl2+________ Cl2↑+________ H2O
(2)在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O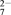 还原为Cr3+,该过程的离子反应方程式为
还原为Cr3+,该过程的离子反应方程式为________________________ 。
(2)在酸性条件下,向含铬废水中加入FeSO4溶液,可将Cr2O
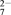 还原为Cr3+,该过程的离子反应方程式为
还原为Cr3+,该过程的离子反应方程式为
您最近一年使用:0次
8 . 高锰酸钾溶液沾到皮肤上形成黑斑,可以用草酸H2C2O4洗除,原理如下:MnO4-+H2C2O4+H+→CO2↑+Mn2++ 下列叙述正确的是
| A.H2C2O4发生还原反应 | B.MnO4-氧化产物为Mn2+ |
| C.横线的物质为H2O | D.生成22.4 L CO2,则转移5 mol电子 |
您最近一年使用:0次
2019-11-25更新
|
127次组卷
|
2卷引用:宁夏回族自治区吴忠市青铜峡市高级中学2020届高三上学期第二次月考化学试题
名校
9 . 氧化还原反应在生产、生活中具有广泛的用途,贯穿古今。
(1)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原
反应的关系”可用如图表达。
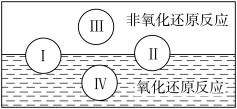
试写出有水参加的符合反应类型Ⅳ的一个化学方程式:_____________________________ ,其中水为________ 剂。
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:___ CuO+____ NH4Cl 
____ Cu+____ CuCl2+____ N2↑+____ H2O。
①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是______ (填元素名称),氧化剂是________ (填化学式)。
③反应中若产生0.2mol的气体,则有________ mol的电子转移。
(1)水是人体的重要组成部分,是人体中含量最多的一种物质。而“四种基本反应类型与氧化还原
反应的关系”可用如图表达。

试写出有水参加的符合反应类型Ⅳ的一个化学方程式:
(2)氯化铵常用作焊接。如:在焊接铜器时用氯化铵除去铜器表面的氧化铜以便焊接,其反应为:

①配平此氧化还原反应方程式。
②该反应中,被氧化的元素是
③反应中若产生0.2mol的气体,则有
您最近一年使用:0次
2019-11-14更新
|
140次组卷
|
2卷引用:宁夏回族自治区顶级名校2019-2020学年高一上学期12月考试化学试题
名校
10 . V2O5是钒的重要化合物,工业上多由各种类型的钒矿石提取。根据描述写方程式。
(1)用氯化焙烧法处理钒铅矿。具体为将食盐和钒铅矿(主要含V2O5)在空气中焙烧,产生黄绿色气体,并生成NaVO3。写出化学方程式___________ ;
(2)V2O5具有微弱的碱性,溶于强酸,当pH=1时生成淡黄色的VO2+___________ ;酸性介质中VO2+是一种较强的氧化剂,可以被草酸(H2C2O4)还原为VO2+_____________ ,I-能将VO2+还原为V3+____________ (写出对应离子方程式);
(3)V2O5也是一种强氧化剂,溶于盐酸被还原为VOCl2,并放出氯气。写出对应化学方程式___________ 。
(1)用氯化焙烧法处理钒铅矿。具体为将食盐和钒铅矿(主要含V2O5)在空气中焙烧,产生黄绿色气体,并生成NaVO3。写出化学方程式
(2)V2O5具有微弱的碱性,溶于强酸,当pH=1时生成淡黄色的VO2+
(3)V2O5也是一种强氧化剂,溶于盐酸被还原为VOCl2,并放出氯气。写出对应化学方程式
您最近一年使用:0次



