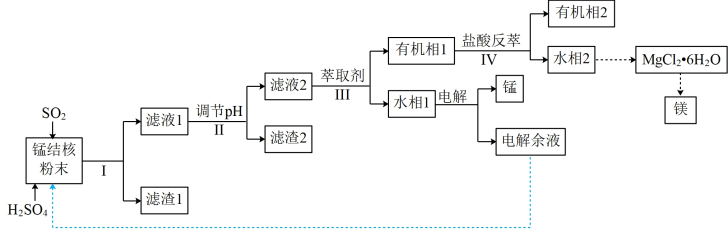
1 . 用海底锰结核(主要成分为MnO2,含少量MgO、Fe2O3、Al2O3、SiO2)为原料,制备金属锰、镁的一种工艺流程路线如下:
已知:①几种难溶物的溶度积(25℃)如下表所示:
②溶液中某离子浓度≤1.0×10-6mol·L-1时,认为该离子沉淀完全。
完成下列问题:
(1)“锰结核粉末”中MnO2与SO2反应的离子方程式为_____ 。
(2)“滤液1”中c(Mn2+)为0.18mol·L-1,则“调节pH”的范围为_______ ,“滤渣2”的成分为______ 。
(3)“Ⅲ”处“萃取剂”萃取的成分是___ ;“Ⅳ”处用“盐酸反萃”的作用是____ 。
(4)MgCl2·6H2O制取无水MgCl2时,需要在干燥的HCl气流中加热分解。HCl的作用为__________ 。
(5)该工艺流程中除电解余液可循环利用外,还能循环利用的试剂为____ 。
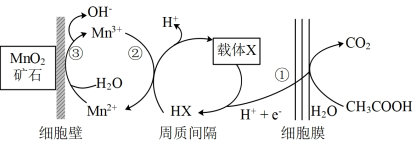
(6)一种海生假单孢菌(采自太平洋深海处),在无氧条件下以醋酸为电子供体还原MnO2生成Mn2+的机理如图所示。写出反应②③的总反应的离子方程式____________ 。

已知:①几种难溶物的溶度积(25℃)如下表所示:
| 化学式 | Mg(OH)2 | Mn(OH)2 | Al(OH)3 | Fe(OH)3 |
| Ksp | 1.8×10-11 | 1.8×10-13 | 1.0×10-33 | 4.0×10-38 |
②溶液中某离子浓度≤1.0×10-6mol·L-1时,认为该离子沉淀完全。
完成下列问题:
(1)“锰结核粉末”中MnO2与SO2反应的离子方程式为
(2)“滤液1”中c(Mn2+)为0.18mol·L-1,则“调节pH”的范围为
(3)“Ⅲ”处“萃取剂”萃取的成分是
(4)MgCl2·6H2O制取无水MgCl2时,需要在干燥的HCl气流中加热分解。HCl的作用为
(5)该工艺流程中除电解余液可循环利用外,还能循环利用的试剂为
(6)一种海生假单孢菌(采自太平洋深海处),在无氧条件下以醋酸为电子供体还原MnO2生成Mn2+的机理如图所示。写出反应②③的总反应的离子方程式

您最近一年使用:0次
2020-07-20更新
|
567次组卷
|
6卷引用:宁夏石嘴山市第三中学2021届高三上学期期末考试理综化学试题
宁夏石嘴山市第三中学2021届高三上学期期末考试理综化学试题河南省郑州市2020届高三第三次质量预测理科综合化学试题(已下线)2021年高考化学押题预测卷(山东卷)(01)(含考试版、答题卡、参考答案、全解全析)陕西省西安中学2021届高三第七次模拟考试化学试题甘肃省武威第六中学 2022~2023学年高三上学期第二次阶段性考试化学试题广东省开平市忠源纪念中学2022届高三考前热身考试化学试题
名校
2 . (1)一个体重50kg的健康人含Fe元素约2g。主要以Fe2+、Fe3+形式存在于人体内。Fe2+易被吸收,给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用Vc可使食物中的Fe3+转化为Fe2+。人体中经常进行Fe2+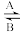 Fe3+的转化,在过程A中,Fe2+做
Fe3+的转化,在过程A中,Fe2+做__ 剂,过程B中Fe3+做___ 剂。
(2)请按要求正确书写:
①“铁与硫酸铜溶液反应”(离子方程式):__ ;
②用CO还原Fe2O3(化学方程式):__ 。
(3)某一反应中有反应物和生成物的粒子共6种:SO32-、I2、H+、SO42-、I-、H2O,已知该反应中I2只发生如下过程:I2→I-,请回答:
①该反应的还原剂是__ (填分子或离子符号)。
②反应过程中,每有1molI2发生反应,转移的电子数为__ 。
③写出该反应的离子方程式(用单线桥法表示出电子的转移方向及数目)__ 。
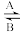 Fe3+的转化,在过程A中,Fe2+做
Fe3+的转化,在过程A中,Fe2+做(2)请按要求正确书写:
①“铁与硫酸铜溶液反应”(离子方程式):
②用CO还原Fe2O3(化学方程式):
(3)某一反应中有反应物和生成物的粒子共6种:SO32-、I2、H+、SO42-、I-、H2O,已知该反应中I2只发生如下过程:I2→I-,请回答:
①该反应的还原剂是
②反应过程中,每有1molI2发生反应,转移的电子数为
③写出该反应的离子方程式(用单线桥法表示出电子的转移方向及数目)
您最近一年使用:0次
名校
3 . (1)FeS2(二硫化亚铁)不溶于水,可溶于适量的稀硝酸中,离子反应式如下,请配平此氧化还原反应方程式:_____ FeS2+_____H++_____N =______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为
=______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为_____________ 。
(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是____________ (填字母)

A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1 L 0.2 mol·L-1的FeBr2溶液中通入标准状况下氯气2.24 L,被氧化的粒子是________ ,此反应的离子方程式:________ 。
 =______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为
=______Fe2++______S+_____NO↑+______H2O。在上述氧化还原反应方程式中还原剂为(2)为了验证Fe3+的性质,某化学兴趣小组设计了如图所示的一组实验,实验方案设计错误的是

A.④和⑤ B.只有③ C.③和④ D.①②③
(3)已知:氧化性Cl2>Br2>Fe3+,还原性Fe2+>Br->Cl-,则向1 L 0.2 mol·L-1的FeBr2溶液中通入标准状况下氯气2.24 L,被氧化的粒子是
您最近一年使用:0次
2020-01-13更新
|
238次组卷
|
4卷引用:【全国百强校】宁夏回族自治区银川一中2018-2019学年高一上学期期末考试化学试题
名校
解题方法
4 . (1)某反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2 ;已知该反应中H2O2只发生所示变化:H2O2→O2 ;写出该反应的化学方程式___________________ ,氧化产物与还原产物的物质的量之比为______ 。
(2)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S=K2S+N2↑+3CO2↑,此反应中的氧化剂是______ ,氧化产物是____ (均用化学式填写)。当参加反应的S的质量为16g时,爆炸生成的气体折算成标准状况时的体积为_______ ,生成的气体的平均相对分子质量为______ ,反应过程中转移电子总数目为________ 个。
(2)火药是中国的“四大发明”之一,永远值得炎黄子孙骄傲。黑火药在发生爆炸时,发生如下的反应:2KNO3+3C+S=K2S+N2↑+3CO2↑,此反应中的氧化剂是
您最近一年使用:0次
名校
5 . 发射“神舟七号”载人飞船的是我国自行研制的“长征一号D”运载火箭。该火箭的主要燃料是偏二甲肼(用R表示)和四氧化二氮,在火箭发射时,两者剧烈反应产生大量气体并释放出大量的热,该反应的化学方程式为:R+2N2O4=3N2+4H2O+2CO2,下列叙述错误的是( )
| A.此反应是氧化还原反应 | B.该反应产物均为非电解质 |
C.R的分子式为 | D.反应瞬间产生大量高温气体,推动火箭飞行 |
您最近一年使用:0次
2019-11-29更新
|
186次组卷
|
5卷引用:宁夏吴忠中学2021-2022学年高一上学期期末考试化学试题
名校
6 . 氧化剂和还原剂在生产生活中广泛使用。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O
①其中还原剂为___ ,还原产物为___ 。
②若有0.8mol还原剂被氧化,则转移电子的物质的量是___ 。
(2)古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:
__ NaClO+__ NH3·H2O→___ N2H4+___ NaCl+___ H2O
①请配平上述化学方程式。
②NH3·H2O在上述反应中显示出来的性质是___ 。
A.氧化性 B.还原性
C.酸性 D.碱性
(3)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为____ ,但Fe2+在酸性条件下很容易被空气中的氧气氧化,写出该反应的离子方程式_____ 。
(4)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中P元素的化合价为____ 。
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂物质的量之比为4∶1,则氧化产物为___ 。
(1)高锰酸钾和氢溴酸溶液可以发生如下反应:2KMnO4+16HBr=5Br2+2MnBr2+2KBr+8H2O
①其中还原剂为
②若有0.8mol还原剂被氧化,则转移电子的物质的量是
(2)古老但仍然是最有用的制备联氨(N2H4)溶液的方法如下:
①请配平上述化学方程式。
②NH3·H2O在上述反应中显示出来的性质是
A.氧化性 B.还原性
C.酸性 D.碱性
(3)人体内所含铁元素以Fe2+和Fe3+的形式存在。市场出售的某种麦片中含有微量的颗粒细小的还原铁粉,这些铁粉在人体胃酸的作用下转化成亚铁盐,此反应的离子方程式为
(4)H3PO2和NaH2PO2均可将溶液中的Ag+还原为Ag,从而可用于化学镀银。
①H3PO2中P元素的化合价为
②利用H3PO2进行化学镀银反应中,氧化剂与还原剂物质的量之比为4∶1,则氧化产物为
您最近一年使用:0次
2019-10-20更新
|
404次组卷
|
6卷引用:宁夏银川市第二中学2021-2022学年高一上学期期末考试化学试题
真题
名校
7 . 若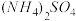 在强热时分解的产物是
在强热时分解的产物是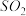 、
、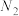 、
、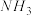 和
和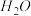 ,则该反应中化合价发生变化和未发生变化的N原子数之比为
,则该反应中化合价发生变化和未发生变化的N原子数之比为
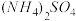 在强热时分解的产物是
在强热时分解的产物是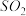 、
、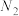 、
、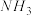 和
和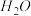 ,则该反应中化合价发生变化和未发生变化的N原子数之比为
,则该反应中化合价发生变化和未发生变化的N原子数之比为| A.1:4 | B.1:2 | C.2:1 | D.4:1 |
您最近一年使用:0次
2019-01-30更新
|
1491次组卷
|
28卷引用:宁夏石嘴山市第三中学2021-2022学年高一上学期期末考试化学试题
宁夏石嘴山市第三中学2021-2022学年高一上学期期末考试化学试题(已下线)2010年云南省玉溪一中高二下学期期末考试化学试题(已下线)2011-2012学年四川省巴中市四县中高一上期期末联考化学试卷(已下线)2013-2014学年辽宁省抚顺市六校联合体高二下学期期末考试化学试卷贵州省剑河县二中2018-2019学年高二上学期期末考试化学试题河北省易县中学2018-2019学年高二下学期期末考试化学试题云南省盈江县民族完全中学2019-2020学年高二上学期期末考试化学试题云南省剑川县第一中学2019-2020学年高一上学期期末考试化学试题宁夏银川市唐徕中学2023-2024学年高三上学期9月月考化学试题2010年普通高等学校招生统一考试理综试题化学部分(全国卷II)(已下线)2011-2012学年云南省玉溪一中高二上学期期中考试化学(理)试卷(已下线)2011-2012年江西省吉安一中高一上学期期中考试化学试卷(已下线)2012届福建省厦门市翔安一中高三11月份月考化学试卷(已下线)2012届山东省济宁市鱼台二中高三11月月考化学试卷(已下线)2015届黑龙江省哈师大附中高三第一次月考化学试卷2015-2016学年河北省武邑中学高一下周考化学试卷甘肃省兰州市第一中学2018届高三8月月考化学试题山西省康杰中学2018届高三上学期第一次月考化学试卷【全国百强校】内蒙古鄂尔多斯市第一中学2018-2019学年高一上学期期中考试化学试题云南省昭通鲁甸县二中2019-2020学年高一10月月考化学试题内蒙古第一机械制造(集团)有限公司第一中学2020届高三上学期第一次月考化学试题2020年春季人教版高中化学必修1第二章《化学物质及其变化》测试卷2020届高三化学总复习考点强化练习:物质及其变化(已下线)【浙江新东方】36新疆新和县实验中学2020-2021学年高三上学期期中考试化学试题江西省九江市柴桑区第一中学2021-2022学年高三上学期第二次月考化学试题黑龙江省大庆外国语学校2021-2022学年高一下学期开学考试化学试题微专题(三)——氧化还原反应方程式的配平与书写
8 . 氯化铬晶体(CrCl3·6H2O)是一种重要的工业原料,工业上常用铬酸钠(Na2CrO4)来制备。实验室以红矾钠(Na2Cr2O7)为原料制备CrCl3·6H2O的流程如下
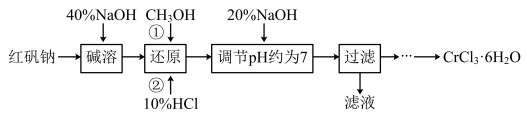
已知:
①Cr2O72-+H2O⇌2CrO42-+2H+;
②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)写出碱溶发生反应的化学方程式___________________________ ,所加40‰NaOH不宜过量太多的原因是_________________________________ 。
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式______________________ ,反应后从剩余溶液中分离出CH3OH的实验方法是___________ 。
(3)使用下列用品来测定溶液的pH,合理的是___________ (填字母)。
A.酚酞溶液 B.石蕊试纸 C.pH计
(4)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体完全溶解于过量的盐酸中,蒸发浓缩,___________ ,过滤,___________ ,低温干燥,得到CrC3·6H2O(实验中可供选择的试剂:盐酸、硫酸、蒸馏水、乙醇、乙醚)。
(5)若取原料红矾钠26.2g,实验最终得到氯化铬晶体21.32g,则该实验的产率为___________ 。

已知:
①Cr2O72-+H2O⇌2CrO42-+2H+;
②CrCl3·6H2O不溶于乙醚,易溶于水、乙醇,易水解。
(1)写出碱溶发生反应的化学方程式
(2)还原时先加入过量CH3OH再加入10%HCl,生成CO2,写出该反应的离子方程式
(3)使用下列用品来测定溶液的pH,合理的是
A.酚酞溶液 B.石蕊试纸 C.pH计
(4)请补充完整由过滤后得到的固体Cr(OH)3制备CrCl3·6H2O的实验方案:将过滤后所得的洁净固体完全溶解于过量的盐酸中,蒸发浓缩,
(5)若取原料红矾钠26.2g,实验最终得到氯化铬晶体21.32g,则该实验的产率为
您最近一年使用:0次
2019-01-30更新
|
159次组卷
|
2卷引用:【市级联考】宁夏回族自治区吴忠市2019届高三上学期期末考试化学试题
10-11高三上·福建厦门·阶段练习
名校
9 . 在上海召开的第七届全球人类基因大会上,我国科学家第一次提出可以用砒霜(As2O3)来治疗早期幼粒白血病。
(1)完成并配平下列化学方程式:_____________
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是_____________ 。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为___________ mol。
(1)完成并配平下列化学方程式:
As2O3+ Zn+ H2SO4 → AsH3+ ZnSO4+ ______
(2)As2O3在上述反应中显示出来的性质是
A.氧化性 B.还原性 C.酸性 D.碱性
(3)若生成0.1 mol AsH3,则转移电子的物质的量为
您最近一年使用:0次
2018-12-11更新
|
125次组卷
|
4卷引用:宁夏固原市隆德县2020-2021学年高一上学期期末考试化学试题
宁夏固原市隆德县2020-2021学年高一上学期期末考试化学试题(已下线)2010年福建省厦门市杏南中学高三上学期10月月考化学卷福建省惠安惠南中学2019届高三上学期期中考试化学试题【全国百强校】山东省泰安市第一中学2019届高三上学期12月学情诊断化学试题
名校
解题方法
10 . 硝酸是一种重要的化工原料,用来制取一系列硝酸盐类氮肥,如硝酸铵、硝酸钾等;也用来制取硝基的炸药等。有机化工中也用硝酸与丙烯或乙烯、乙二醇作用制取草酸。
(1)某同学对铁与稀硝酸的反应进行探究,若稀HNO3只被还原成NO。
①写出铁与过量稀硝酸反应的离子方程式_______________________________ 。
②写出过量铁与稀硝酸反应的离子方程式_______________________________ 。
③若28克铁与含1.6摩尔硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比__________________ 。
④上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为_________ g。
(2)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中的NO3-浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:____ Al+___NO3-+___OH-==___AlO2-+___N2↑+_________。
②上述反应中,还原剂与还原产物的物质的量之比是____ ,反应中转移电子0.3mol,标准状况下生成N2是___________ mL。
(1)某同学对铁与稀硝酸的反应进行探究,若稀HNO3只被还原成NO。
①写出铁与过量稀硝酸反应的离子方程式
②写出过量铁与稀硝酸反应的离子方程式
③若28克铁与含1.6摩尔硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比
④上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为
(2)饮用水中的NO3-对人类健康会产生危害,为了降低饮用水中的NO3-浓度,某饮用水研究人员提出,在碱性条件下用铝粉将NO3-还原为N2。
①配平方程式:
②上述反应中,还原剂与还原产物的物质的量之比是
您最近一年使用:0次
2018-01-26更新
|
425次组卷
|
4卷引用:宁夏银川一中2017-2018学年高一上学期期末考试化学试题



