1 . 化学基本概念和研究方法要准确掌握,下列是某同学对有关物质进行分类的列表:
(1)上述三组分类中的错误物质有______ 种。
(2)砷是与磷相邻同主族元素,则其在周期表的位置是______ ;砷化氢的电子式:______ ,它是一种有剧毒恶臭的无色气体,还原性极强,能与硝酸银反应生成Ag和砒霜(As2O3),反应的离子方程式为______ 。
(3)已知: ,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出
,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出______ 克I2(小数点后保留2位)。
(4)除去KCl溶液中少量的K2SO4杂质,要判断所加BaCl2溶液已经过量,操作是______ 。
(5)依据化学方程式,回答下列问题: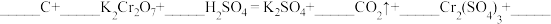
①配平完善化学方程式:_______________ 。
②H2SO4在上述反应中表现出来的性质是______ 。
③若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为______ L。
| 组序号 | 单质 | 碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 |
| ① | 灰砷(α-As) | Na2CO3 | H2C2O4 | K2SO4 | Na2O2 | SO3 |
| ② | 臭氧 | Fe(OH)3胶体 | H37Cl | KAl(SO4)2 | CaO | As2O3 |
| ③ | I2 | Al(OH)3 | CH3OH | K2Cr2O7 | Al2O3 | NO2 |
(2)砷是与磷相邻同主族元素,则其在周期表的位置是
(3)已知:
 ,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出
,在标准状况下,750ml含有O3的O2,当其中所含O3完全分解后体积变为780ml,若将此含有O3的O2lL通入KI溶液中,能析出(4)除去KCl溶液中少量的K2SO4杂质,要判断所加BaCl2溶液已经过量,操作是
(5)依据化学方程式,回答下列问题:
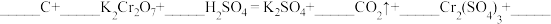
①配平完善化学方程式:
②H2SO4在上述反应中表现出来的性质是
③若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为
您最近一年使用:0次
名校
解题方法
2 . 对于数以千万计的化学物质和为数众多的化学反应,分类法的作用几乎是无可代替的。
Ⅰ.现有以下物质:①H2O、②Al、③Fe3O4、④Fe(OH)3胶体、⑤FeBr2溶液、⑥干冰、⑦稀硫酸、⑧酒精、⑨Cl2。
(1)以上物质中属于混合物的是___________ (填序号,下同),既不属于电解质也不属于非电解质的是___________ 。
(2)向④中逐滴滴加⑦,可观察到的现象是___________ 。
Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
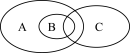
(3)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是___________ (填字母)。
(4)写出物质③和⑦发生反应的离子方程式:___________ 。
(5)写出上述物质用于焊接钢轨的化学方程式:___________ 。
(6)向⑤中通入⑨,至Cl2与FeBr2物质的量相等时的离子方程式:___________ 。
Ⅰ.现有以下物质:①H2O、②Al、③Fe3O4、④Fe(OH)3胶体、⑤FeBr2溶液、⑥干冰、⑦稀硫酸、⑧酒精、⑨Cl2。
(1)以上物质中属于混合物的是
(2)向④中逐滴滴加⑦,可观察到的现象是
Ⅱ.虽然分类的方法不同,但四种基本反应类型和离子反应、氧化还原反应之间也存在着一定的关系。
(3)下图为离子反应、氧化还原反应和置换反应三者之间的关系,其中表示离子反应的是

(4)写出物质③和⑦发生反应的离子方程式:
(5)写出上述物质用于焊接钢轨的化学方程式:
(6)向⑤中通入⑨,至Cl2与FeBr2物质的量相等时的离子方程式:
您最近一年使用:0次
2023-08-10更新
|
138次组卷
|
2卷引用:山东省实验中学2022-2023学年高一上学期12月月考化学试题
名校
解题方法
3 . 氧化还原反应对我们的生产和生活同时具有正负两方面的影响,如果我们能够掌握化学变化的规律,就有可能做到趋利避害,使之更好地为社会发展服务。下面我们逐一分析:
(1)黑火药是我国古代的四大发明之一,黑火药着火时,发生如下氧化还原反应: 。在此反应中,还原剂为
。在此反应中,还原剂为_______ (填化学式),还原产物是_______ (填化学式),当该反应转移2.4mol电子时,产生气体的体积为_______ L(标况下)。
(2)湿法制备高铁酸钾( )是在碱性环境中进行,反应体系中有六种反应微粒:
)是在碱性环境中进行,反应体系中有六种反应微粒: 、
、 、
、 、
、 、
、 、
、 。请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:
。请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:_______ 。
(3)汽车剧烈碰撞时,安全气囊中发生反应: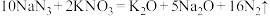 。若反应得到的氧化产物比还原产物多2.8mol,则此过程中转移电子的个数为
。若反应得到的氧化产物比还原产物多2.8mol,则此过程中转移电子的个数为_______ 。
(4) 与一定浓度的
与一定浓度的 反应,生成
反应,生成 、
、 、
、 、NO和
、NO和 ,当
,当 和NO的个数之比为2∶1时,则表现酸性与表现氧化性的
和NO的个数之比为2∶1时,则表现酸性与表现氧化性的 的个数之比为
的个数之比为_______ 。
(1)黑火药是我国古代的四大发明之一,黑火药着火时,发生如下氧化还原反应:
 。在此反应中,还原剂为
。在此反应中,还原剂为(2)湿法制备高铁酸钾(
 )是在碱性环境中进行,反应体系中有六种反应微粒:
)是在碱性环境中进行,反应体系中有六种反应微粒: 、
、 、
、 、
、 、
、 、
、 。请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:
。请依据上述信息,写出并配平湿法制高铁酸钾的离子方程式:(3)汽车剧烈碰撞时,安全气囊中发生反应:
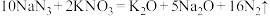 。若反应得到的氧化产物比还原产物多2.8mol,则此过程中转移电子的个数为
。若反应得到的氧化产物比还原产物多2.8mol,则此过程中转移电子的个数为(4)
 与一定浓度的
与一定浓度的 反应,生成
反应,生成 、
、 、
、 、NO和
、NO和 ,当
,当 和NO的个数之比为2∶1时,则表现酸性与表现氧化性的
和NO的个数之比为2∶1时,则表现酸性与表现氧化性的 的个数之比为
的个数之比为
您最近一年使用:0次
2023-01-14更新
|
434次组卷
|
2卷引用:山东省实验中学2022-2023学年高一上学期期末考试化学试题
名校
解题方法
4 . 硫有多种化合物,如H2S、SO2等,它们对环境均有一定的影响,含硫化合物的综合利用既可以消除污染,又可以带来一定的经济效益。
(1)有学者提出利用Fe3+、Fe2+等离子的作用,在常温下将SO2氧化成SO 而实现SO2的回收利用,写出Fe3+将SO2氧化成SO
而实现SO2的回收利用,写出Fe3+将SO2氧化成SO 反应的离子方程式
反应的离子方程式_______ 。
(2)含有Fe2+、Fe3+的硫酸盐混合溶液可用于吸收H2S回收硫单质,其转化关系如图所示。
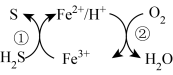
该图示中总反应的化学方程式为_______ 。
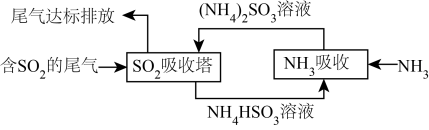
(3)某企业利用下列流程综合处理工厂排放的含SO2的烟气,以减少其对环境造成的污染。“SO2吸收塔”中发生反应的化学方程式为_______ ,该流程中可循环利用的物质为_______ (填化学式)。
(4)生产过程中的尾气需要测定SO2的含量符合标准才能排放。已知有VL(已换算成标准状况)尾气,通入足量H2O2溶液吸收再加入足量BaCl2溶液充分反应后(不考虑尾气中其它成分的反应),过滤,洗涤、干燥、称量得到bg沉淀。H2O2溶液的作用是_______ ;尾气中SO2含量(体积分数)的计算式是_______ (用含V、b的代数式表示)。
(1)有学者提出利用Fe3+、Fe2+等离子的作用,在常温下将SO2氧化成SO
 而实现SO2的回收利用,写出Fe3+将SO2氧化成SO
而实现SO2的回收利用,写出Fe3+将SO2氧化成SO 反应的离子方程式
反应的离子方程式(2)含有Fe2+、Fe3+的硫酸盐混合溶液可用于吸收H2S回收硫单质,其转化关系如图所示。
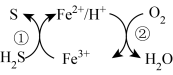
该图示中总反应的化学方程式为
(3)某企业利用下列流程综合处理工厂排放的含SO2的烟气,以减少其对环境造成的污染。“SO2吸收塔”中发生反应的化学方程式为

(4)生产过程中的尾气需要测定SO2的含量符合标准才能排放。已知有VL(已换算成标准状况)尾气,通入足量H2O2溶液吸收再加入足量BaCl2溶液充分反应后(不考虑尾气中其它成分的反应),过滤,洗涤、干燥、称量得到bg沉淀。H2O2溶液的作用是
您最近一年使用:0次
名校
解题方法
5 . 按要求填空:
(1)现有以下物质:①NaHCO3;②O2;③CH3COOH溶液;④Ca(OH)2;⑤蔗糖;⑥H2O;⑦NaCl;⑧CO2;⑨氨水,
a.其中能导电的是(填编号,下同):_______ ;属于电解质的是_______ ;属于非电解质的是:_______ 。
b.请写出③和⑨反应的离子方程式_______
c.过量的①和少量的④在水溶液中的离子方程式为_______
(2)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,其一种制备原理如下,把方程式补充完整并配平:______
_______ClO-+_______Fe3++_______=_______ _______Cl-+_______H2O
_______Cl-+_______H2O
(1)现有以下物质:①NaHCO3;②O2;③CH3COOH溶液;④Ca(OH)2;⑤蔗糖;⑥H2O;⑦NaCl;⑧CO2;⑨氨水,
a.其中能导电的是(填编号,下同):
b.请写出③和⑨反应的离子方程式
c.过量的①和少量的④在水溶液中的离子方程式为
(2)高铁酸钠(Na2FeO4)是一种新型绿色消毒剂,其一种制备原理如下,把方程式补充完整并配平:
_______ClO-+_______Fe3++_______=_______
 _______Cl-+_______H2O
_______Cl-+_______H2O
您最近一年使用:0次
6 . 三氟化氮(NF3)是一种新型电子材料,它在潮湿的空气中与水蒸气能发生氧化还原反应,其反应的产物有:HF、NO和HNO3,请根据要求回答下列问题:
(1)反应过程中,氧化剂是_______ ,还原剂是_______ ,被氧化与被还原的元素原子的物质的量之比为_______ 。
(2)写出该反应的化学方程式___ ,若反应中生成0.2molHNO3,转移的电子数目为____ 个。
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现,你判断该气体泄漏时的现象是_______ 。
(1)反应过程中,氧化剂是
(2)写出该反应的化学方程式
(3)NF3是一种无色、无臭的气体,但一旦NF3在空气中泄漏,还是易于发现,你判断该气体泄漏时的现象是
您最近一年使用:0次
名校
7 . 氧化还原反应在物质制取和转化中有重要的应用。请回答下列问题:
(1) (亚硝酸钙)可用作混凝土中钢筋的防护剂,实验室可用如下反应制备:
(亚硝酸钙)可用作混凝土中钢筋的防护剂,实验室可用如下反应制备:
①该反应中的氧化剂是_______ (填化学式,下同),还原剂是_______ 。
②该反应中被氧化的N原子与被还原的N原子的质量之比为_______ 。
③用单线桥标出该反应中电子的转移情况:_______ 。
(2)某反应体系有反应物和生成物共7种: 。已知该反应中
。已知该反应中 只发生如下过程:
只发生如下过程: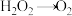 ,试回答下列问题:
,试回答下列问题:
①该反应中,发生还原反应的过程是_______ →_______ (填化学式)。
②写出该反应的化学方程式并配平:_______ 。
③若反应每消耗 ,生成
,生成_______  。
。
(1)
 (亚硝酸钙)可用作混凝土中钢筋的防护剂,实验室可用如下反应制备:
(亚硝酸钙)可用作混凝土中钢筋的防护剂,实验室可用如下反应制备:
①该反应中的氧化剂是
②该反应中被氧化的N原子与被还原的N原子的质量之比为
③用单线桥标出该反应中电子的转移情况:
(2)某反应体系有反应物和生成物共7种:
 。已知该反应中
。已知该反应中 只发生如下过程:
只发生如下过程: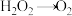 ,试回答下列问题:
,试回答下列问题:①该反应中,发生还原反应的过程是
②写出该反应的化学方程式并配平:
③若反应每消耗
 ,生成
,生成 。
。
您最近一年使用:0次
2022-11-19更新
|
130次组卷
|
2卷引用:山东省济南外国语学校2022-2023学年高一上学期12月月考化学试题
解题方法
8 . 钠是一种非常活泼、具有广泛应用的金属。
(1)金属钠通常保存在_______ 里,以隔绝空气。
(2)汽车安全气囊的气体发生剂 可由金属钠生产。某汽车安全气囊内含
可由金属钠生产。某汽车安全气囊内含 、
、 和
和 等物质。
等物质。
①当汽车发生较严重的碰撞时,引发 分解发生反应
分解发生反应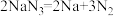 ,从而为气囊充气。产生的
,从而为气囊充气。产生的 立即与
立即与 发生置换反应生成
发生置换反应生成 ,化学方程式为
,化学方程式为_______ 。
② 是冷却剂,分解时可吸收产气过程释放的热量。该反应的化学方程式为
是冷却剂,分解时可吸收产气过程释放的热量。该反应的化学方程式为_______ 。
③一个安全气囊通常装有 ,其完全分解所释放的
,其完全分解所释放的 为
为_______  。
。
(3)工业上通过电解 生产金属钠:
生产金属钠: ,过程如下:
,过程如下:

已知:电解时需要将 加热至熔融状态。
加热至熔融状态。 的熔点为
的熔点为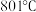 ,为降低能耗,通常加入
,为降低能耗,通常加入 把熔点降至约
把熔点降至约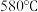 。
。
①把 固体加热至熔融状态,目的是
固体加热至熔融状态,目的是_______ 。
②粗钠中含有少量杂质 ,过程Ⅱ除去
,过程Ⅱ除去 的化学方程式为
的化学方程式为_______ 。(不必写反应条件)
(1)金属钠通常保存在
(2)汽车安全气囊的气体发生剂
 可由金属钠生产。某汽车安全气囊内含
可由金属钠生产。某汽车安全气囊内含 、
、 和
和 等物质。
等物质。①当汽车发生较严重的碰撞时,引发
 分解发生反应
分解发生反应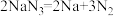 ,从而为气囊充气。产生的
,从而为气囊充气。产生的 立即与
立即与 发生置换反应生成
发生置换反应生成 ,化学方程式为
,化学方程式为②
 是冷却剂,分解时可吸收产气过程释放的热量。该反应的化学方程式为
是冷却剂,分解时可吸收产气过程释放的热量。该反应的化学方程式为③一个安全气囊通常装有
 ,其完全分解所释放的
,其完全分解所释放的 为
为 。
。(3)工业上通过电解
 生产金属钠:
生产金属钠: ,过程如下:
,过程如下:
已知:电解时需要将
 加热至熔融状态。
加热至熔融状态。 的熔点为
的熔点为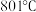 ,为降低能耗,通常加入
,为降低能耗,通常加入 把熔点降至约
把熔点降至约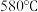 。
。①把
 固体加热至熔融状态,目的是
固体加热至熔融状态,目的是②粗钠中含有少量杂质
 ,过程Ⅱ除去
,过程Ⅱ除去 的化学方程式为
的化学方程式为
您最近一年使用:0次
9 . 二氧化氯(ClO2)是一种黄绿色有刺激性气味的气体,其熔点为-59℃,沸点为11.0℃,易溶于水。是目前国际上公认的新一代高效、广谱、安全的杀菌、保鲜剂,在水处理等方面有广泛应用的高效安全消毒剂。与Cl2相比ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)实验室用二氧化锰制备氯气的化学方程式为____ ,氯气和水反应的离子方程式为____ 。
(2)在ClO2的制备方法中,比较实用的有数十种,实验室常用氯酸钠(NaClO3)、亚硫酸钠(Na2SO3)和硫酸共热制备二氧化氯,此化学反应方程式为____ 。
(3)我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:
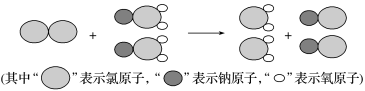
该反应的化学方程式为____ 。
(4)含氯消毒剂的消毒能力可以用氧化性来衡量。每克ClO2的氧化能力相当于____ 克Cl2的氧化能力。(计算结果保留两位小数)
(1)实验室用二氧化锰制备氯气的化学方程式为
(2)在ClO2的制备方法中,比较实用的有数十种,实验室常用氯酸钠(NaClO3)、亚硫酸钠(Na2SO3)和硫酸共热制备二氧化氯,此化学反应方程式为
(3)我国最近成功研制出制取ClO2的新方法,其反应的微观过程如图所示:

该反应的化学方程式为
(4)含氯消毒剂的消毒能力可以用氧化性来衡量。每克ClO2的氧化能力相当于
您最近一年使用:0次
10 . NaCN(氰化钠)是一种重要的基础化工原料,可用于电镀、冶金和有机合成等。回答下列问题。
(1)NaCN溶液中发生水解反应的离子方程式为____ ,实验室配制NaCN溶液的方法是____ 。
(2)NaCN与Cl2反应可制备ClCN(氯氰),氯氰的电子式为____ 。
(3)制备NaCN的方法很多种。
①氨钠法:反应原理为2Na+2C+2NH3 2NaCN+3H2。该反应中,每生成2molNaCN,转移电子的物质的量为
2NaCN+3H2。该反应中,每生成2molNaCN,转移电子的物质的量为____ 。
②NaCN也可由HCN与NaOH反应制得。
已知:CH4(g)=C(s)+2H2(g) ΔH1
2HCN(g)=2C(s)+H2(g)+N2(g) ΔH2
N2(g)+3H2(g) 2NH3(g) ΔH3
2NH3(g) ΔH3
则反应:CH4(g)+NH3(g)=HCN(g)+3H2(g)的ΔH=____ (用含ΔH1、ΔH2、ΔH3的代数式表示)。
(1)NaCN溶液中发生水解反应的离子方程式为
(2)NaCN与Cl2反应可制备ClCN(氯氰),氯氰的电子式为
(3)制备NaCN的方法很多种。
①氨钠法:反应原理为2Na+2C+2NH3
 2NaCN+3H2。该反应中,每生成2molNaCN,转移电子的物质的量为
2NaCN+3H2。该反应中,每生成2molNaCN,转移电子的物质的量为②NaCN也可由HCN与NaOH反应制得。
已知:CH4(g)=C(s)+2H2(g) ΔH1
2HCN(g)=2C(s)+H2(g)+N2(g) ΔH2
N2(g)+3H2(g)
 2NH3(g) ΔH3
2NH3(g) ΔH3则反应:CH4(g)+NH3(g)=HCN(g)+3H2(g)的ΔH=
您最近一年使用:0次



