名校
1 . 已知:① (绿色)(强碱性条件)
(绿色)(强碱性条件)
② (强酸性条件)
(强酸性条件)
(1)在KOH溶液中, 与
与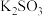 溶液发生反应,还原剂为
溶液发生反应,还原剂为___________ ,还原产物为___________ 。
(2)将 溶液滴入NaOH溶液微热,得到透明的绿色溶液,写出反应的离子方程式
溶液滴入NaOH溶液微热,得到透明的绿色溶液,写出反应的离子方程式___________ 。
(3)向20mL浓度为0.02mol/L的 溶液中滴加
溶液中滴加 溶液,使
溶液,使 全部转化为
全部转化为 ,则反应前需向
,则反应前需向 溶液加入
溶液加入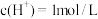 的酸不少于
的酸不少于___________ mL。
 (绿色)(强碱性条件)
(绿色)(强碱性条件)②
 (强酸性条件)
(强酸性条件)(1)在KOH溶液中,
 与
与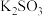 溶液发生反应,还原剂为
溶液发生反应,还原剂为(2)将
 溶液滴入NaOH溶液微热,得到透明的绿色溶液,写出反应的离子方程式
溶液滴入NaOH溶液微热,得到透明的绿色溶液,写出反应的离子方程式(3)向20mL浓度为0.02mol/L的
 溶液中滴加
溶液中滴加 溶液,使
溶液,使 全部转化为
全部转化为 ,则反应前需向
,则反应前需向 溶液加入
溶液加入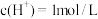 的酸不少于
的酸不少于
您最近半年使用:0次
2 . 次磷酸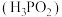 是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
(1)次磷酸中 的化合价为
的化合价为___________ ,画出 的原子结构示意图:
的原子结构示意图:___________ 。
(2)写出 与足量
与足量 溶液反应的化学方程式:
溶液反应的化学方程式:___________ 。
(3)工业上次磷酸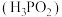 常用于化学镀银,发生的反应如下:
常用于化学镀银,发生的反应如下: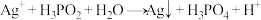 (方程式未配平)
(方程式未配平)
①该反应中___________ (填化学式)被还原。
②配平该反应方程式并标出电子转移的方向和数目:___________ 。
 。
。
③据该反应判断,还原性:___________ >___________ (填化学式)。
④若有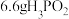 参加该反应,则反应中转移电子的物质的量为
参加该反应,则反应中转移电子的物质的量为___________  。
。
(4)若将氯气通入 溶液中,也发生
溶液中,也发生 的转化,写出该反应的化学方程式:
的转化,写出该反应的化学方程式:___________ 。
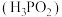 是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:(1)次磷酸中
 的化合价为
的化合价为 的原子结构示意图:
的原子结构示意图:(2)写出
 与足量
与足量 溶液反应的化学方程式:
溶液反应的化学方程式:(3)工业上次磷酸
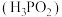 常用于化学镀银,发生的反应如下:
常用于化学镀银,发生的反应如下: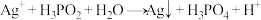 (方程式未配平)
(方程式未配平)①该反应中
②配平该反应方程式并标出电子转移的方向和数目:
 。
。③据该反应判断,还原性:
④若有
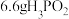 参加该反应,则反应中转移电子的物质的量为
参加该反应,则反应中转移电子的物质的量为 。
。(4)若将氯气通入
 溶液中,也发生
溶液中,也发生 的转化,写出该反应的化学方程式:
的转化,写出该反应的化学方程式:
您最近半年使用:0次
名校
3 . 铬及其化合物在催化、金属防腐等方面具有重要应用。催化剂Cr2O3可由(NH4)2Cr2O7加热分解制备,反应同时生成无污染气体。
(1)完成化学方程式:_____ 。
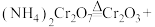 _____+_____。
_____+_____。
(2)Cr2O3催化丙烷脱氢过程中,部分反应历程如图, 过程的焓变为
过程的焓变为_____ (列式表示)。_____ (用“→”表示含氮物质间的转化);其中一个有颜色变化的反应的化学方程式为_____ 。
(1)完成化学方程式:
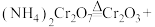 _____+_____。
_____+_____。(2)Cr2O3催化丙烷脱氢过程中,部分反应历程如图,
 过程的焓变为
过程的焓变为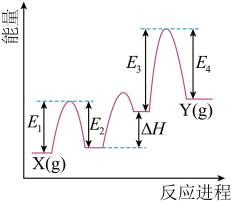
您最近半年使用:0次
名校
4 . 将CO2转化为CO是利用CO2的重要途径,由CO可以制备多种液体燃料。
(1)我国在CO2催化加氢制取汽油方面取得突破性进展,转化过程如下所示。___________ ,b中碳原子的杂化轨道类型为___________ 。
(2)Cu、Cu2O可应用于CO2转化CO的研究。以CuSO4·5H2O、Na2SO3、Na2CO3为原料能制备Cu2O。将生成Cu2O的反应补充完整___________ 。
___________Cu2+ + ___________CO +___________SO
+___________SO =___________Cu2O+___________↑+___________
=___________Cu2O+___________↑+___________
(3)在Cu催化剂作用下,反应CO2+H2 =CO+H2O的可能机理如下。
i.CO2+2Cu=CO+Cu2O;
ii.___________ (写出反应方程式)。
(1)我国在CO2催化加氢制取汽油方面取得突破性进展,转化过程如下所示。

(2)Cu、Cu2O可应用于CO2转化CO的研究。以CuSO4·5H2O、Na2SO3、Na2CO3为原料能制备Cu2O。将生成Cu2O的反应补充完整
___________Cu2+ + ___________CO
 +___________SO
+___________SO =___________Cu2O+___________↑+___________
=___________Cu2O+___________↑+___________(3)在Cu催化剂作用下,反应CO2+H2 =CO+H2O的可能机理如下。
i.CO2+2Cu=CO+Cu2O;
ii.
您最近半年使用:0次
名校
解题方法
5 . 根据要求完成下列方程式。
(1)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,其光解反应的化学方程式为:2K3[Fe(C2O4)3] 2FeC2O4 +3K2C2O4 +2CO2↑。
2FeC2O4 +3K2C2O4 +2CO2↑。
①草酸亚铁在隔绝空气的条件下加热会分解,可以制得黑色粉末状的氧化亚铁,写出该反应的化学方程式___________ 。
②氢氧化亚铁的制备过程中要注意隔绝空气,否则白色沉淀会迅速转化为灰绿色,最后得到红褐色物质,写出该转化过程的化学方程式___________ 。
③高铁酸钠是新型的净水剂,在强碱中氢氧化铁可以被氯气氧化生成紫色的高铁酸根,完成该反应的离子方程式___________ 。
(2)黄血盐(K4[Fe(CN)6] )是合法的食品添加剂,用作抗结剂;黄血盐在溶液中遇到Fe3+ ,生成普鲁士蓝沉淀。
①铊是一种剧毒化学品,若出现了中毒症状,应立即就医,在医学上,医生通常建议中毒者服用一种可溶性普鲁士蓝(KFe[Fe(CN)6])解毒,Tl+ 与K+ 性质接近,铊可置换普鲁士兰中的钾后,形成不溶性物质,随粪便排出,对治疗经口急慢性铊中毒有一定疗效,写出解铊毒反应的离子方程式___________ 。
②无水黄血盐可被浓硫酸分解,生成三种常见的盐和一种常见的无色无味气体,分析完成该反应的化学方程式___________ 。(提示:反应中价态不变)
(3)基于生成滕氏蓝的化学反应原理发展起来的晒制蓝图技术在复印机诞生之前广泛用于工程图纸的复制。赤血盐溶液遇到Fe2+ ,可以生成蓝色的滕氏蓝沉淀,写出得到滕氏蓝沉淀反应的离子方程式___________ 。(已知:氯气遇到黄血盐可以得到赤血盐)
(1)K3[Fe(C2O4)3]·3H2O(三草酸合铁酸钾)为亮绿色晶体,可用于晒制蓝图。晒制蓝图时,用K3[Fe(C2O4)3]·3H2O作感光剂,其光解反应的化学方程式为:2K3[Fe(C2O4)3]
 2FeC2O4 +3K2C2O4 +2CO2↑。
2FeC2O4 +3K2C2O4 +2CO2↑。①草酸亚铁在隔绝空气的条件下加热会分解,可以制得黑色粉末状的氧化亚铁,写出该反应的化学方程式
②氢氧化亚铁的制备过程中要注意隔绝空气,否则白色沉淀会迅速转化为灰绿色,最后得到红褐色物质,写出该转化过程的化学方程式
③高铁酸钠是新型的净水剂,在强碱中氢氧化铁可以被氯气氧化生成紫色的高铁酸根,完成该反应的离子方程式
(2)黄血盐(K4[Fe(CN)6] )是合法的食品添加剂,用作抗结剂;黄血盐在溶液中遇到Fe3+ ,生成普鲁士蓝沉淀。
①铊是一种剧毒化学品,若出现了中毒症状,应立即就医,在医学上,医生通常建议中毒者服用一种可溶性普鲁士蓝(KFe[Fe(CN)6])解毒,Tl+ 与K+ 性质接近,铊可置换普鲁士兰中的钾后,形成不溶性物质,随粪便排出,对治疗经口急慢性铊中毒有一定疗效,写出解铊毒反应的离子方程式
②无水黄血盐可被浓硫酸分解,生成三种常见的盐和一种常见的无色无味气体,分析完成该反应的化学方程式
(3)基于生成滕氏蓝的化学反应原理发展起来的晒制蓝图技术在复印机诞生之前广泛用于工程图纸的复制。赤血盐溶液遇到Fe2+ ,可以生成蓝色的滕氏蓝沉淀,写出得到滕氏蓝沉淀反应的离子方程式
您最近半年使用:0次
名校
解题方法
6 . 卤素互化物、拟卤素与卤素单质的结构,性质相似。常见的卤素互化物有ICl、IBr等,拟卤素有(CN)2、(SCN)2等。
(1)卤族元素位于元素周期表的_______ 。
(2)79Br和81Br这两种核素的中子数之差的绝对值为_______ 。
(3)①Cl2;②ICl;③IBr三种物质熔点由高到低的顺序为_______ 。
(4)①已知CN-与N2结构相似,CN-的电子式为______ 。
②推算HCN分子中σ键与π键数目之比为_______ 。
③关于氨基氰(N≡C-NH2)分子的说法中正确的是_______ 。
A.C原子采用sp3杂化
B.N原子的杂化形式有sp与sp3杂化
C.C≡N键的键长大于C-N键
D.所有原子满足8电子稳定结构
开采的金矿可用氰化法提取,步骤如下:
i.将金矿砂溶于pH为10.5~11的KCN溶液,并鼓入空气,过滤除去矿渣,得含K[Au(CN)2]的滤液;
ii.向滤液中加入足量金属锌,得单质金。Zn+2K[Au(CN)2]=2Au+K2[Zn(CN)4]
(5)K[Au(CN)2]中Au+的配体为______ 。
(6)K2[Zn(CN)4]中Au+的配位数为______ 。
(7)i中反应的离子方程式为:_______ 。
 Au+
Au+ CN-+
CN-+ _______+
_______+ _______=
_______= [Au(CN)2]-+
[Au(CN)2]-+ _______
_______
(8)已知Ka(HCN)=4.0×10-10。i中,pH<10.5会导致相同时间内Au的浸取率下降,原因_______ 。
(1)卤族元素位于元素周期表的
| A.s区 | B.p区 | C.d区 | D.f区 |
(3)①Cl2;②ICl;③IBr三种物质熔点由高到低的顺序为
| A.①>②>③ | B.③>②>① | C.②>①>③ | D.③>①>② |
②推算HCN分子中σ键与π键数目之比为
③关于氨基氰(N≡C-NH2)分子的说法中正确的是
A.C原子采用sp3杂化
B.N原子的杂化形式有sp与sp3杂化
C.C≡N键的键长大于C-N键
D.所有原子满足8电子稳定结构
开采的金矿可用氰化法提取,步骤如下:
i.将金矿砂溶于pH为10.5~11的KCN溶液,并鼓入空气,过滤除去矿渣,得含K[Au(CN)2]的滤液;
ii.向滤液中加入足量金属锌,得单质金。Zn+2K[Au(CN)2]=2Au+K2[Zn(CN)4]
(5)K[Au(CN)2]中Au+的配体为
(6)K2[Zn(CN)4]中Au+的配位数为
(7)i中反应的离子方程式为:
 Au+
Au+ CN-+
CN-+ _______+
_______+ _______=
_______= [Au(CN)2]-+
[Au(CN)2]-+ _______
_______(8)已知Ka(HCN)=4.0×10-10。i中,pH<10.5会导致相同时间内Au的浸取率下降,原因
您最近半年使用:0次
名校
7 . 亚硫酸盐是一类很早即在世界范围内广泛使用的食品添加剂,可作为食品漂白剂,防腐剂;可抑制非酶褐变和酶促褐变,防止食品褐变,使水果不至黑变,还能防止鲜虾生成黑斑;在酸性介质中,还是十分有效的抗菌剂。
(1)亚硫酸钠中,阴离子的空间结构为___________ 。
(2)常温下, 溶液呈碱性,原因是
溶液呈碱性,原因是___________ (用离子方程式表示)。
(3)常温下,已知 溶液中含硫粒子的浓度之和为
溶液中含硫粒子的浓度之和为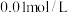 ,向
,向 溶液中加入
溶液中加入 ,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
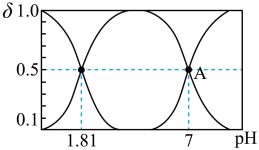
①A点溶液中离子浓度大小关系为___________ 。
②常温下, 溶液呈
溶液呈___________ 性。
(4)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性 溶液为例)进行处理,原理是
溶液为例)进行处理,原理是___________ (用离子方程式表示)。常温处理后,再调节 使
使 浓度不高于
浓度不高于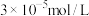 即可排放,调节
即可排放,调节 应不低于
应不低于___________ 。[已知Ksp[Cr(OH)3]=3×10-32]
(1)亚硫酸钠中,阴离子的空间结构为
(2)常温下,
 溶液呈碱性,原因是
溶液呈碱性,原因是(3)常温下,已知
 溶液中含硫粒子的浓度之和为
溶液中含硫粒子的浓度之和为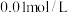 ,向
,向 溶液中加入
溶液中加入 ,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
,溶液中含硫粒子的物质的量分数与溶液的关系如图所示。
①A点溶液中离子浓度大小关系为
②常温下,
 溶液呈
溶液呈(4)工业废水中的亚硫酸盐过量排放和不恰当的处理方法会引发严重的环境问题,如水体富营养化、水生生物死亡等。工厂废水排放前,可以先用氧化性工业废水(以含酸性
 溶液为例)进行处理,原理是
溶液为例)进行处理,原理是 使
使 浓度不高于
浓度不高于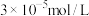 即可排放,调节
即可排放,调节 应不低于
应不低于
您最近半年使用:0次
名校
8 . Ⅰ.有钠、氢、氧、硫四种元素,用其中的一种或几种元素可以组成多种物质,写出符合下列要求的化学式(各写一个):
(1)酸式盐___________ ;
(2)非电解质___________ ;
(3)强电解质___________ ;
(4)弱电解质___________ 。
Ⅱ.完成下列问题
(5)配平下列反应________ ;
___________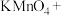 ___________
___________ (浓)
(浓) ___________
___________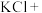 ___________
___________ ___________
___________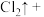 ___________
___________ 。
。
(6)该反应中还原产物为___________ ,若有 参加反应,则参加反应的
参加反应,则参加反应的 为
为___________  ,其中被氧化的
,其中被氧化的 为
为___________  ,转移电子的物质的量为
,转移电子的物质的量为___________  。
。
(1)酸式盐
(2)非电解质
(3)强电解质
(4)弱电解质
Ⅱ.完成下列问题
(5)配平下列反应
___________
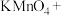 ___________
___________ (浓)
(浓) ___________
___________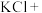 ___________
___________ ___________
___________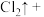 ___________
___________ 。
。(6)该反应中还原产物为
 参加反应,则参加反应的
参加反应,则参加反应的 为
为 ,其中被氧化的
,其中被氧化的 为
为 ,转移电子的物质的量为
,转移电子的物质的量为 。
。
您最近半年使用:0次
解题方法
9 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:
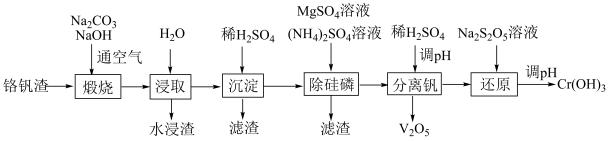
已知:最高价铬酸根在酸性介质中以Cr2O 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。回答下列问题:
存在。回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________ (填化学式)。
(2)水浸渣中主要有SiO2和___________ 。
(3)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO 或VO3+;在碱性条件下,溶解为VO
或VO3+;在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有___________ (填标号)。
A.酸性 B.碱性 C.两性
(4)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为___________ 。

已知:最高价铬酸根在酸性介质中以Cr2O
 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。回答下列问题:
存在。回答下列问题:(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(2)水浸渣中主要有SiO2和
(3)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO
 或VO3+;在碱性条件下,溶解为VO
或VO3+;在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有A.酸性 B.碱性 C.两性
(4)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为
您最近半年使用:0次
10 . 回答下列问题:
(1)已知H2A在水中发生电离:H2A=H++HA-,HA-⇌H++A2-。
①向H2A稀溶液中加入少量NaHA固体,溶液的pH_______ (填“增大”“减小”或“不变”)。
②常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)⇌Ca2+(aq)+A2-(aq)。加入少量Na2A固体,c(Ca2+)_______ (填“增大”“减小”或“不变”),原因是_______ 。
(2)含有Cr2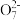 的废水毒性较大。经化学分析,某工厂废水中Cr2
的废水毒性较大。经化学分析,某工厂废水中Cr2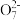 的浓度为4.00×10-3mol·L-1。为使废水能达标排放,作如下处理:Cr2
的浓度为4.00×10-3mol·L-1。为使废水能达标排放,作如下处理:Cr2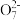
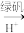 Cr3+、Fe3+
Cr3+、Fe3+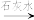 Cr(OH)3、Fe(OH)3。
Cr(OH)3、Fe(OH)3。
①在废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为_______ 。
②已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Cr(OH)3]=7.0×10-31。若处理后的废水中残留的c(Fe3+)=2.0×10-14mol·L-1,则残留的Cr3+的浓度为_______ 。
(1)已知H2A在水中发生电离:H2A=H++HA-,HA-⇌H++A2-。
①向H2A稀溶液中加入少量NaHA固体,溶液的pH
②常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)⇌Ca2+(aq)+A2-(aq)。加入少量Na2A固体,c(Ca2+)
(2)含有Cr2
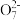 的废水毒性较大。经化学分析,某工厂废水中Cr2
的废水毒性较大。经化学分析,某工厂废水中Cr2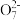 的浓度为4.00×10-3mol·L-1。为使废水能达标排放,作如下处理:Cr2
的浓度为4.00×10-3mol·L-1。为使废水能达标排放,作如下处理:Cr2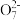
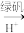 Cr3+、Fe3+
Cr3+、Fe3+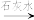 Cr(OH)3、Fe(OH)3。
Cr(OH)3、Fe(OH)3。①在废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为
②已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Cr(OH)3]=7.0×10-31。若处理后的废水中残留的c(Fe3+)=2.0×10-14mol·L-1,则残留的Cr3+的浓度为
您最近半年使用:0次



