1 . 次磷酸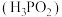 是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
(1)次磷酸中 的化合价为
的化合价为___________ ,画出 的原子结构示意图:
的原子结构示意图:___________ 。
(2)写出 与足量
与足量 溶液反应的化学方程式:
溶液反应的化学方程式:___________ 。
(3)工业上次磷酸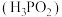 常用于化学镀银,发生的反应如下:
常用于化学镀银,发生的反应如下: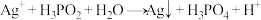 (方程式未配平)
(方程式未配平)
①该反应中___________ (填化学式)被还原。
②配平该反应方程式并标出电子转移的方向和数目:___________ 。
 。
。
③据该反应判断,还原性:___________ >___________ (填化学式)。
④若有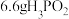 参加该反应,则反应中转移电子的物质的量为
参加该反应,则反应中转移电子的物质的量为___________  。
。
(4)若将氯气通入 溶液中,也发生
溶液中,也发生 的转化,写出该反应的化学方程式:
的转化,写出该反应的化学方程式:___________ 。
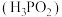 是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:
是一种精细磷化工产品,属于一元弱酸,具有较强的还原性。回答下列问题:(1)次磷酸中
 的化合价为
的化合价为 的原子结构示意图:
的原子结构示意图:(2)写出
 与足量
与足量 溶液反应的化学方程式:
溶液反应的化学方程式:(3)工业上次磷酸
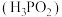 常用于化学镀银,发生的反应如下:
常用于化学镀银,发生的反应如下: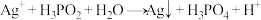 (方程式未配平)
(方程式未配平)①该反应中
②配平该反应方程式并标出电子转移的方向和数目:
 。
。③据该反应判断,还原性:
④若有
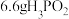 参加该反应,则反应中转移电子的物质的量为
参加该反应,则反应中转移电子的物质的量为 。
。(4)若将氯气通入
 溶液中,也发生
溶液中,也发生 的转化,写出该反应的化学方程式:
的转化,写出该反应的化学方程式:
您最近一年使用:0次
解题方法
2 . 铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物,从铬钒渣中分离提取铬和钒的一种流程如下图所示:
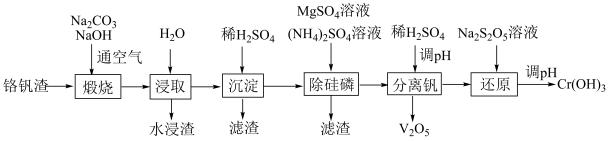
已知:最高价铬酸根在酸性介质中以Cr2O 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。回答下列问题:
存在。回答下列问题:
(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为___________ (填化学式)。
(2)水浸渣中主要有SiO2和___________ 。
(3)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO 或VO3+;在碱性条件下,溶解为VO
或VO3+;在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有___________ (填标号)。
A.酸性 B.碱性 C.两性
(4)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为___________ 。

已知:最高价铬酸根在酸性介质中以Cr2O
 存在,在碱性介质中以CrO
存在,在碱性介质中以CrO 存在。回答下列问题:
存在。回答下列问题:(1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为
(2)水浸渣中主要有SiO2和
(3)“分离钒”步骤中,将溶液pH调到1.8左右得到V2O5沉淀,V2O5在pH<1时,溶解为VO
 或VO3+;在碱性条件下,溶解为VO
或VO3+;在碱性条件下,溶解为VO 或VO
或VO ,上述性质说明V2O5具有
,上述性质说明V2O5具有A.酸性 B.碱性 C.两性
(4)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为
您最近一年使用:0次
3 . 回答下列问题:
(1)已知H2A在水中发生电离:H2A=H++HA-,HA-⇌H++A2-。
①向H2A稀溶液中加入少量NaHA固体,溶液的pH_______ (填“增大”“减小”或“不变”)。
②常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)⇌Ca2+(aq)+A2-(aq)。加入少量Na2A固体,c(Ca2+)_______ (填“增大”“减小”或“不变”),原因是_______ 。
(2)含有Cr2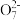 的废水毒性较大。经化学分析,某工厂废水中Cr2
的废水毒性较大。经化学分析,某工厂废水中Cr2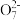 的浓度为4.00×10-3mol·L-1。为使废水能达标排放,作如下处理:Cr2
的浓度为4.00×10-3mol·L-1。为使废水能达标排放,作如下处理:Cr2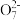
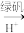 Cr3+、Fe3+
Cr3+、Fe3+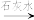 Cr(OH)3、Fe(OH)3。
Cr(OH)3、Fe(OH)3。
①在废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为_______ 。
②已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Cr(OH)3]=7.0×10-31。若处理后的废水中残留的c(Fe3+)=2.0×10-14mol·L-1,则残留的Cr3+的浓度为_______ 。
(1)已知H2A在水中发生电离:H2A=H++HA-,HA-⇌H++A2-。
①向H2A稀溶液中加入少量NaHA固体,溶液的pH
②常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)⇌Ca2+(aq)+A2-(aq)。加入少量Na2A固体,c(Ca2+)
(2)含有Cr2
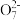 的废水毒性较大。经化学分析,某工厂废水中Cr2
的废水毒性较大。经化学分析,某工厂废水中Cr2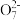 的浓度为4.00×10-3mol·L-1。为使废水能达标排放,作如下处理:Cr2
的浓度为4.00×10-3mol·L-1。为使废水能达标排放,作如下处理:Cr2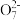
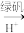 Cr3+、Fe3+
Cr3+、Fe3+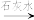 Cr(OH)3、Fe(OH)3。
Cr(OH)3、Fe(OH)3。①在废水中加入FeSO4·7H2O和稀硫酸,发生反应的离子方程式为
②已知:Ksp[Fe(OH)3]=2.8×10-39,Ksp[Cr(OH)3]=7.0×10-31。若处理后的废水中残留的c(Fe3+)=2.0×10-14mol·L-1,则残留的Cr3+的浓度为
您最近一年使用:0次
解题方法
4 . 无论是在环境保护领域还是在工农业生产领域,氮及其化合物一直是我国科研重点。回答下列问题:
(1)下列过程属于氮的固定过程的是______ (填选项字母)。
(2)消除汽车尾气中的氮氧化合物的原理之一为2NO(g)+2CO(g)⇌N2(g)+2CO2(g)。一定温度下,向体积为5L的刚性密闭容器中充入0.5molNO和0.5molCO,发生上述反应,测得部分气体的物质的量随时间变化关系如图所示:_______ (填“N2”或“CO2”)物质的量的变化曲线。
②该温度下,反应开始至5min时该反应的平均反应速率v(NO)=_______ 。
③3min时,反应_______ (填“达到”或“未达到”)化学平衡,6min时,正反应速率______ (填“>”“<”或“=”)逆反应速率。
④下列情况能说明该反应达到平衡状态的是______ (填选项字母)。
A.化学反应速率 正(NO)=
正(NO)= 逆(N2)
逆(N2)
B.CO与CO2的物质的量之和不再发生变化
C.容器内气体压强不再发生变化
D.容器内混合气体密度不再发生变化
(3)实验室用NaOH溶液对氮氧化合物进行尾气吸收,例如NaOH溶液可将NO2转化为NaNO3和NaNO2。该吸收过程中发生反应的离子方程式为______ 。
(1)下列过程属于氮的固定过程的是
| A.工业合成氨 |
| B.工业利用氨气合成硝酸 |
| C.雷雨天中氮气与氧气生成氮氧化合物 |
| D.通过碱性试剂将气态的氮氧化合物转化为固态含氮化合物 |

②该温度下,反应开始至5min时该反应的平均反应速率v(NO)=
③3min时,反应
④下列情况能说明该反应达到平衡状态的是
A.化学反应速率
 正(NO)=
正(NO)= 逆(N2)
逆(N2)B.CO与CO2的物质的量之和不再发生变化
C.容器内气体压强不再发生变化
D.容器内混合气体密度不再发生变化
(3)实验室用NaOH溶液对氮氧化合物进行尾气吸收,例如NaOH溶液可将NO2转化为NaNO3和NaNO2。该吸收过程中发生反应的离子方程式为
您最近一年使用:0次
名校
5 . 氯化铬( )是一种化工原料,可用于催化剂、颜料、印染、陶瓷、电镀等行业。实验室利用铬酸钡(
)是一种化工原料,可用于催化剂、颜料、印染、陶瓷、电镀等行业。实验室利用铬酸钡(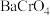 )可制备少量氯化铬:
)可制备少量氯化铬:

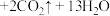 。回答下列问题:
。回答下列问题:
(1)上述反应中,还原剂是_________ ,还原产物与氧化产物的物质的量之比是________ 。
(2)该制备操作方法中,需加稍过量的乙醇,目的是________ 。
(3)制备的氯化铬粗样品利用下列滴定方法测定其纯度(杂质不参加反应):

已知:I.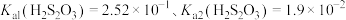 。
。
Ⅱ.上述过程发生反应: 、
、 。
。
① 标准液应盛放在
标准液应盛放在_______ 中进行滴定。
②滴定终点时,溶液由蓝色变为无色,则滴定时加入的指示剂名称是_______ 。
③滴定时,平行测定3次,平均消耗 标准液的体积为
标准液的体积为 ,则该氯化铬粗样品中
,则该氯化铬粗样品中 的纯度是
的纯度是______ (保留四位有效数字)。
 )是一种化工原料,可用于催化剂、颜料、印染、陶瓷、电镀等行业。实验室利用铬酸钡(
)是一种化工原料,可用于催化剂、颜料、印染、陶瓷、电镀等行业。实验室利用铬酸钡(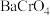 )可制备少量氯化铬:
)可制备少量氯化铬:

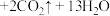 。回答下列问题:
。回答下列问题:(1)上述反应中,还原剂是
(2)该制备操作方法中,需加稍过量的乙醇,目的是
(3)制备的氯化铬粗样品利用下列滴定方法测定其纯度(杂质不参加反应):

已知:I.
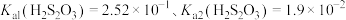 。
。Ⅱ.上述过程发生反应:
 、
、 。
。①
 标准液应盛放在
标准液应盛放在②滴定终点时,溶液由蓝色变为无色,则滴定时加入的指示剂名称是
③滴定时,平行测定3次,平均消耗
 标准液的体积为
标准液的体积为 ,则该氯化铬粗样品中
,则该氯化铬粗样品中 的纯度是
的纯度是
您最近一年使用:0次
名校
6 . 根据所学知识,回答下列问题:
(1)自来水厂用氯气杀菌、消毒,其消毒原理主要是氯气溶于水后生成了 。氯水中存在的离子有
。氯水中存在的离子有___________ ; 的结构式为
的结构式为___________ ; 在溶液中电离本质是
在溶液中电离本质是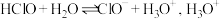 的电子式是
的电子式是___________ 。
(2)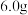 氮的氧化物
氮的氧化物 中,含
中,含 物质的量为
物质的量为 ,则
,则 的摩尔质量为
的摩尔质量为___________ 。
(3)已知反应: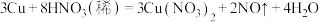 。若有
。若有 被氧化,则被还原的
被氧化,则被还原的 的物质的量是
的物质的量是___________  。
。
(4) 是一种黄绿色气体,被称为“第四代”饮用水消毒剂。制备
是一种黄绿色气体,被称为“第四代”饮用水消毒剂。制备 的一种方法为在平底烧瓶中加入
的一种方法为在平底烧瓶中加入 固体、足量草酸
固体、足量草酸 、稀硫酸,
、稀硫酸, 水浴加热。已知草酸被氧化为
水浴加热。已知草酸被氧化为 ,该反应的化学方程式为
,该反应的化学方程式为___________ 。
(5)消毒效率是指消毒剂的有效氯。有效氯 有效系数
有效系数 含氯量,其中有效系数
含氯量,其中有效系数 夺取电子数,含氯量
夺取电子数,含氯量 的消毒效率为
的消毒效率为___________ 。
(1)自来水厂用氯气杀菌、消毒,其消毒原理主要是氯气溶于水后生成了
 。氯水中存在的离子有
。氯水中存在的离子有 的结构式为
的结构式为 在溶液中电离本质是
在溶液中电离本质是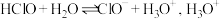 的电子式是
的电子式是(2)
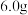 氮的氧化物
氮的氧化物 中,含
中,含 物质的量为
物质的量为 ,则
,则 的摩尔质量为
的摩尔质量为(3)已知反应:
 。若有
。若有 被氧化,则被还原的
被氧化,则被还原的 的物质的量是
的物质的量是 。
。(4)
 是一种黄绿色气体,被称为“第四代”饮用水消毒剂。制备
是一种黄绿色气体,被称为“第四代”饮用水消毒剂。制备 的一种方法为在平底烧瓶中加入
的一种方法为在平底烧瓶中加入 固体、足量草酸
固体、足量草酸 、稀硫酸,
、稀硫酸, 水浴加热。已知草酸被氧化为
水浴加热。已知草酸被氧化为 ,该反应的化学方程式为
,该反应的化学方程式为(5)消毒效率是指消毒剂的有效氯。有效氯
 有效系数
有效系数 含氯量,其中有效系数
含氯量,其中有效系数 夺取电子数,含氯量
夺取电子数,含氯量 的消毒效率为
的消毒效率为
您最近一年使用:0次
7 . 黄铁矿(主要成分为FeS2)的利用对资源和环境具有重要意义,一种酸性条件下催化氧化黄铁矿的物质转化关系如图所示,回答下列问题:
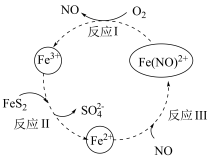
(1)基态氮原子的价层电子排布式为____________ 。
(2)基态氧原子的核外电子有________ 种空间运动状态,其电子占据的最高能级的电子云轮廓图为____ 形。
(3)第一电离能:N________ (填“>”“<”或“=”)O。
(4)反应Ⅱ的离子方程式为____________________ ,Fe3+的半径比Fe2+________ (填“大”或“小”),Fe3+的稳定性比Fe2+更________ (填“强”或“弱”)。

(1)基态氮原子的价层电子排布式为
(2)基态氧原子的核外电子有
(3)第一电离能:N
(4)反应Ⅱ的离子方程式为
您最近一年使用:0次
名校
8 . I.人类活动中的碳排放无可避免。
(1)配平下列反应,并标出电子转移的方向和数目。___________
___________CH4+___________NO2 ___________NO+___________CO2+___________H2O
___________NO+___________CO2+___________H2O
(2)有一种处理废水中的HCOOH的微型原电池。电池含有Fe-C,使用时通入空气,便可以在___________ 生成H2O2。
A.阴极 B.负极 C.阳极 D.正极
写出H2O2与HCOOH反应生成CO2的化学方程式:___________ 。
Ⅱ.一种富集CO2的原电池模拟装置如下图。
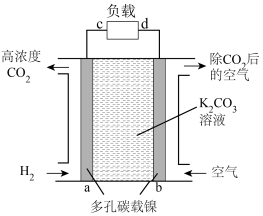
(3)b极为___________ 极(填“正”或“负”),a电极上发生的电极反应为___________ 。
(4)上述电极材料采用多孔碳载镍,“多孔”的优点是___________ 。
(5)该装置若消耗2 mol H2,则理论上在b极除去CO2的体积约为___________ L(标准状况下)。
(1)配平下列反应,并标出电子转移的方向和数目。
___________CH4+___________NO2
 ___________NO+___________CO2+___________H2O
___________NO+___________CO2+___________H2O(2)有一种处理废水中的HCOOH的微型原电池。电池含有Fe-C,使用时通入空气,便可以在
A.阴极 B.负极 C.阳极 D.正极
写出H2O2与HCOOH反应生成CO2的化学方程式:
Ⅱ.一种富集CO2的原电池模拟装置如下图。

(3)b极为
(4)上述电极材料采用多孔碳载镍,“多孔”的优点是
(5)该装置若消耗2 mol H2,则理论上在b极除去CO2的体积约为
您最近一年使用:0次
名校
9 . 氨气是重要的化工原料,氨水、硝酸盐、铵盐等均可作化肥产品。
(1)在VL浓度为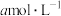 的氨水中滴加等体积
的氨水中滴加等体积 的盐酸,使pH=7,则产物中一水合氨浓度为
的盐酸,使pH=7,则产物中一水合氨浓度为___________  。
。
(2)在自然界的氮循环过程中,硝化细菌将土壤中的 转化为
转化为 后,土壤中的O2进一步将
后,土壤中的O2进一步将 氧化为
氧化为 ,在氧气较少的环境下,
,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以N2形式放出。氧气与
反应,使氮以N2形式放出。氧气与 反应时,反应物
反应时,反应物 与O2的物质的量之比为
与O2的物质的量之比为___________ ,写出 与
与 作用生成N2的离子方程式
作用生成N2的离子方程式___________ 。
(1)在VL浓度为
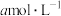 的氨水中滴加等体积
的氨水中滴加等体积 的盐酸,使pH=7,则产物中一水合氨浓度为
的盐酸,使pH=7,则产物中一水合氨浓度为 。
。(2)在自然界的氮循环过程中,硝化细菌将土壤中的
 转化为
转化为 后,土壤中的O2进一步将
后,土壤中的O2进一步将 氧化为
氧化为 ,在氧气较少的环境下,
,在氧气较少的环境下, 又可以在反硝化细菌的作用下与
又可以在反硝化细菌的作用下与 反应,使氮以N2形式放出。氧气与
反应,使氮以N2形式放出。氧气与 反应时,反应物
反应时,反应物 与O2的物质的量之比为
与O2的物质的量之比为 与
与 作用生成N2的离子方程式
作用生成N2的离子方程式
您最近一年使用:0次
10 . 磷及其化合物在生产、生活中具有广泛的用途,回答下列问题:
(1)白磷(结构如图所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。

①白磷( )的相对分子质量为
)的相对分子质量为___________ 。
②基态P原子中成对电子数与未成对电子数之比为___________ 。
③基态P原子中能量最高的电子所占据原子轨道的电子云轮廓图为___________ 形。
(2)磷及其部分重要化合物的相互转化如图所示。

①基态钙原子的简化电子排布式为___________ 。
②第一电离能:Si___________ (填“>”“<”或“=”)C。
③ 和
和 的组成元素相同,但二者的性质不完全相同,其原因为
的组成元素相同,但二者的性质不完全相同,其原因为___________ 。
④常温下, 与少量
与少量 溶液反应的化学方程式为
溶液反应的化学方程式为___________ 。
(3)反应Ⅲ的离子方程式为___________ (已知: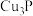 不溶于水)。
不溶于水)。
(1)白磷(结构如图所示)在潮湿的空气中发生缓慢氧化,在40℃左右即可自燃。

①白磷(
 )的相对分子质量为
)的相对分子质量为②基态P原子中成对电子数与未成对电子数之比为
③基态P原子中能量最高的电子所占据原子轨道的电子云轮廓图为
(2)磷及其部分重要化合物的相互转化如图所示。

①基态钙原子的简化电子排布式为
②第一电离能:Si
③
 和
和 的组成元素相同,但二者的性质不完全相同,其原因为
的组成元素相同,但二者的性质不完全相同,其原因为④常温下,
 与少量
与少量 溶液反应的化学方程式为
溶液反应的化学方程式为(3)反应Ⅲ的离子方程式为
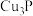 不溶于水)。
不溶于水)。
您最近一年使用:0次



