名校
1 . 电催化还原 是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。
是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。
(1)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原 的装置示意图如图-1所示。控制其他条件相同,将一定量的
的装置示意图如图-1所示。控制其他条件相同,将一定量的 通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
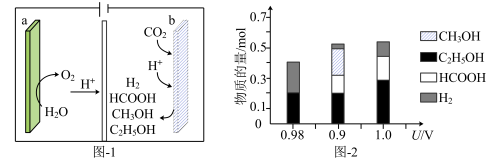
①电解前需向电解质溶液中持续通入过量 的原因是
的原因是___________ 。
②控制电压为0.8V,电解时转移电子的物质的量为___________ mol。
③科研小组利用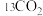 代替原有的
代替原有的 进行研究,其目的是
进行研究,其目的是___________ 。
(2)一种铜基复合电极材料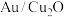 的制备方法:将一定量
的制备方法:将一定量 分散至水与乙醇的混合溶液中,向溶液中逐滴滴加
分散至水与乙醇的混合溶液中,向溶液中逐滴滴加 (一种强酸)溶液,搅拌一段时间后离心分离,得
(一种强酸)溶液,搅拌一段时间后离心分离,得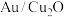 ,溶液呈蓝色。写出
,溶液呈蓝色。写出 还原
还原 的离子方程式:
的离子方程式:___________ 。
(3)金属Cu/La复合电极材料电催化还原CO₂制备甲醛和乙醇的可能机理如图-3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图-4所示。
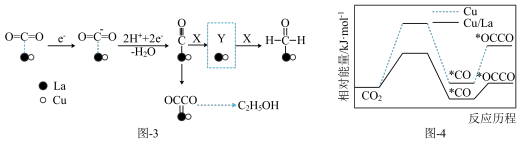
①X为___________ 。在答题卡上相应位置补充完整虚线框内Y的结构。_________
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原 的优点是
的优点是___________ 。
 是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。
是当今资源化利用二氧化碳的重点课题,常用的阴极材料有有机多孔电极材料、铜基复合电极材料等。(1)一种有机多孔电极材料(铜粉沉积在一种有机物的骨架上)电催化还原
 的装置示意图如图-1所示。控制其他条件相同,将一定量的
的装置示意图如图-1所示。控制其他条件相同,将一定量的 通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
通入该电催化装置中,阴极所得产物及其物质的量与电压的关系如图-2所示。
①电解前需向电解质溶液中持续通入过量
 的原因是
的原因是②控制电压为0.8V,电解时转移电子的物质的量为
③科研小组利用
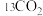 代替原有的
代替原有的 进行研究,其目的是
进行研究,其目的是(2)一种铜基复合电极材料
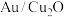 的制备方法:将一定量
的制备方法:将一定量 分散至水与乙醇的混合溶液中,向溶液中逐滴滴加
分散至水与乙醇的混合溶液中,向溶液中逐滴滴加 (一种强酸)溶液,搅拌一段时间后离心分离,得
(一种强酸)溶液,搅拌一段时间后离心分离,得 ,溶液呈蓝色。写出
,溶液呈蓝色。写出 还原
还原 的离子方程式:
的离子方程式:(3)金属Cu/La复合电极材料电催化还原CO₂制备甲醛和乙醇的可能机理如图-3所示。研究表明,在不同电极材料上形成中间体的部分反应活化能如图-4所示。

①X为
②与单纯的Cu电极相比,利用Cu/La复合电极材料电催化还原
 的优点是
的优点是
您最近一年使用:0次
2023-05-27更新
|
738次组卷
|
6卷引用:四川省宜宾市叙州区第一中学校2023-2024学年高二上学期1月期末化学试题
四川省宜宾市叙州区第一中学校2023-2024学年高二上学期1月期末化学试题江苏省南通市2023届高三下学期第四次模拟考试化学试题江苏省盐城市伍佑中学2023届高三下学期模拟预测化学试题(已下线)考点19 电解池(核心考点精讲精练)-备战2024年高考化学一轮复习考点帮(全国通用)(已下线)第25讲电解池与金属的电化学腐蚀江苏省南京师范大学苏州实验学校2023-2024学年高三上学期零模考试热身练化学试题
名校
2 . 工业废水中的重金属离子会导致环境污染危害人体健康,可用多种方法去除。
I.臭氧法
络合态的金属离子难以直接去除。O3与水反应产生的·OH(羟基自由基)可以氧化分解金属配合物[mRa+ ·nX]中的有机配体,使金属离子游离到水中,反应原理为:
·OH+[mRa+·nX] →mRa++CO2+H2O (Ra+表示金属离子,X表示配体)
·OH同时也能与溶液中的 、
、 反应。在某废水中加入Ca(OH)2,再通入O3可处理其中的络合态镍(II)。
反应。在某废水中加入Ca(OH)2,再通入O3可处理其中的络合态镍(II)。
(1)基态Ni2+的核外电子排布式为_______ 。
(2)加入的Ca(OH)2的作用是_______ 。
Ⅱ.纳米零价铝法
纳米铝粉有很强的吸附性和还原性,水中溶解的氧在纳米铝粉表面产生·OH(羟基自由基),可将甘氨酸铬中的有机基团降解,释放出的铬(VI)被纳米铝粉去除。
(3)向AlCl3溶液中滴加碱性NaBH4溶液,溶液中BH (B元素的化合价为+3)与Al3+反应可生成纳米铝粉、H2和B(OH)
(B元素的化合价为+3)与Al3+反应可生成纳米铝粉、H2和B(OH) ,其离子方程式为
,其离子方程式为 _______ 。
(4)向含有甘氨酸铬的废水中加入纳米铝粉,研究溶液中总氮含量[ ]随时间的变化可知甘氨酸铬在降解过程中的变化状态。实验测得溶液中总氮含量随时间的变化如图所示,反应初期溶液中的总氮含量先迅速降低后随即上升的原因是
]随时间的变化可知甘氨酸铬在降解过程中的变化状态。实验测得溶液中总氮含量随时间的变化如图所示,反应初期溶液中的总氮含量先迅速降低后随即上升的原因是 _______ 。

Ⅲ.金属炭法
其他条件相同,分别取铝炭混合物和铁炭混合物,与含Zn2+的废水反应相同时间,Zn2+去除率与废水pH的关系如图所示。

(5)废水pH为3时,铝炭混合物对Zn2+去除率远大于铁炭混合物的主要原因是_______ 。
(6)废水pH大于6,随着pH增大,铝炭混合物对Zn2+去除率增大的原因是_______ 。
I.臭氧法
络合态的金属离子难以直接去除。O3与水反应产生的·OH(羟基自由基)可以氧化分解金属配合物[mRa+ ·nX]中的有机配体,使金属离子游离到水中,反应原理为:
·OH+[mRa+·nX] →mRa++CO2+H2O (Ra+表示金属离子,X表示配体)
·OH同时也能与溶液中的
 、
、 反应。在某废水中加入Ca(OH)2,再通入O3可处理其中的络合态镍(II)。
反应。在某废水中加入Ca(OH)2,再通入O3可处理其中的络合态镍(II)。(1)基态Ni2+的核外电子排布式为
(2)加入的Ca(OH)2的作用是
Ⅱ.纳米零价铝法
纳米铝粉有很强的吸附性和还原性,水中溶解的氧在纳米铝粉表面产生·OH(羟基自由基),可将甘氨酸铬中的有机基团降解,释放出的铬(VI)被纳米铝粉去除。
(3)向AlCl3溶液中滴加碱性NaBH4溶液,溶液中BH
 (B元素的化合价为+3)与Al3+反应可生成纳米铝粉、H2和B(OH)
(B元素的化合价为+3)与Al3+反应可生成纳米铝粉、H2和B(OH) ,其离子方程式为
,其离子方程式为 (4)向含有甘氨酸铬的废水中加入纳米铝粉,研究溶液中总氮含量[
 ]随时间的变化可知甘氨酸铬在降解过程中的变化状态。实验测得溶液中总氮含量随时间的变化如图所示,反应初期溶液中的总氮含量先迅速降低后随即上升的原因是
]随时间的变化可知甘氨酸铬在降解过程中的变化状态。实验测得溶液中总氮含量随时间的变化如图所示,反应初期溶液中的总氮含量先迅速降低后随即上升的原因是 
Ⅲ.金属炭法
其他条件相同,分别取铝炭混合物和铁炭混合物,与含Zn2+的废水反应相同时间,Zn2+去除率与废水pH的关系如图所示。

(5)废水pH为3时,铝炭混合物对Zn2+去除率远大于铁炭混合物的主要原因是
(6)废水pH大于6,随着pH增大,铝炭混合物对Zn2+去除率增大的原因是
您最近一年使用:0次
2022-05-07更新
|
906次组卷
|
3卷引用:江苏省扬州中学2022-2023学年高二下学期期中考试化学试题
名校
3 . 工业或机动车尾气中的NOx会造成环境问题,可用多种方法脱除。
(1)碱液吸收:NaOH溶液可吸收硝酸工业尾气(含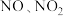 ),获得副产品
),获得副产品 。
。
①等物质的量NO与NO2被NaOH溶液吸收,反应的离子方程式为_______ 。
②若吸收时NO与NO2比例控制不当,则吸收液经浓缩结晶、过滤得到 晶体中最有可能混有的杂质是
晶体中最有可能混有的杂质是_______ (填化学式)。排放的尾气中含量较高的氮氧化物是_______ (填化学式)。
(2)还原法:尿素水溶液热解产生的NH3可去除尾气中的NOx,流程如下:
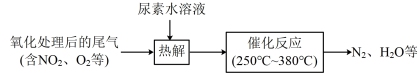
①尿素 中氮元素的化合价为
中氮元素的化合价为_______ 。
②写出“催化反应”过程中NH3还原NO2的化学方程式_______ 。
③若氧化处理后的尾气中混有SO2,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低NOx的去除率。试分析硫酸盐的产生过程_______ 。
④“催化反应”过程中需控制温度在 之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和
之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和_______ 。
(1)碱液吸收:NaOH溶液可吸收硝酸工业尾气(含
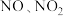 ),获得副产品
),获得副产品 。
。①等物质的量NO与NO2被NaOH溶液吸收,反应的离子方程式为
②若吸收时NO与NO2比例控制不当,则吸收液经浓缩结晶、过滤得到
 晶体中最有可能混有的杂质是
晶体中最有可能混有的杂质是(2)还原法:尿素水溶液热解产生的NH3可去除尾气中的NOx,流程如下:

①尿素
 中氮元素的化合价为
中氮元素的化合价为②写出“催化反应”过程中NH3还原NO2的化学方程式
③若氧化处理后的尾气中混有SO2,此时催化剂表面会因为覆盖部分硫酸盐而导致催化剂中毒,降低NOx的去除率。试分析硫酸盐的产生过程
④“催化反应”过程中需控制温度在
 之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和
之间。温度过高,NOx的去除率下降,其原因可能是温度过高催化剂的活性降低和
您最近一年使用:0次
2022-08-29更新
|
959次组卷
|
3卷引用:江苏省苏州市2021-2022学年高二下学期期末学业质量阳光指标调研(延期到8月)化学试题
真题
4 . 过氧化钙(CaO2·8H2O)是一种在水产养殖中广泛使用的供氧剂。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。
Ca(OH)2+H2O2+6H2O=CaO2·8H2O
反应时通常加入过量的Ca(OH)2,其目的是___________ 。
(2)向池塘水中加入一定量的CaO2·8H2O后,池塘水中浓度增加的离子有___________ (填序号)。
A.Ca2+B.H+C.CO D.OH−
D.OH−
(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I−完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
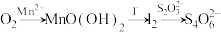
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:___________ 。
②取加过一定量CaO2·8H2O的池塘水样100.00mL,按上述方法测定水中溶解氧量,消耗0.01000mol·L−1Na2S2O3标准溶液13.50mL。计算该水样中的溶解氧(以mg·L−1表示),写出计算过程___________ 。
(1)Ca(OH)2悬浊液与H2O2溶液反应可制备CaO2·8H2O。
Ca(OH)2+H2O2+6H2O=CaO2·8H2O
反应时通常加入过量的Ca(OH)2,其目的是
(2)向池塘水中加入一定量的CaO2·8H2O后,池塘水中浓度增加的离子有
A.Ca2+B.H+C.CO
 D.OH−
D.OH−(3)水中溶解氧的测定方法如下:向一定量水样中加入适量MnSO4和碱性KI溶液,生成MnO(OH)2沉淀,密封静置;加入适量稀H2SO4,待MnO(OH)2与I−完全反应生成Mn2+和I2后,以淀粉作指示剂,用Na2S2O3标准溶液滴定至终点,测定过程中物质的转化关系如下:
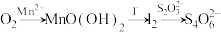
①写出O2将Mn2+氧化成MnO(OH)2的离子方程式:
②取加过一定量CaO2·8H2O的池塘水样100.00mL,按上述方法测定水中溶解氧量,消耗0.01000mol·L−1Na2S2O3标准溶液13.50mL。计算该水样中的溶解氧(以mg·L−1表示),写出计算过程
您最近一年使用:0次
2016-12-09更新
|
8611次组卷
|
7卷引用:2016-2017学年广东省深圳中学高二上第一次月考化学卷
名校
解题方法
5 . 氨既是一种重要的化工产品,又是一种重要的化工原料。下图为合成氨以及氨氧化制硝酸的流程示意图。

(1)合成塔中发生反应的化学方程式为:_______ 。
(2)工业生产中为了储运大量浓硝酸,最好选择_______作为罐体材料。
(3)与氮氧化物有关的全球或区域性大气环境问题有_______ (填字母序号)。
(4)人们开发了溶液吸收、催化还原等尾气处理方法。请以尾气中的NO2处理为例,写出相关反应的化学方程式:纯碱溶液吸收法:(提示:NO2与纯碱溶液反应可发生歧化生成两种盐) _______
(5)氮及其化合物在催化剂a和催化剂b转化过程如图所示,下列分析合理的是_______ 。

A.催化剂a表面发生了非极性共价键的断裂和极性共价键的形成
B.N2与H2反应属于氮的固定过程
C.在催化剂b表面形成氮氧键时不涉及电子转移
(6)某兴趣小组对反应2NH3(g) N2(g)+3H2(g)进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。
N2(g)+3H2(g)进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。

①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=_______ mol·L-1·min-1(用含t1的代数式表示);
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是_______ (用图中a、b、c、d表示)。

(1)合成塔中发生反应的化学方程式为:
(2)工业生产中为了储运大量浓硝酸,最好选择_______作为罐体材料。
| A.铜 | B.铂 | C.铝 | D.镁 |
| A.酸雨 | B.沙尘暴 | C.光化学烟雾 | D.白色污染 |
(5)氮及其化合物在催化剂a和催化剂b转化过程如图所示,下列分析合理的是

A.催化剂a表面发生了非极性共价键的断裂和极性共价键的形成
B.N2与H2反应属于氮的固定过程
C.在催化剂b表面形成氮氧键时不涉及电子转移
(6)某兴趣小组对反应2NH3(g)
 N2(g)+3H2(g)进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。
N2(g)+3H2(g)进行了实验探究。在一定温度和催化剂的条件下,将0.1 mol NH3通入3 L的密闭容器中进行反应(此时容器内总压为200 kPa),各物质的分压随时间的变化曲线如图所示。
①若保持容器体积不变,t1时反应达到平衡,用H2的浓度变化表示0~t1时间内的反应速率v(H2)=
②t2时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后N2分压变化趋势的曲线是
您最近一年使用:0次
6 . 以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,采用化学沉降法处理含砷废水,相关数据如表。
表1 几种砷酸盐的
表2 工厂污染物排放浓度及允许排放标准
回答以下问题:
(1)该工厂排放的废水中 的物质的量浓度为
的物质的量浓度为_______  。
。
(2)若处理后的工厂废水中 、
、 的浓度均为
的浓度均为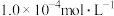 ,则此时废水中
,则此时废水中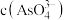 最大是
最大是_______  。
。
(3)工厂排放出的酸性废水中的三价砷( ,弱酸)不易沉降,可投入
,弱酸)不易沉降,可投入 先将其氧化成五价砷(
先将其氧化成五价砷( ,弱酸),写出该反应的离子方程式:
,弱酸),写出该反应的离子方程式:_______ 。
(4)在处理含砷废水时采用分段式,先向废水中投入适量生石灰调节pH为2,再投入适量生石灰将pH调节为8左右,使五价砷以 形式沉降。
形式沉降。
①将pH调节为2时废水中有大量沉淀产生,沉淀主要成分的化学式为_______ 。
②在pH调节为8左右才出现大量 沉淀的原因为
沉淀的原因为_______ 。
表1 几种砷酸盐的

| 难溶物 |  |
 | 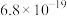 |
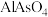 | 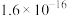 |
 |  |
| 污染物 |  |  |
| 浓度 | 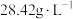 | 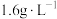 |
| 排放标准 |  | 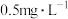 |
(1)该工厂排放的废水中
 的物质的量浓度为
的物质的量浓度为 。
。(2)若处理后的工厂废水中
 、
、 的浓度均为
的浓度均为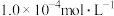 ,则此时废水中
,则此时废水中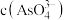 最大是
最大是 。
。(3)工厂排放出的酸性废水中的三价砷(
 ,弱酸)不易沉降,可投入
,弱酸)不易沉降,可投入 先将其氧化成五价砷(
先将其氧化成五价砷( ,弱酸),写出该反应的离子方程式:
,弱酸),写出该反应的离子方程式:(4)在处理含砷废水时采用分段式,先向废水中投入适量生石灰调节pH为2,再投入适量生石灰将pH调节为8左右,使五价砷以
 形式沉降。
形式沉降。①将pH调节为2时废水中有大量沉淀产生,沉淀主要成分的化学式为
②在pH调节为8左右才出现大量
 沉淀的原因为
沉淀的原因为
您最近一年使用:0次
7 . 氮和氮的化合物与人类有密切关系.
(1)氮的固定有利于生物吸收氮.下列属于氮的固定的是_______ (填序号).
①工业上N2和H2合成NH3 ②N2和O2放电条件下生成NO ③NH3催化氧化生成NO
写出反应③的化学方程式_______ .
(2)治理NO通常是在氧化剂作用下,将NO氧化成溶解度高的NO2,然后用水或碱液吸收脱氮.下列物质可以用作氧化NO的是_______ (填序号).
A.NaCl溶液 B.NaOH溶液 C.Na2CO3溶液 D.KMnO4溶液
若以NaClO溶液氧化NO,写出该反应的化学方程式,并用双线桥法标出反应中电子的得失和数目_______ .
(3)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应。用Rh做催化剂时该反应的过程示意图如下:

①过程Ⅰ为_______ 过程(填“吸热”或“放热”)。过程Ⅱ生成的化学键有_______ (填“极性键”、“非极性键”或“极性键和非极性键”)
②已知过程Ⅰ的焓变为akJ/mol,过程Ⅱ的焓变为bkJ/mol,则该反应的热化学方程式为_______ 。
(1)氮的固定有利于生物吸收氮.下列属于氮的固定的是
①工业上N2和H2合成NH3 ②N2和O2放电条件下生成NO ③NH3催化氧化生成NO
写出反应③的化学方程式
(2)治理NO通常是在氧化剂作用下,将NO氧化成溶解度高的NO2,然后用水或碱液吸收脱氮.下列物质可以用作氧化NO的是
A.NaCl溶液 B.NaOH溶液 C.Na2CO3溶液 D.KMnO4溶液
若以NaClO溶液氧化NO,写出该反应的化学方程式,并用双线桥法标出反应中电子的得失和数目
(3)CO与NO在Rh催化剂上的氧化还原反应是控制汽车尾气对空气污染的关键反应。用Rh做催化剂时该反应的过程示意图如下:

①过程Ⅰ为
②已知过程Ⅰ的焓变为akJ/mol,过程Ⅱ的焓变为bkJ/mol,则该反应的热化学方程式为
您最近一年使用:0次
名校
解题方法
8 . 回答下列问题:
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是___________ (填序号),可作为证据的实验现象是___________ (填字母序号)。
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO___________ H2O2(填“>”或“<”);当有0.1molO2生成时,转移电子的物质的量为___________ mol。
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。___________
(3)_____NaIO3+______NaHSO3——_____NaHSO4+_______Na2SO4+_____I2+_____H2O
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。
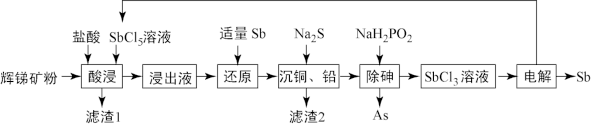
(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是___________ (填化学式)。
(5)写出“还原”反应的化学方程式___________ 。
I.双氧水和84消毒液是生活中常用的两种消毒剂。
(1)某同学设计如下实验研究H2O2的性质,能证明H2O2有还原性的实验是
| 序号 | 实验 | 实验现象 |
| 1 | 向5%H2O2溶液中滴加酸性KMnO4溶液 | a.溶液紫色褪去; b.有大量气泡产生 |
| 2 | 向5%H2O2溶液中滴加淀粉碘化钾溶液 | c.溶液变蓝 |
(2)某届奥运会期间,由于工作人员将84消毒液与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种原因可能是NaClO与H2O2反应产生O2促进藻类快速生长。该反应说明氧化性:NaClO
II.全球一半左右的碘是以智利硝石提取硝酸钠后的母液为原料,加入亚硫酸氢钠制取,相关反应如下,配平此化学方程式。
(3)_____NaIO3+______NaHSO3——_____NaHSO4+_______Na2SO4+_____I2+_____H2O
III.锑(Sb)被广泛用于生产各种阻燃剂、合金、陶瓷、半导体元件、医药用品等。以辉锑矿为原料制备金属锑的一种工艺流程如下。已知:辉锑矿的主要成分为Sb2S3,还含As2S5、PbS、CuO和SiO2等;浸出液主要含盐酸和SbCl3,还含SbCl5、CuCl2、AlCl3和PbCl2等。

(4)“酸浸”过程中SbCl5和Sb2S3反应有S生成,该反应的还原产物是
(5)写出“还原”反应的化学方程式
您最近一年使用:0次
2021-07-28更新
|
1110次组卷
|
3卷引用:吉林省长春希望高中2020-2021学年高二下学期期末考试化学试题
2014·海南·高考真题
真题
名校
9 . 锂锰电池的体积小、性能优良,是常用的一次电池。该电池反应原理如图所示,其中电解质LiClO4,溶于混合有机溶剂中,Li+通过电解质迁移入MnO2晶格中,生成LiMnO2。 回答下列问题:
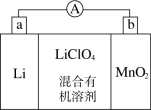
(1)外电路的电流方向是由________ 极流向________ 极(填字母)。
(2)电池正极反应式为___________________________________ 。
(3)是否可用水代替电池中的混合有机溶剂?________ (填“是”或“否”),原因是________________________________________________________________ 。
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为_______________________________________________ 。K2MnO4在酸性溶液中歧化,生成KMnO4和MnO2的物质的量之比为___________ 。

(1)外电路的电流方向是由
(2)电池正极反应式为
(3)是否可用水代替电池中的混合有机溶剂?
(4)MnO2可与KOH和KClO3在高温下反应,生成K2MnO4,反应的化学方程式为
您最近一年使用:0次
2016-12-09更新
|
4988次组卷
|
15卷引用:2014-2015学年黑龙江省哈尔滨市第六中学高二10月月考化学试卷
(已下线)2014-2015学年黑龙江省哈尔滨市第六中学高二10月月考化学试卷福建省惠安惠南中学2017-2018学年高二10月月考(理)化学试题河南省郑州市第一中学2018-2019学年高二上学期入学测试化学试题人教版(2019)高二选择性必修第一册 第四章 化学反应与电能 第一节 原电池 教材帮黑龙江省大兴安岭呼玛县高级中学2021-2022学年高二上学期期末考试化学试题2014年全国普通高等学校招生统一考试理科综合能力测试化学(海南卷)河北省张家口市第一中学2016-2017学年高一(衔接班)6月月考(理)化学试题湖北省沙市中学2018届高三上学期第二次双周考试化学试题(已下线)2019高考备考二轮复习精品资料-专题3 氧化还原反应(教学案)(已下线)2019高考备考二轮复习精品资料-专题10 电化学及其应用(教学案)湖南省双峰县第一中学2018-2019学年高一6月月考化学试题安徽省淮北市第一中学2019-2020学年高一下学期第二次线上学习考试(3月)化学试题山东省德州市齐河县实验中学2019-2020学年高一下学期期中考试化学试题浙江省宁波市北仑中学2020-2021学年高一下学期期中考试化学(1班选考)试题河南省新蔡县第一高级中学2020-2021学年高一下学期5月月考化学试题
解题方法
10 . 将氧化铁还原为铁的技术在人类文明的进步中占有十分重要的地位。炼铁高炉中发生的关键反应如下:
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
CO2(g)+C(s)=2CO(g) ΔH=+172.46 kJ/mol
Fe2O3+CO→Fe+CO2
若已知:2Fe(s)+ O2(g)=Fe2O3(s) ΔH=-824.21 kJ/mol
O2(g)=Fe2O3(s) ΔH=-824.21 kJ/mol
根据上面三个热化学方程式,回答下列问题:
(1)CO的摩尔燃烧焓为_______ ;写出其热化学方程式:_______ 。
(2)高炉内Fe2O3被CO还原为Fe的热化学方程式为_______ 。
(3)炼制1吨含铁96%的生铁所需焦炭的理论用量是_______ 吨,实际生产中所需焦炭远高于理论用量,其原因是_______ 。
C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ/mol
CO2(g)+C(s)=2CO(g) ΔH=+172.46 kJ/mol
Fe2O3+CO→Fe+CO2
若已知:2Fe(s)+
 O2(g)=Fe2O3(s) ΔH=-824.21 kJ/mol
O2(g)=Fe2O3(s) ΔH=-824.21 kJ/mol根据上面三个热化学方程式,回答下列问题:
(1)CO的摩尔燃烧焓为
(2)高炉内Fe2O3被CO还原为Fe的热化学方程式为
(3)炼制1吨含铁96%的生铁所需焦炭的理论用量是
您最近一年使用:0次



