1 . 土壤中硝酸盐会被细菌分解。有一种脱氧硫杆菌能够利用土壤中的硫化物来分解硝酸盐,其主要化学原理如下:
___________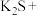 ___________
___________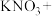 ___________
___________ ___________
___________ ___________
___________ ___________KOH
___________KOH
①配平反应方程式,并标出电子转移的方向和数目。___________
②上述反应___________ 元素被氧化,发生氧化反应的物质是___________ 。若生成
 ,转移电子数为
,转移电子数为___________ 个。
___________
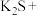 ___________
___________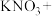 ___________
___________ ___________
___________ ___________
___________ ___________KOH
___________KOH①配平反应方程式,并标出电子转移的方向和数目。
②上述反应

 ,转移电子数为
,转移电子数为
您最近一年使用:0次
2 . 化学与人类生活、生产密切相关。请根据题意填空:
(1)我国5G通信技术处于世界领先地位,高速通信离不开光导纤维,用于制造光导纤维的基本原料是___________ (填“SiO2”或“Si”);
(2)“84”消毒液在新冠肺炎疫情防控中发挥了很大的作用,已知“84”消毒液的制备原理为Cl2+2NaOH=NaCl+NaClO+H2O,则“84”消毒液的有效成分为___________ (填“NaCl”或“NaClO”);
(3)在汽车排气管上安装催化转化装置,可使尾气中的NO和CO反应转化为无污染的物质,请完成该反应的化学方程式:2CO+2NO 2CO2+
2CO2+___________ 。
(1)我国5G通信技术处于世界领先地位,高速通信离不开光导纤维,用于制造光导纤维的基本原料是
(2)“84”消毒液在新冠肺炎疫情防控中发挥了很大的作用,已知“84”消毒液的制备原理为Cl2+2NaOH=NaCl+NaClO+H2O,则“84”消毒液的有效成分为
(3)在汽车排气管上安装催化转化装置,可使尾气中的NO和CO反应转化为无污染的物质,请完成该反应的化学方程式:2CO+2NO
 2CO2+
2CO2+
您最近一年使用:0次
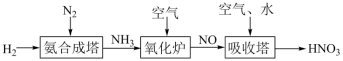
3 . 氮元素形成的化合物种类十分丰富。请根据以下工业制硝酸的原理示意图回答含氮化合物相关的问题: 的说法中,不正确的是___________(填字母)。
的说法中,不正确的是___________(填字母)。
(2)氨气在氧化炉中发生反应的化学方程式为___________ 。
(3)氮的氧化物(NOx)是常见的大气污染物之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质NO与NO2的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为___________ 。
(4)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的污染,可用以下两种方法处理:
①可用ClO2将氮氧化物转化成 。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为___________ 。
②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为___________ 。
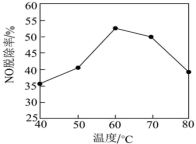
③还有人研究:在不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃ 时,NO 脱除率下降的原因是___________ 。
 的说法中,不正确的是___________(填字母)。
的说法中,不正确的是___________(填字母)。A.工业合成 需要在高温、高压、催化剂下进行 需要在高温、高压、催化剂下进行 |
B. 可用来生产碳铵和尿素等化肥 可用来生产碳铵和尿素等化肥 |
C. 可用浓硫酸或无水氯化钙干燥 可用浓硫酸或无水氯化钙干燥 |
D. 受热易分解,须置于冷暗处保存 受热易分解,须置于冷暗处保存 |
(3)氮的氧化物(NOx)是常见的大气污染物之一,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。当物质NO与NO2的物质的量之比为1:1时,与足量氨气能在催化剂作用下发生反应,生成两种无污染的物质,该反应的化学方程式为
(4)“吸收塔”尾部会有含NO、NO2等氮氧化物的尾气排出,为消除它们对环境的污染,可用以下两种方法处理:
①可用ClO2将氮氧化物转化成
 。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为
。向含ClO2的溶液中加入NaOH溶液调节至碱性,ClO2转化为去除氮氧化物效果更好的NaClO2,再通入NO气体进行反应。碱性条件下NaClO2去除NO反应的离子方程式为②氨转化法。已知7mol氨恰好能将含NO和NO2共6mol的混合气体完全转化为N2,则混合气体中NO和NO2的物质的量之比为
③还有人研究:在不同温度下经酸化处理的Ca(ClO)2溶液对NO脱除率的影响,结果如图所示。在60~80℃ 时,NO 脱除率下降的原因是
您最近一年使用:0次
名校
4 . 如图是氮元素的各种价态与物质类别的对应关系:_____ 。从氮元素的化合价能否发生变化的角度判断,图中既有氧化性又有还原性的化合物有_______ 。
(2)实验室将浓氨水加入生石灰中可以快速制取NH3的化学方程式为_________ 。
(3)浓硝酸、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应使用___________ 。
(4)汽车尾气中含有CO和NOx等多种有害气体,若在汽车的排气管上安装一种催化转化装置,可使CO与NOx反应,生成两种无毒气体,则该反应的化学方程式为_____________ 。

(2)实验室将浓氨水加入生石灰中可以快速制取NH3的化学方程式为
(3)浓硝酸、稀硝酸的性质既相似又有差别,若要除去铁制品表面的铜镀层应使用
(4)汽车尾气中含有CO和NOx等多种有害气体,若在汽车的排气管上安装一种催化转化装置,可使CO与NOx反应,生成两种无毒气体,则该反应的化学方程式为
您最近一年使用:0次
5 . 二氧化氯(ClO2)是国际公认的广谱、高效和安全的杀菌剂。
(1)制备C1O2的一种方法是在酸性条件下用草酸(碳的价态+3价)和氯酸钠反应,配平该反应的化学方程式,并标出电子转移的方向和数目:________ 。
_____H2C2O4+_____NaClO3+____H2SO4→_____ Na2SO4+___CO2↑+_____ClO2↑+___ H2O
(2)上述反应中被氧化的元素是____ ,氧化产物是_____ 。
(3)若反应中生成1.12L(标况) ClO2,转移电子数目为________ 。
(4)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,计算ClO2的消毒能力是等质量Cl2的_____ 倍(保留2位小数)。
(5)若以NaClO2为原料制备ClO2,需要加入具有____ (填“氧化性”或“还原性”)的物质。
(1)制备C1O2的一种方法是在酸性条件下用草酸(碳的价态+3价)和氯酸钠反应,配平该反应的化学方程式,并标出电子转移的方向和数目:
_____H2C2O4+_____NaClO3+____H2SO4→_____ Na2SO4+___CO2↑+_____ClO2↑+___ H2O
(2)上述反应中被氧化的元素是
(3)若反应中生成1.12L(标况) ClO2,转移电子数目为
(4)ClO2具有强氧化性,若ClO2和Cl2在消毒时自身均被还原为Cl-,计算ClO2的消毒能力是等质量Cl2的
(5)若以NaClO2为原料制备ClO2,需要加入具有
您最近一年使用:0次
6 . 锑白 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的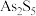 、
、 、
、 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: 、
、 、
、 、
、 、
、 、
、 、
、 ;
;
② ,
, 。
。
回答下列问题:
(1)粉碎辉锑矿的目的是_______ 。
(2)滤渣I的成分除不溶性杂质外还有PbS、S、_______ (填化学式)。 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为_______ 。
(3)“除砷”时氧化剂与还原剂的物质的量之比为_______ (P转化为最高价态)。
(4)若浸取液 、
、 浓度均为
浓度均为 ,
,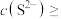
_______  才能使二者完全沉淀(当离子浓度
才能使二者完全沉淀(当离子浓度 时认为沉淀完全),此时
时认为沉淀完全),此时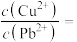
_______ 。
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:_______ ;随温度升高,脱氯率降低可能的原因为_______ 。
 是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为
是优良的无机白色颜料,可用作阻燃剂、催化剂、油漆等。一种采用辉锑矿(主要成分为 ,含少量的
,含少量的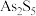 、
、 、
、 和
和 等)提取锑白的工艺流程如图所示:
等)提取锑白的工艺流程如图所示: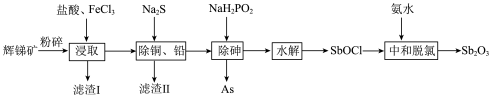
 、
、 、
、 、
、 、
、 、
、 、
、 ;
;②
 ,
, 。
。回答下列问题:
(1)粉碎辉锑矿的目的是
(2)滤渣I的成分除不溶性杂质外还有PbS、S、
 在“浸取”时发生反应的离子方程式为
在“浸取”时发生反应的离子方程式为(3)“除砷”时氧化剂与还原剂的物质的量之比为
(4)若浸取液
 、
、 浓度均为
浓度均为 ,
,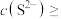
 才能使二者完全沉淀(当离子浓度
才能使二者完全沉淀(当离子浓度 时认为沉淀完全),此时
时认为沉淀完全),此时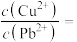
(5)“中和脱氯”时脱氯率与反应温度的关系如图所示:

您最近一年使用:0次
名校
7 . 高一年级小村同学最近通过学习了解到:“肼”( )是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
)是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
(1) 属于
属于_______ 化合物(填“离子化合物”或“共价化合物”),所含化学键类型有_______ (填“离子键”或“极性键”或“非极性键”)
(2)已知①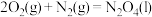
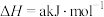
②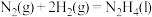
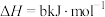
③
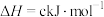
某型号火箭采用液态肼和液态 作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式
作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式________ 。
(3)液态肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的热化学方程式________ ,理论上每消耗64 g肼可除去标准状况下
________ L。
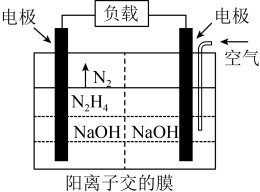
(4)科学家用肼作为燃料电池的燃料,电池结构如图所示,写出负极的电极反应式_________ 。
 )是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。
)是一种重要的化学物质,可用作喷气式发动机燃料、火箭燃料、显影剂、抗氧剂、还原剂等。请结合数据完成下面有关“肼”的化学问题。(1)
 属于
属于(2)已知①
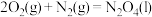
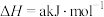
②
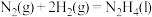
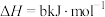
③

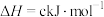
某型号火箭采用液态肼和液态
 作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式
作推进剂,燃烧生成两种无污染气体。写出反应的热化学方程式(3)液态肼可以除去水中的溶解氧,且生成物能参与大气循环。写出该反应的热化学方程式

(4)科学家用肼作为燃料电池的燃料,电池结构如图所示,写出负极的电极反应式

您最近一年使用:0次
解题方法
8 . 连二亚硫酸钠 俗称低亚硫酸钠,广泛用于纺织、医药、选矿、造纸工业。某实验小组拟用甲酸钠、烧碱、二氧化硫制备连二亚硫酸钠并测定其纯度。
俗称低亚硫酸钠,广泛用于纺织、医药、选矿、造纸工业。某实验小组拟用甲酸钠、烧碱、二氧化硫制备连二亚硫酸钠并测定其纯度。
查阅资料:连二亚硫酸钠是白色结晶粉末,极易溶于水,不溶于乙醇,加热到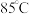 以上分解放出二氧化硫,空气中能被氧化,是一种强还原剂。
以上分解放出二氧化硫,空气中能被氧化,是一种强还原剂。
I. 的制备。
的制备。 时选用上图所示装置中的
时选用上图所示装置中的_______ (填小写字母),选用以下试剂中的_______ (填选项字母)。
A.铜粉 B. C.
C. 浓硫酸 D.
浓硫酸 D. 硫酸 E.
硫酸 E. 硫酸 F.浓盐酸 G.稀硝酸
硫酸 F.浓盐酸 G.稀硝酸
II. 的制备。
的制备。
利用如图所示实验装置(加热、搅拌及夹持装置省略)制备 ,实验步骤如下:
,实验步骤如下:
ii.持续通入 ,保持水浴温度
,保持水浴温度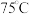 左右反应
左右反应 ;
;
iii.停止加热,冷却至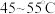 ;
;
iv.拆卸装置,将e中的混合物经过_______、洗涤后得到粗产品。
(2)步骤i先通入 的目的是
的目的是_______ 。
(3)装置e中发生的主要反应的化学方程式为_______ 。
(4)步骤iv的空白处实验操作为_______ 。洗涤粗产品的洗涤剂为_______ (填“水”或“乙醇”),进一步提纯 的方法为
的方法为_______ 。
III. 纯度的测定。
纯度的测定。
称取纯化后的产品mg溶于水,加入 溶液碱化后配成
溶液碱化后配成 待测液,量取
待测液,量取 待测液于锥形瓶中,加入
待测液于锥形瓶中,加入 滴亚甲基蓝,用
滴亚甲基蓝,用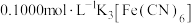 标准液进行滴定,当溶液颜色由无色变为蓝色时,达到滴定终点,进行三次平行实验消耗标准液
标准液进行滴定,当溶液颜色由无色变为蓝色时,达到滴定终点,进行三次平行实验消耗标准液 {已知滴定过程中主要转化为
{已知滴定过程中主要转化为 ,
,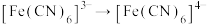 }。
}。
(5)下列情况会造成测定结果偏小的是_______(填选项字母)。
(6)产品的纯度为_______ (用含c、V的代数式表示)。
 俗称低亚硫酸钠,广泛用于纺织、医药、选矿、造纸工业。某实验小组拟用甲酸钠、烧碱、二氧化硫制备连二亚硫酸钠并测定其纯度。
俗称低亚硫酸钠,广泛用于纺织、医药、选矿、造纸工业。某实验小组拟用甲酸钠、烧碱、二氧化硫制备连二亚硫酸钠并测定其纯度。查阅资料:连二亚硫酸钠是白色结晶粉末,极易溶于水,不溶于乙醇,加热到
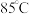 以上分解放出二氧化硫,空气中能被氧化,是一种强还原剂。
以上分解放出二氧化硫,空气中能被氧化,是一种强还原剂。I.
 的制备。
的制备。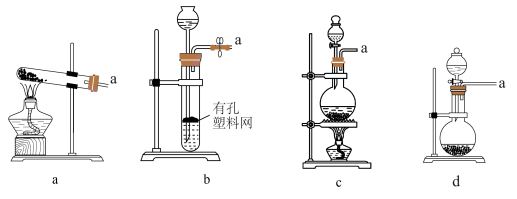
 时选用上图所示装置中的
时选用上图所示装置中的A.铜粉 B.
 C.
C. 浓硫酸 D.
浓硫酸 D. 硫酸 E.
硫酸 E. 硫酸 F.浓盐酸 G.稀硝酸
硫酸 F.浓盐酸 G.稀硝酸II.
 的制备。
的制备。利用如图所示实验装置(加热、搅拌及夹持装置省略)制备
 ,实验步骤如下:
,实验步骤如下: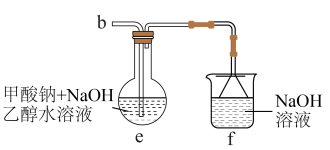
ii.持续通入
 ,保持水浴温度
,保持水浴温度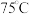 左右反应
左右反应 ;
;iii.停止加热,冷却至
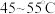 ;
;iv.拆卸装置,将e中的混合物经过_______、洗涤后得到粗产品。
(2)步骤i先通入
 的目的是
的目的是(3)装置e中发生的主要反应的化学方程式为
(4)步骤iv的空白处实验操作为
 的方法为
的方法为III.
 纯度的测定。
纯度的测定。称取纯化后的产品mg溶于水,加入
 溶液碱化后配成
溶液碱化后配成 待测液,量取
待测液,量取 待测液于锥形瓶中,加入
待测液于锥形瓶中,加入 滴亚甲基蓝,用
滴亚甲基蓝,用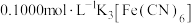 标准液进行滴定,当溶液颜色由无色变为蓝色时,达到滴定终点,进行三次平行实验消耗标准液
标准液进行滴定,当溶液颜色由无色变为蓝色时,达到滴定终点,进行三次平行实验消耗标准液 {已知滴定过程中主要转化为
{已知滴定过程中主要转化为 ,
,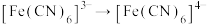 }。
}。(5)下列情况会造成测定结果偏小的是_______(填选项字母)。
| A.盛放待测液的锥形瓶内残留少量蒸馏水 |
B.未用 标准液润洗酸式滴定管 标准液润洗酸式滴定管 |
| C.若考虑空气参与上述滴定氧化还原反应 |
| D.滴定终点时俯视读数 |
(6)产品的纯度为
您最近一年使用:0次
9 . 硫脲 在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备 ,然后
,然后 再与
再与 合成
合成 ,实验装置(夹持及加热装置略)如图所示。回答下列问题:
,实验装置(夹持及加热装置略)如图所示。回答下列问题: 易溶于水,易被氧化,受热时部分发生异构化生成
易溶于水,易被氧化,受热时部分发生异构化生成 。
。
实验(一):制备硫脲。
(1)装置B中饱和NaHS溶液的作用是_______ 。
(2)检查装置气密性后加入药品,打开 ,通入一段时间
,通入一段时间 ,再打开
,再打开 ,当观察到
,当观察到_______ 时,再打开 。
。
(3)完成(2)中操作后,水浴加热装置D,在80℃条件下合成硫脲,控制温度在880℃的原因是_______ ;装置D中除生成硫脲外,还生成一种碱,写出该过程D中发生反应的化学方程式:_______ 。
实验(二):探究硫脲的性质。
(4)①取少量 溶于水,加热至150℃,一段时间后再冷却至室温,滴加
溶于水,加热至150℃,一段时间后再冷却至室温,滴加_______ ,可检验是否有 生成。
生成。
②取少量 溶于NaOH溶液,加入
溶于NaOH溶液,加入 溶液,过滤,洗涤,得到黑色固体,由此推知,
溶液,过滤,洗涤,得到黑色固体,由此推知, 在碱性条件下会生成
在碱性条件下会生成_______ (填离子符号)。
③取少量 溶液通过如图实验验证
溶液通过如图实验验证 被酸性
被酸性 溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性
溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性 溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有
溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有 生成,则石墨电极上的反应式为
生成,则石墨电极上的反应式为_______ 。
(5)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取mg产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用cmol/L酸性 标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为_______ (用含m、c、V的代数式表示)。
 在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备
在药物制备、金属矿物浮选等方面有广泛应用。实验室中可先制备 ,然后
,然后 再与
再与 合成
合成 ,实验装置(夹持及加热装置略)如图所示。回答下列问题:
,实验装置(夹持及加热装置略)如图所示。回答下列问题: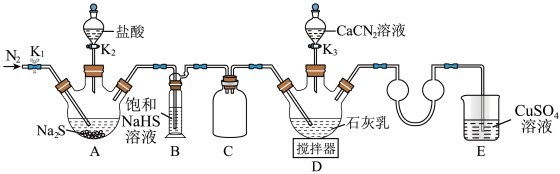
 易溶于水,易被氧化,受热时部分发生异构化生成
易溶于水,易被氧化,受热时部分发生异构化生成 。
。实验(一):制备硫脲。
(1)装置B中饱和NaHS溶液的作用是
(2)检查装置气密性后加入药品,打开
 ,通入一段时间
,通入一段时间 ,再打开
,再打开 ,当观察到
,当观察到 。
。(3)完成(2)中操作后,水浴加热装置D,在80℃条件下合成硫脲,控制温度在880℃的原因是
实验(二):探究硫脲的性质。
(4)①取少量
 溶于水,加热至150℃,一段时间后再冷却至室温,滴加
溶于水,加热至150℃,一段时间后再冷却至室温,滴加 生成。
生成。②取少量
 溶于NaOH溶液,加入
溶于NaOH溶液,加入 溶液,过滤,洗涤,得到黑色固体,由此推知,
溶液,过滤,洗涤,得到黑色固体,由此推知, 在碱性条件下会生成
在碱性条件下会生成③取少量
 溶液通过如图实验验证
溶液通过如图实验验证 被酸性
被酸性 溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性
溶液氧化的产物。关闭K,发现电流计指针偏转;一段时间后,左烧杯中酸性 溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有
溶液褪色,右烧杯中产生两种无毒气体,其溶液经检验有 生成,则石墨电极上的反应式为
生成,则石墨电极上的反应式为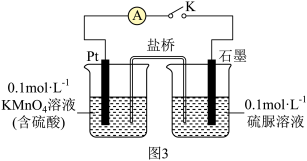
(5)装置D反应后的液体经分离、提纯、烘干可得产品。测定产品的纯度:称取mg产品,加水溶解配成250mL溶液,取25mL于锥形瓶中,加入稀硫酸酸化,用cmol/L酸性
 标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
标准溶液滴定,滴定至终点时消耗标准溶液VmL。则样品中硫脲的质量分数为
您最近一年使用:0次
解题方法
10 . 元素周期表可以用于探寻各种元素间的内在联系。
(1)下列关于元素周期表的说法错误的是______ 。
a.门捷列夫按照原子的核电荷数由小到大排列制出了第一张元素周期表
b.元素周期表由三个短周期,四个长周期构成
c.在金属和非金属的分界线处寻找半导体材料
d.元素周期表中含有主族、副族、第VⅢ族、0族等十八个族
(2)利用元素在周期表中的位置、结构、性质的关系,得出的结论正确的是______ 。
a.原子半径:Li>Na>K b.酸性:H3PO4>H2SO4>HClO4
c.稳定性:H2Se>H2S>H2O d.碱性:NaOH>Mg(OH)2>Al(OH)3
(3)碳族元素包括:C、Si、Ge、Sn、Pb、Fl(放射性元素)
①请完成CO2和KOH溶液恰好反应生成正盐的离子方程式_______ 。
②写出Si在元素周期表中的位置_______ 。由碳族元素结构特点,可推测Pb3O4中Pb的化合价为_____ 。
(4)卤族元素包括:F、Cl、Br、I、At(放射性元素)
①Br与F的原子序数的差值为______ 。
②已知某溶液中只含有Fe2+、Cl﹣、Br﹣、I﹣,且c(Cl﹣):c(Br﹣):c(I﹣)=1:1:2,则c(Fe2+):c(Br﹣)=____ 。向其中通入一定量的氯气发生反应,当c(Fe2+):c(Cl﹣)=1:4时,离子方程式为_____ 。
(1)下列关于元素周期表的说法错误的是
a.门捷列夫按照原子的核电荷数由小到大排列制出了第一张元素周期表
b.元素周期表由三个短周期,四个长周期构成
c.在金属和非金属的分界线处寻找半导体材料
d.元素周期表中含有主族、副族、第VⅢ族、0族等十八个族
(2)利用元素在周期表中的位置、结构、性质的关系,得出的结论正确的是
a.原子半径:Li>Na>K b.酸性:H3PO4>H2SO4>HClO4
c.稳定性:H2Se>H2S>H2O d.碱性:NaOH>Mg(OH)2>Al(OH)3
(3)碳族元素包括:C、Si、Ge、Sn、Pb、Fl(放射性元素)
①请完成CO2和KOH溶液恰好反应生成正盐的离子方程式
②写出Si在元素周期表中的位置
(4)卤族元素包括:F、Cl、Br、I、At(放射性元素)
①Br与F的原子序数的差值为
②已知某溶液中只含有Fe2+、Cl﹣、Br﹣、I﹣,且c(Cl﹣):c(Br﹣):c(I﹣)=1:1:2,则c(Fe2+):c(Br﹣)=
您最近一年使用:0次



