名校
解题方法
1 . 已知Mn2O 与S2-在酸性溶液中能发生反应: Mn2O
与S2-在酸性溶液中能发生反应: Mn2O +3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O
+3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O 中锰元素的化合价是
中锰元素的化合价是
 与S2-在酸性溶液中能发生反应: Mn2O
与S2-在酸性溶液中能发生反应: Mn2O +3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O
+3S2-+14H+=2Mn3++3S↓+7H2O,则Mn2O 中锰元素的化合价是
中锰元素的化合价是| A.+2 | B.+4 | C.+3 | D.+6 |
您最近一年使用:0次
2022-02-28更新
|
850次组卷
|
36卷引用:广东省湛江市第四中学2020-2021学年高一上学期期中考试化学试题
广东省湛江市第四中学2020-2021学年高一上学期期中考试化学试题河南省安阳市第三十六中学2017-2018学年高一上学期期中考试化学试题安徽省阜阳市第三中学2018-2019学年高一下学期开学考试化学试题夯基提能2020届高三化学选择题对题专练——氧化还原反应的实际应用广东省2020年普通高中学业水平考试化学合格性考试模拟试题(七)陕西省汉中市龙岗学校2019-2020学年高一上学期期末考试化学试题(已下线)【南昌新东方】江西省九江一中2013-2014学年高一上学期期中考试化学试题广东省珠海市第二中学2019-2020学年高一上学期期中考试化学试题广东省中山纪念中学2019-2020学年高一上学期第二次段考化学试题山东省济宁市邹城兖矿一中2020-2021学年度高一9月月考化学试题吉林公主岭范家屯一中2020-2021学年高一上学期期中考试化学试题(已下线)【浙江新东方】30湖南省岳阳市楚雄中学2020-2021学年高一上学期期中考试化学试题北京市铁路第二中学2020-2021学年高一上学期期中考试化学试题(已下线)【南昌新东方】9. 2020 高一上 铁路一中 刘惠文 钟欣(已下线)【浙江新东方】双师 (55)宁夏青铜峡市高级中学2020-2021学年高一12月月考化学试题河北衡水市第十四中学2020-2021学年高一上学期三调考试化学试题河北省衡水市武邑武罗学校2020-2021学年高一上学期期中考试化学试题河北省衡水市武强中学2020-2021学年高一上学期第一次月考化学试题黑龙江省鸡西市第一中学2020-2021学年高一上学期第一次月考化学试题云南省昆明市第八中学2020-2021学年高一上学期期中考试化学试题天津市滨海新区2020-2021学年高一上学期期末考试化学试题新疆巴音郭楞蒙古自治州第二中学2021届高三上学期第一次摸底考试化学试题云南省玉溪市江川区第二中学2020-2021学年高一下学期竞赛化学试题四川省成都市第七中学2021-2022学年高一上学期期中考试化学试题四川省攀枝花市第十五中学校2021-2022学年高一上学期期中考试化学试题安徽省安庆市第十中学2021-2022学年高一上学期10月月考化学试题江苏省宿迁市泗阳县实验高级中学2021-2022学年高一上学期第二次调研测试化学试题广东省梅州市兴宁市叶塘中学2021-2022学年高一上学期摸底考试化学试题浙江省绿谷联盟2022-2023学年高一上学期10月份考试化学试题 黑龙江省鹤岗市第一中学2022-2023学年高一上学期10月月考化学试题山西省晋城市第一中学校2022-2023学年高一上学期第二次调研考试化学试题四川省仁寿县铧强中学2021-2022学年高一上学期半期考试化学试题(已下线)专题七 氧化还原反应天津市宁河区2023-2024学年高一上学期期末考试化学试题
名校
解题方法
2 . 已知实验室制取氯气的反应原理为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O,据此回答下列问题:
MnCl2+Cl2↑+2H2O,据此回答下列问题:
(1)该反应中氧化剂是__________ (填化学式,下同),被氧化的元素是_______ 元素,氧化产物是__________ 。
(2)若反应中生成1mol Cl2,则转移的电子为_____ mol。
(3)用单线桥法表示电子转移的方向和数目:_______________ MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(4)有一种“地康法”制取氯气的反应原理如下所示:
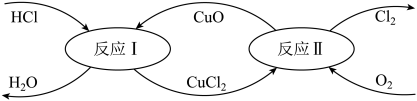
反应Ⅰ:CuO + 2HCl=CuCl2 + H2O
反应Ⅱ:2CuCl2 + O2 =2CuO + 2Cl2
①反应Ⅰ的离子方程式为______________________________________________________ 。
②反应Ⅱ属于____________ 反应。(填四种基本反应类型之一)
③工业生产中常用氨气检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式:____________________________________________________ 。
 MnCl2+Cl2↑+2H2O,据此回答下列问题:
MnCl2+Cl2↑+2H2O,据此回答下列问题:(1)该反应中氧化剂是
(2)若反应中生成1mol Cl2,则转移的电子为
(3)用单线桥法表示电子转移的方向和数目:
 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O(4)有一种“地康法”制取氯气的反应原理如下所示:

反应Ⅰ:CuO + 2HCl=CuCl2 + H2O
反应Ⅱ:2CuCl2 + O2 =2CuO + 2Cl2
①反应Ⅰ的离子方程式为
②反应Ⅱ属于
③工业生产中常用氨气检查输送氯气的管道是否有Cl2泄漏。若Cl2有泄漏,可以观察到有大量的白烟生成(为NH4Cl固体),同时会生成一种空气中含量最多的物质,试写出该反应的化学方程式:
您最近一年使用:0次
2020-10-21更新
|
231次组卷
|
2卷引用:广东省湛江市第四中学2020-2021学年高一上学期期中考试化学试题
解题方法
3 . 磷酸亚铁锂(LiFePO4)电池是新能源汽车的动力电池之一。废旧电池正极片(磷酸亚铁锂、炭黑和铝箔等)可再生利用,其工艺流程如图:
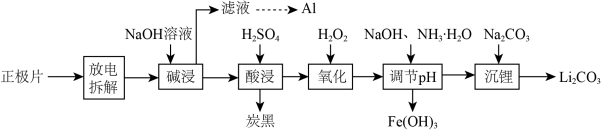
已知:碳酸锂在水中的溶解度:0℃时1.54g,90℃时0.85g,100℃时0.71g。
(1)上述流程中要得到Li2CO3的操作是___ 。
(2) “氧化”发生反应的离子方程式为___ ;若用HNO3代替H2O2,不足之处是___ 。
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为___ mol·L-1。
②“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如表:
则最佳的沉淀pH=___ 。
(4) “沉锂”时所得的沉淀应用___ 洗涤(填“热水”或“冷水”)。
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为___ 。

已知:碳酸锂在水中的溶解度:0℃时1.54g,90℃时0.85g,100℃时0.71g。
(1)上述流程中要得到Li2CO3的操作是
(2) “氧化”发生反应的离子方程式为
(3)①已知Ksp[Fe(OH)3]=2.6×10-39。常温下,在Fe(OH)3悬浊液中,当溶液的pH=3.0时,Fe3+的浓度为
②“调节pH”生成沉淀时,溶液pH与金属元素的沉淀百分率(ω)的关系如表:
| pH | 3.5 | 5.0 | 6.5 | 8.0 | 10.0 | 12.0 |
| ω(Fe)/% | 66.5 | 79.2 | 88.5 | 97.2 | 97.4 | 98.1 |
| ω(Li)/% | 0.9 | 1.3 | 1.9 | 2.4 | 4.5 | 8.0 |
则最佳的沉淀pH=
(4) “沉锂”时所得的沉淀应用
(5)磷酸亚铁锂电池在工作时,正极发生LiFePO4和FePO4的转化,该电池放电时正极的电极反应式为
您最近一年使用:0次
4 . 四氧化三锰既是磁性材料锰锌铁氧体(ZnaMnbFecO4,Fe元素为+3价,Zn、Mn元素化合价相同)的重要生产原料,也常被用作氮氧化物分解的催化剂。近年来对制备高品质四氧化三锰的研究越来越受到重视。以硫酸锰为原料制备四氧化三锰的工艺流程如图:

回答下列问题:
(1)“溶解”时需用玻璃棒,其作用为____ 。
(2)“碱化”时反应离子方程式为____ 。
(3)滤液X中含有的溶质为____ (填化学式)。
(4)简述“碱化”得到的沉淀是否洗涤干净的方法:_____ 。
(5)“氧化”时发生的化学反应方程式为____ 。
(6)研究实验条件发现:在其他条件不变的情况下,加快和H2O2的滴加速度,氧化速率并未明显加快,其原因是____ (用化学方程式表示)。
(7)取30.2gMnSO4经上述工艺过程后,生成____ gMn3O4(假设Mn元素不损失)。

回答下列问题:
(1)“溶解”时需用玻璃棒,其作用为
(2)“碱化”时反应离子方程式为
(3)滤液X中含有的溶质为
(4)简述“碱化”得到的沉淀是否洗涤干净的方法:
(5)“氧化”时发生的化学反应方程式为
(6)研究实验条件发现:在其他条件不变的情况下,加快和H2O2的滴加速度,氧化速率并未明显加快,其原因是
(7)取30.2gMnSO4经上述工艺过程后,生成
您最近一年使用:0次
名校
解题方法
5 . 锰的化合物在工业、医疗等领域有重要应用。某兴趣小组模拟工业制备KMnO4及探究锰(II)盐能否被氧化为高锰(VI)酸盐。已知:酸性条件下,KMnO4可氧化Cl-。
I.KMnO4的制备:
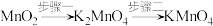
反应原理:
步骤一:3MnO2+6KOH+KClO3=3K2MnO4(墨绿色)+KCl+3H2O
步骤二:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
实验操作:
步骤一:将一定比例的MnO2、KOH和KClO3固体混合加热,得到墨绿色的固体,冷却后加水充分溶解,然后将得到的碱性K2MnO4溶液放入烧杯C中。
步骤二:连接装置,检查气密性后装入药品。打开分液漏斗活塞,当C中溶液完全变为紫红色时,关闭活塞停止反应,分离、提纯获取KMnO4晶体。
实验装置如图所示:
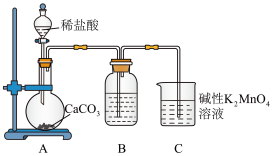
(1)检查装置A气密性:关闭分液漏斗活塞,在B中加入蒸馏水至液面超过长导管口,用热毛巾捂住圆底烧瓶,若__ ,则说明装置气密性良好。
(2)装置A中盛装稀盐酸的仪器名称是__ ,装置B中盛装的试剂是__ 。
(3)反应结束后,若未及时分离KMnO4晶体,会发现C中紫红色溶液变浅,其原因可能是__ 。
II.该小组继续探究Mn2+能否被氧化为MnO ,进行了下列实验:
,进行了下列实验:
已知:MnO2为棕黑色固体,难溶于水;KMnO4在酸性环境下缓慢分解产生MnO2。
(4)实验①中生成棕黑色沉淀的离子方程式为__ 。
(5)对比实验②和③,实验②的作用是__ 。
I.KMnO4的制备:
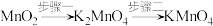
反应原理:
步骤一:3MnO2+6KOH+KClO3=3K2MnO4(墨绿色)+KCl+3H2O
步骤二:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
实验操作:
步骤一:将一定比例的MnO2、KOH和KClO3固体混合加热,得到墨绿色的固体,冷却后加水充分溶解,然后将得到的碱性K2MnO4溶液放入烧杯C中。
步骤二:连接装置,检查气密性后装入药品。打开分液漏斗活塞,当C中溶液完全变为紫红色时,关闭活塞停止反应,分离、提纯获取KMnO4晶体。
实验装置如图所示:

(1)检查装置A气密性:关闭分液漏斗活塞,在B中加入蒸馏水至液面超过长导管口,用热毛巾捂住圆底烧瓶,若
(2)装置A中盛装稀盐酸的仪器名称是
(3)反应结束后,若未及时分离KMnO4晶体,会发现C中紫红色溶液变浅,其原因可能是
II.该小组继续探究Mn2+能否被氧化为MnO
 ,进行了下列实验:
,进行了下列实验:| 装置图 | 试剂X | 实验现象 |
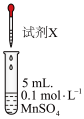 | ①1mL2mol/LNaOH和1mL1.5mol/LH2O2混合液 | 生成棕黑色沉淀 |
| ②2mL0.1mol/LHNO3溶液 | 无明显现象 | |
| ③2mL0.1mol/LHNO3溶液和少量PbO2 | 滴加HNO3溶液后试管内无明显现象,加入PbO2立即变为紫红色,稍后紫红色消失,生成棕黑色沉淀 |
已知:MnO2为棕黑色固体,难溶于水;KMnO4在酸性环境下缓慢分解产生MnO2。
(4)实验①中生成棕黑色沉淀的离子方程式为
(5)对比实验②和③,实验②的作用是
您最近一年使用:0次
2020-08-28更新
|
79次组卷
|
2卷引用:广东省湛江市第二十中学2020-2021学年高二上学期第二次阶段考试化学试题
名校
解题方法
6 . 工业制硫酸的反应原理主要有下列三个反应:
①FeS2(s)+O2(g) Fe2O3(s)+SO2(g);ΔH1
Fe2O3(s)+SO2(g);ΔH1
②2SO2(g)+O2(g) 2SO3(g); ΔH2
2SO3(g); ΔH2
③SO3+H2O=H2SO4
Ⅰ.(1)反应①配平后各物质系数分别为_____ 、______ 、_______ 、______ 。若每生成1molSO2时反应放热426.5kJ,则ΔH1=_______________ 。
(2)工业生产中将FeS2矿石粉碎后投入反应器中反应,这样做的目的是___________ 。
Ⅱ.下表是不同温度和压强下反应②中SO2的转化率
(3)反应②是气体体积缩小的可逆反应,增大压强有利于提高原料转化率,但工业生产中该反应在常压下进行,采用常压生产条件的理由是_______________________ 。
(4)若原料气组成:SO2 7%,O211%,N2 82%,在温度和压强不变的条件下,混合气体体积变为原来的97.2%,则SO2的转化率为_________ 。
Ⅲ.尾气中的二氧化硫对环境造成污染,需要处理后才能排放。常用亚硫酸钠吸收法。
(5)Na2SO3溶液吸收SO2的离子方程式为________________________ ;
(6)常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是____ (填序号)
A.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
B.c(Na+)=c(SO32-)+c(HSO3-)+C(H2SO3)
C.c(Na+)>c(SO32-)>c(OH-)>c(H+)
D.水电离出c(OH-)=l×l0-8 mol·L-1
①FeS2(s)+O2(g)
 Fe2O3(s)+SO2(g);ΔH1
Fe2O3(s)+SO2(g);ΔH1②2SO2(g)+O2(g)
 2SO3(g); ΔH2
2SO3(g); ΔH2 ③SO3+H2O=H2SO4
Ⅰ.(1)反应①配平后各物质系数分别为
(2)工业生产中将FeS2矿石粉碎后投入反应器中反应,这样做的目的是
Ⅱ.下表是不同温度和压强下反应②中SO2的转化率
| 0.1Mp | 0.5Mp | 1Mp | 10Mp | |
| 400℃ | 99.2 | 99.6 | 99.7 | 99.9 |
| 500℃ | 93.5 | 96.9 | 97.8 | 99.3 |
| 600℃ | 73.7 | 85.8 | 89.5 | 96.4 |
(3)反应②是气体体积缩小的可逆反应,增大压强有利于提高原料转化率,但工业生产中该反应在常压下进行,采用常压生产条件的理由是
(4)若原料气组成:SO2 7%,O211%,N2 82%,在温度和压强不变的条件下,混合气体体积变为原来的97.2%,则SO2的转化率为
Ⅲ.尾气中的二氧化硫对环境造成污染,需要处理后才能排放。常用亚硫酸钠吸收法。
(5)Na2SO3溶液吸收SO2的离子方程式为
(6)常温下,当吸收至pH=6时,吸收液中相关离子浓度关系一定正确的是
A.c(Na+)+c(H+)>c(SO32-)+c(HSO3-)+c(OH-)
B.c(Na+)=c(SO32-)+c(HSO3-)+C(H2SO3)
C.c(Na+)>c(SO32-)>c(OH-)>c(H+)
D.水电离出c(OH-)=l×l0-8 mol·L-1
您最近一年使用:0次
2019-11-30更新
|
96次组卷
|
2卷引用:广东省湛江第一中学2019-2020学年高二12月月考化学试题
名校
7 . 高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。其中铁元素的化合价为
| A.+2 | B.+5 | C.+6 | D.+8 |
您最近一年使用:0次
2019-07-05更新
|
475次组卷
|
8卷引用:广东省湛江市第二十一中学2019-2020学年高二上学期期中考试(学考)化学试题
名校
解题方法
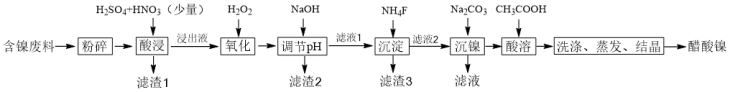
8 . 醋酸镍[(CH3COO)2Ni]是一种重要的化工原料。一种以含镍废料(含NiS、Al2O3、FeO、CaO、SiO2)为原料,制取醋酸镍的工艺流程图如下:
相关离子生成氢氧化物的pH 和相关物质的溶解性如下表:
(1)调节pH 步骤中,溶液pH的调节范围是___________________ 。
(2)滤渣1和滤渣3 主要成分的化学式分别是___________ 、___________ 。
(3)酸浸过程中,1molNiS失去6 NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式__________________________________ 。
(4)沉镍过程中,若c(Ni2+)=2.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为________ g。(保留小数点后1位有效数字)
(5)写出氧化步骤中加入H2O2 时发生反应的离子方程式___________________ 。
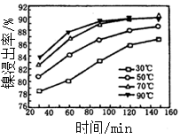
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为_______________________ 。

相关离子生成氢氧化物的pH 和相关物质的溶解性如下表:
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH | 物质 | 20℃时溶解性(H2O) |
| Fe3+ | 1.1 | 3.2 | CaSO4 | 微溶 |
| Fe2+ | 5.8 | 8.8 | NiF | 可溶 |
| Al3+ | 3.0 | 5.0 | CaF2 | 难溶 |
| Ni2+ | 6.7 | 9.5 | NiCO3 | Ksp=9.60×10-6 |
(2)滤渣1和滤渣3 主要成分的化学式分别是
(3)酸浸过程中,1molNiS失去6 NA个电子,同时生成两种无色有毒气体。写出该反应的化学方程式
(4)沉镍过程中,若c(Ni2+)=2.0 mol·L-1,欲使100 mL该滤液中的Ni2+沉淀完全[c(Ni2+)≤10-5mol·L-1],则需要加入Na2CO3固体的质量最少为
(5)写出氧化步骤中加入H2O2 时发生反应的离子方程式
(6)保持其他条件不变,在不同温度下对含镍废料进行酸浸,镍浸出率随时间变化如图。酸浸的最佳温度与时间分别为

您最近一年使用:0次
名校
解题方法
9 . 活性氧化锌是一种多功能性的新型无机材料。某小组以粗氧化锌(含铁、铜的氧化物)为原料模拟工业生产活性氧化锌,步骤如下:

已知各相关氢氧化物沉淀pH范围如下表所示:
完成下列填空:
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要______ (选填编号)
A.天平 B.滴定管 C.容量瓶 D.胶头滴管
(2)步骤II中加入H2O2溶液的作用是____________ (用离子方程式表示);
(3)用ZnO调节pH,以除去含铁杂质,调节pH的适宜范围是_______________________ 。
(4)步骤III中加入Zn粉的作用是:①__________________ ;②进一步调节溶液pH。
(5)碱式碳酸锌[Zn2(OH)2 CO3]煅烧的化学方程式为____________ 。
(6)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
①取1.000g活性氧化锌,用15.00mL 1.000mol·L-1硫酸溶液完全溶解,滴入几滴甲基橙。②用浓度为0.5000mol·L-1的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL。判断滴定终点的依据是_________ ;所得活性氧化锌的纯度为_________ 。

已知各相关氢氧化物沉淀pH范围如下表所示:
| Zn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀pH | 5.4 | 7.0 | 2.3 | 4.7 |
| 完全沉淀pH | 8.0 | 9.0 | 4.1 | 6.7 |
完成下列填空:
(1)步骤I中所需25%稀硫酸可用98%浓硫酸(密度为1.84g/mL)配制,所需的仪器除玻璃棒、烧杯、量筒外,还需要
A.天平 B.滴定管 C.容量瓶 D.胶头滴管
(2)步骤II中加入H2O2溶液的作用是
(3)用ZnO调节pH,以除去含铁杂质,调节pH的适宜范围是
(4)步骤III中加入Zn粉的作用是:①
(5)碱式碳酸锌[Zn2(OH)2 CO3]煅烧的化学方程式为
(6)用如下方法测定所得活性氧化锌的纯度(假设杂质不参与反应):
①取1.000g活性氧化锌,用15.00mL 1.000mol·L-1硫酸溶液完全溶解,滴入几滴甲基橙。②用浓度为0.5000mol·L-1的标准氢氧化钠溶液滴定剩余硫酸,到达终点时消耗氢氧化钠溶液12.00mL。判断滴定终点的依据是
您最近一年使用:0次
10 . 钛冶炼厂与氯碱厂、甲醇厂组成一个产业链(如图所示),将大大提高资源的利用率,减少环境污染。

请回答下列问题:
(1)Fe位于元素周期表中的位置是__________ 。
(2)写出流程中电解池里发生反应的离子方程式:__________ 。
(3)写出流程中“氯化”的化学方程式:__________ 。
(4)写出TiCl4完全水解生成TiO2·H2O的化学方程式:__________ 。
(5)高温炉中通入Ar的作用是___________ 。
(6)上述流程中可循环利用的物质有__________ 。
(7)下图为氯碱工业的装置示意图,使用______ (填“阴”或“阳”)离子交换膜,目的除了降低分离氢氧化钠的成本外还可以________ 。


请回答下列问题:
(1)Fe位于元素周期表中的位置是
(2)写出流程中电解池里发生反应的离子方程式:
(3)写出流程中“氯化”的化学方程式:
(4)写出TiCl4完全水解生成TiO2·H2O的化学方程式:
(5)高温炉中通入Ar的作用是
(6)上述流程中可循环利用的物质有
(7)下图为氯碱工业的装置示意图,使用

您最近一年使用:0次



