名校
1 . 某小组同学探究不同条件下氯气与二价锰化合物的反应。查阅资料显示:
a. 在一定条件下能被
在一定条件下能被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。
b.浓碱条件下, 可被
可被 还原为
还原为 。
。
c. 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。
d. 为白色沉淀。实验装置如下图:
为白色沉淀。实验装置如下图:
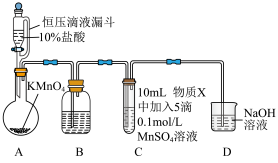
(1)A中发生的反应的化学方程式如下: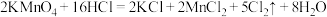 。用双线桥标出该反应中电子转移的方向、得失和数目
。用双线桥标出该反应中电子转移的方向、得失和数目___________ 。
(2)通入 前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为___________ 。
(3)对比实验Ⅰ、Ⅱ通入 后的实验现象,对于
后的实验现象,对于 还原性与溶液酸碱性的认识是
还原性与溶液酸碱性的认识是___________ 。
(4)根据资料b,Ⅲ中应得到绿色溶液,而实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入 导致溶液的碱性减弱。
导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将 氧化为
氧化为 。
。
①用离子方程式表示可能导致溶液碱性减弱的原因:___________ 。
②取Ⅲ中放置后的 悬浊液,加入
悬浊液,加入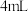 40%
40% 溶液,观察到溶液紫色迅速变为绿色,且有无色无味的气体产生,该气体的化学式为
溶液,观察到溶液紫色迅速变为绿色,且有无色无味的气体产生,该气体的化学式为___________ 。同时还可观察到溶液的绿色缓慢加深,即可证明Ⅲ的悬浊液中氧化剂过量。
a.
 在一定条件下能被
在一定条件下能被 或
或 氧化成
氧化成 (棕黑色)、
(棕黑色)、 (绿色)、
(绿色)、 (紫色)。
(紫色)。b.浓碱条件下,
 可被
可被 还原为
还原为 。
。c.
 的氧化性与溶液的酸碱性无关,
的氧化性与溶液的酸碱性无关, 的氧化性随碱性增强而减弱。
的氧化性随碱性增强而减弱。d.
 为白色沉淀。实验装置如下图:
为白色沉淀。实验装置如下图:
| 序号 | 物质X | C中实验现象 | |
通入 前 前 | 通入 后 后 | ||
| Ⅰ | 水 | 得到无色溶液 | 产生棕黑色沉淀,且放置后不发生变化 |
| Ⅱ | 5% 溶液 溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
| Ⅲ | 40% 溶液 溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
(1)A中发生的反应的化学方程式如下:
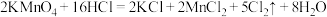 。用双线桥标出该反应中电子转移的方向、得失和数目
。用双线桥标出该反应中电子转移的方向、得失和数目(2)通入
 前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为
前,Ⅱ、Ⅲ中沉淀由白色变为棕黑色的化学方程式为(3)对比实验Ⅰ、Ⅱ通入
 后的实验现象,对于
后的实验现象,对于 还原性与溶液酸碱性的认识是
还原性与溶液酸碱性的认识是(4)根据资料b,Ⅲ中应得到绿色溶液,而实验中得到紫色溶液,分析现象与资料不符的原因:
原因一:可能是通入
 导致溶液的碱性减弱。
导致溶液的碱性减弱。原因二:可能是氧化剂过量,氧化剂将
 氧化为
氧化为 。
。①用离子方程式表示可能导致溶液碱性减弱的原因:
②取Ⅲ中放置后的
 悬浊液,加入
悬浊液,加入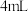 40%
40% 溶液,观察到溶液紫色迅速变为绿色,且有无色无味的气体产生,该气体的化学式为
溶液,观察到溶液紫色迅速变为绿色,且有无色无味的气体产生,该气体的化学式为
您最近半年使用:0次
2023-12-11更新
|
58次组卷
|
2卷引用:福建省厦门大学附属科技中学2023-2024学年高一上学期11月期中考试化学试题
2 . 下图所示是验证氯气性质的微型实验,a、b、c、d、e是浸有相关溶液的滤纸。向 晶体滴加浓盐酸后,立即用另一培养皿扣在上面。已知:
晶体滴加浓盐酸后,立即用另一培养皿扣在上面。已知: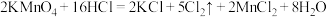 、
、 、
、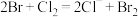 (溴单质为深红棕色)
(溴单质为深红棕色)

能全面解释实验现象且正确的是
 晶体滴加浓盐酸后,立即用另一培养皿扣在上面。已知:
晶体滴加浓盐酸后,立即用另一培养皿扣在上面。已知: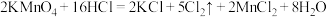 、
、 、
、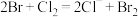 (溴单质为深红棕色)
(溴单质为深红棕色)
能全面解释实验现象且正确的是
| 选项 | 实验现象 | 解释或结论 |
| A | a处变蓝,b处变红棕色 | 氧化性: |
| B | c处先变红,后褪色 | 氯气与水生成了酸性物质 |
| C | d处立即褪色 | 氯气与水生成了漂白性物质 |
| D | e处变红色 | 还原性: |
| A.A | B.B | C.C | D.D |
您最近半年使用:0次
2022-03-18更新
|
1330次组卷
|
51卷引用:福建省龙岩第一中学2022-2023学年高一上学期第二次月考化学试题
福建省龙岩第一中学2022-2023学年高一上学期第二次月考化学试题(已下线)2013-2014学年浙江省宁波市八校高一上学期期末联考化学试卷(已下线)2014高考化学专题突破训练 专题10非金属及其化合物练习卷(已下线)2014高考名师推荐化学氯、溴、碘及其化合物主要性质(已下线)2013-2014学年浙江省杭州地区六校高二下学期期中联考化学试卷(已下线)2013-2014河北省石家庄一中上学期开学考试高二化学试卷(已下线)2015届湖南省长沙市长郡中学高三第一次月考化学试卷2015届辽宁省抚顺市二中高三上学期期中考试化学试卷2014-2015河北唐山市一中高一下学期开学调研考试化学试卷2015-2016学年黑龙江省大庆铁人中学高一上期末化学试卷2015-2016学年湖南省长沙市望城一中高一上期末化学试卷河南省南阳市2016-2017学年高一上学期期终质量评估化学试题2016-2017学年江西省南昌市第二中学高一上学期期末考试化学试卷河北省涞水波峰中学2018届高三第一次调研考试化学试题甘肃省兰州市第一中学2018届高三8月月考化学试题天津市和平区2017-2018学年高一上学期期末考试化学试题(已下线)2019高考备考一轮复习精品资料 第四章 常见的非金属及其化合物 第2讲 氯及其化合物【押题专练】辽宁省阜新市海州高级中学2019届高三上学期第一次月考化学试题河北省承德市第一中学2018-2019学年高一上学期第三次月考化学试题黑龙江省大庆市铁人中学2018-2019学年高一下学期开学考试化学试题陕西省榆林市第二中学2018-2019学年高二下学期期中考试化学试题2019届上海奉贤区高考第一次模拟化学试题陕西省西安电子科技大学附属中学2019-2020学年高一上学期期末考试化学试题2020届上海市奉贤区高考化学一模试卷2012年上海市高考化学试题(已下线)【南昌新东方】师大附中2019-2020 高一(上) 期末安徽省肥东县第二中学2019-2020学年高一下学期期中考试(共建班)化学试题河南省信阳市罗山县2021届高三第一次调研(8月联考)化学试题江西省奉新县第一中学2021届高三上学期第一次月考化学试题内蒙古自治区呼和浩特市和林格尔县第一中学2018-2019学年高二上学期第一次月考化学试题人教版(2019)高一必修第一册 第二章 海水中的重要元素 第二节 氯及其化合物 教材帮江西省上饶市横峰中学2021届高三上学期第一次月考化学试题宁夏青铜峡市高级中学2021届高三上学期期中考试化学试题黑龙江伊春林业管理局第二中学2021届高三上学期期中考试化学试题(已下线)第12讲 富集在海水中的元素——卤素(精讲)-2022年一轮复习讲练测(已下线)考点09 氯及其化合物-备战2022年高考化学一轮复习考点帮(全国通用)(已下线)考点09 氯及其化合物-备战2022年高考化学一轮复习考点帮(浙江专用)内蒙古自治区包钢第一中学2021-2022学年高三上学期10月月考化学试题浙江省绍兴市第一中学2016-2017学年高一下学期期末考试化学试题宁夏青铜峡市高级中学2021-2022学年高三上学期11月测试化学试题浙江省宁波中学2021-2022学年高一上学期期中考试化学试题(已下线)考点09 氯及其化合物-备战2023年高考化学一轮复习考点帮(全国通用)(已下线)第12讲 富集在海水中的元素——卤素(讲)-2023年高考化学一轮复习讲练测(全国通用)(已下线)第05练 氯及其化合物-2023年高考化学一轮复习小题多维练(全国通用)(已下线)第05练 氯及其化合物-2023年高考化学一轮复习小题多维练(全国通用)天津市红桥区2019-2020学年高一上学期期末考试化学试题(已下线)2.2.2 氯气与金属、非金属及还原性化合物的反应-2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)黑龙江省佳木斯市第十二中学2022-2023学年高三上学期期中考试化学试题江西省景德镇一中2022-2023学年高一上学期期中(18班)化学试题.广东省广州市第八十六中学2022-2023学年高一上学期期中考试化学试题(已下线)【知识图鉴】单元讲练测必修第一册第二单元03巩固练
解题方法
3 . 分类是认识和研究物质及其变化的一种常用的科学方法。依据物质类别和元素价态可以对物质的性质进行解释和预测。
资料:人们常用“84消毒液”进行消毒。“84消毒液”的名称源于北京某医院在1984年研制成功的一种高效含氯消毒液。“84消毒液”呈无色或淡黄色,可由Cl2与NaOH溶液反应制得,其主要成分为NaClO、 NaCl。
(1)Cl2与NaOH溶液反应的离子方程式是_______ 。
(2)某同学购买了一瓶“威露士”牌“84消毒液”,该消毒液通常稀释100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如图信息:
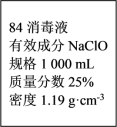
①该“84消毒液”的物质的量浓度约为_______ 。
②“84消毒液”与稀硫酸混合使用可增强消毒能力,其发生的化学反应符合规律:_______ +_______ =_______ +_______ (填物质类别 )。
某消毒小组人员用98%的浓硫酸配制250 mL 1.0 mol/L的稀硫酸用于增强“84消毒液”的消毒能力。在如图所列配制过程中,错误的是_______ (填选项字母)。
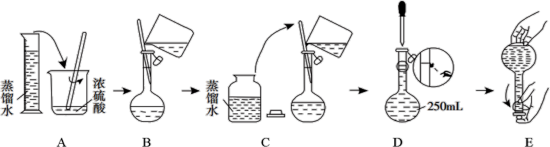
对所配制的稀硫酸进行标定,发现其浓度小于1.0 mol/L,引起误差的原因可能为_______ (填选项字母)。
A.定容时,俯视刻度线
B.转移溶液后,未洗涤烧杯和玻璃棒
C.容量瓶在使用前未干燥,里面有少量蒸馏水
D.定容摇匀后,发现液面低于容量瓶的刻度线,再加水至刻度线
(3)“84消毒液”不能与洁厕灵(含盐酸)混用,混用会发生如下反应:ClO-+Cl-+2H+=Cl2↑+H2O。
①该反应中起氧化作用的微粒是_______ 。
②若反应中生成了0.01molCl2,转移电子的物质的量为_______ mol。
(4)2016年巴西奥运会期间,由于工作人员将“84消毒液”与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO将H2O2氧化产生的O2促进藻类快速生长。该反应说明氧化性:NaClO_______ H2O2(填“>”或“<”)。
资料:人们常用“84消毒液”进行消毒。“84消毒液”的名称源于北京某医院在1984年研制成功的一种高效含氯消毒液。“84消毒液”呈无色或淡黄色,可由Cl2与NaOH溶液反应制得,其主要成分为NaClO、 NaCl。
(1)Cl2与NaOH溶液反应的离子方程式是
(2)某同学购买了一瓶“威露士”牌“84消毒液”,该消毒液通常稀释100倍(体积比)使用。查阅相关资料和消毒液包装说明得到如图信息:
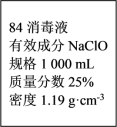
①该“84消毒液”的物质的量浓度约为
②“84消毒液”与稀硫酸混合使用可增强消毒能力,其发生的化学反应符合规律:
某消毒小组人员用98%的浓硫酸配制250 mL 1.0 mol/L的稀硫酸用于增强“84消毒液”的消毒能力。在如图所列配制过程中,错误的是

对所配制的稀硫酸进行标定,发现其浓度小于1.0 mol/L,引起误差的原因可能为
A.定容时,俯视刻度线
B.转移溶液后,未洗涤烧杯和玻璃棒
C.容量瓶在使用前未干燥,里面有少量蒸馏水
D.定容摇匀后,发现液面低于容量瓶的刻度线,再加水至刻度线
(3)“84消毒液”不能与洁厕灵(含盐酸)混用,混用会发生如下反应:ClO-+Cl-+2H+=Cl2↑+H2O。
①该反应中起氧化作用的微粒是
②若反应中生成了0.01molCl2,转移电子的物质的量为
(4)2016年巴西奥运会期间,由于工作人员将“84消毒液”与双氧水两种消毒剂混用,导致游泳池藻类快速生长,池水变绿。一种可能的原因是NaClO将H2O2氧化产生的O2促进藻类快速生长。该反应说明氧化性:NaClO
您最近半年使用:0次
2022-12-05更新
|
57次组卷
|
2卷引用:福建省建瓯市芝华中学2022-2023学年高一上学期期中考试化学试题
名校
解题方法
4 . 氯的含氧酸盐具有较强的氧化性,能够杀菌消毒,在预防新冠疫情中起到重要作用。某化学兴趣小组用氯气和相应的碱溶液反应制备 和
和 ,探究其氧化还原性质,装置如下图所示(部分装置省略)。
,探究其氧化还原性质,装置如下图所示(部分装置省略)。
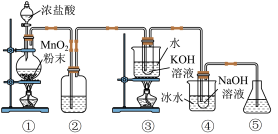
已知:氯气与碱反应时温度不同产物不同,温度较高时生成 ,温度较低时生成
,温度较低时生成 ,请回答下列问题:
,请回答下列问题:
(1)装置①中盛放浓盐酸的仪器名称为_______ 。若反应产生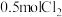 ,反应转移的电子数是
,反应转移的电子数是_______ ,被氧化的盐酸质量为_______ 。装置②的作用是_______ 。如果缺少装置②,对制取 和
和 的影响是
的影响是_______ 。
(2)装置③中反应的化学方程式为_______ ,反应结束后,取出③中试管,经冷却结晶,过滤,少量(冷)水洗涤,干燥,得到 晶体。
晶体。
(3)装置④中采用冰水浴冷却的目的是_______ 。
(4)装置⑤中的试剂下列选项中不可选用的是_______ 。
A. 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液
(5)取少量 和
和 溶液分别置于1号和2号试管中,分别滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入
溶液分别置于1号和2号试管中,分别滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显紫红色。根据上述实验,以下结论正确的是_______。
层显紫红色。根据上述实验,以下结论正确的是_______。
 和
和 ,探究其氧化还原性质,装置如下图所示(部分装置省略)。
,探究其氧化还原性质,装置如下图所示(部分装置省略)。
已知:氯气与碱反应时温度不同产物不同,温度较高时生成
 ,温度较低时生成
,温度较低时生成 ,请回答下列问题:
,请回答下列问题:(1)装置①中盛放浓盐酸的仪器名称为
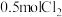 ,反应转移的电子数是
,反应转移的电子数是 和
和 的影响是
的影响是(2)装置③中反应的化学方程式为
 晶体。
晶体。(3)装置④中采用冰水浴冷却的目的是
(4)装置⑤中的试剂下列选项中不可选用的是
A.
 溶液 B.
溶液 B. 溶液 C.
溶液 C. 溶液
溶液(5)取少量
 和
和 溶液分别置于1号和2号试管中,分别滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入
溶液分别置于1号和2号试管中,分别滴加中性KI溶液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入 振荡,静置后
振荡,静置后 层显紫红色。根据上述实验,以下结论正确的是_______。
层显紫红色。根据上述实验,以下结论正确的是_______。A.氧化性: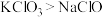 | B.氧化性: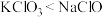 |
C.还原性: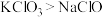 | D.还原性: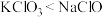 |
您最近半年使用:0次
名校
解题方法
5 . I.氯水具有多种性质,该小组同学用足量氯水分别与Na2CO3溶液,AgNO3溶液和FeBr2溶液反应。完成下列问题:
已知:常温下发生反应:i.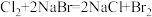 ;ii:
;ii: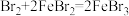
(1)证明氯水中含有盐酸,可选择的试剂是___________ 溶液(选填“Na2CO3”或“AgNO3”)。
(2)氯水与FeBr2溶液反应能证明氯水具有氧化性。请补充完整足量氯水与FeBr2溶液反应的离子方程式 :_____ 。
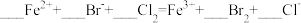 。
。
(3)久置氯水的主要成分是H2O、___________ (填化学式),用化学方程式解释分别为Cl2+H2O HCl+HClO、
HCl+HClO、___________ 。
Ⅱ.该小组同学在实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。

已知:i.氯气与碱反应时,温度不同产物不同
ii.CCl4难溶于水且密度比水大,I2在CCl4中显紫色。请回答下列问题:
(4)写出装置①中制取氯气的化学方程式,并用双线桥标出电子转移情况:___________ 。
(5)装置②盛装的试剂是___________ ,其作用是___________ 。
(6)装置③中反应化学方程式为___________ ,反应结束后,取出③中试管,经冷却结晶,过滤,少量(冷)水洗涤,干燥,得到KClO3晶体。
(7)装置④中采用冰水浴冷却的目的是___________ ,反应的离子方程 式为___________ 。
(8)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI浴液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显紫色。根据上述实验,以下结论正确的是___________。
已知:常温下发生反应:i.
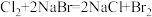 ;ii:
;ii: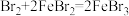
(1)证明氯水中含有盐酸,可选择的试剂是
(2)氯水与FeBr2溶液反应能证明氯水具有氧化性。请补充完整足量氯水与FeBr2溶液反应的
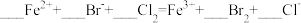 。
。(3)久置氯水的主要成分是H2O、
 HCl+HClO、
HCl+HClO、Ⅱ.该小组同学在实验室中利用下图装置(部分装置省略)制备KClO3和NaClO,探究其氧化还原性质。

已知:i.氯气与碱反应时,温度不同产物不同
ii.CCl4难溶于水且密度比水大,I2在CCl4中显紫色。请回答下列问题:
(4)写出装置①中制取氯气的化学方程式,并用双线桥标出电子转移情况:
(5)装置②盛装的试剂是
(6)装置③中反应化学方程式为
(7)装置④中采用冰水浴冷却的目的是
(8)取少量KClO3和NaClO溶液分别置于1号和2号试管中,滴加中性KI浴液。1号试管溶液颜色不变。2号试管溶液变为棕色,加入CCl4振荡,静置后CCl4层显紫色。根据上述实验,以下结论正确的是___________。
A.氧化性: | B.氧化性: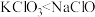 |
C.还原性: | D.还原性: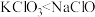 |
您最近半年使用:0次
名校
解题方法
6 . 含氯化合物在生产生活中具有广泛的用途。氯及其化合物的“价一类”二维图如图所示,回答下列问题:
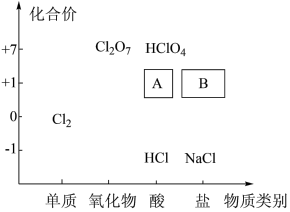
(1)自来水厂常将一定量氯气通入自来水进行消毒杀菌,用化学方程式解释为_____ ;其中具有杀菌作用的物质名称 为_____ ,实验室保存该物质的方法是将其置于_____ 试剂瓶中,_____ 保存。
(2)氯气与烧碱的反应可用于制备84消毒液,反应的化学方程式为_____ 。84消毒液的功能有_____ (填序号),其有效成分 应在“价类二维图“中的位置是_____ (选填A或B)
a.环境消毒b.器物杀菌c.织物漂白d.发酵食物
(3)某同学利用以下试剂研究HClO的性质,并进行了如下预测:
a.NaOHb.NaHCO3c.紫色石蕊试剂
从物质类别角度看,HClO具有酸性,可能与_____ 发生反应;(填标号,下同)
从化合价角度看,HClO具有氧化性,可能与_____ 发生反应;
从稳定性角度看,HClO具有不稳定性,反应的化学方程式为_____ 。
(4)漂白粉也具有和84消毒液类似的作用,漂白粉的有效成分是_____ (填化学式),漂白粉生效的化学方程式为_____ 。

(1)自来水厂常将一定量氯气通入自来水进行消毒杀菌,用化学方程式解释为
(2)氯气与烧碱的反应可用于制备84消毒液,反应的化学方程式为
a.环境消毒b.器物杀菌c.织物漂白d.发酵食物
(3)某同学利用以下试剂研究HClO的性质,并进行了如下预测:
a.NaOHb.NaHCO3c.紫色石蕊试剂
从物质类别角度看,HClO具有酸性,可能与
从化合价角度看,HClO具有氧化性,可能与
从稳定性角度看,HClO具有不稳定性,反应的化学方程式为
(4)漂白粉也具有和84消毒液类似的作用,漂白粉的有效成分是
您最近半年使用:0次
名校
7 . 氯气是一种重要的化工原料,氯气及其化合物在自来水的消毒、农药的生产、药物的合成等领域都有着重要的应用。
Ⅰ.黄色气体 是一种新型消毒剂,可用于污水杀菌和饮用水净化。
是一种新型消毒剂,可用于污水杀菌和饮用水净化。
(1) 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,则该反应的离子方程式为
,则该反应的离子方程式为________ 。
Ⅱ.某学生设计如图所示的实验装置,利用 制取氯气并与潮湿的消石灰(氢氧化钙)反应制取少量漂白粉(该反应为放热反应),回答下列问题:
制取氯气并与潮湿的消石灰(氢氧化钙)反应制取少量漂白粉(该反应为放热反应),回答下列问题:

(2)装置 中反应的化学方程式为
中反应的化学方程式为___________ 。
(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是_______ 。
②试判断另一个副反应(用化学方程式表示)________ ,为避免此副反应的发生,可将装置作何改进________ 。
Ⅰ.黄色气体
 是一种新型消毒剂,可用于污水杀菌和饮用水净化。
是一种新型消毒剂,可用于污水杀菌和饮用水净化。(1)
 与
与 在强酸性溶液中反应可制得
在强酸性溶液中反应可制得 ,则该反应的离子方程式为
,则该反应的离子方程式为Ⅱ.某学生设计如图所示的实验装置,利用
 制取氯气并与潮湿的消石灰(氢氧化钙)反应制取少量漂白粉(该反应为放热反应),回答下列问题:
制取氯气并与潮湿的消石灰(氢氧化钙)反应制取少量漂白粉(该反应为放热反应),回答下列问题:
(2)装置
 中反应的化学方程式为
中反应的化学方程式为(3)此实验所得漂白粉的有效成分偏低,该学生经分析并查阅资料发现,主要原因是在U形管中还存在两个副反应:
①温度较高时氯气与消石灰反应生成
 ,为避免此副反应的发生,可采取的措施是
,为避免此副反应的发生,可采取的措施是②试判断另一个副反应(用化学方程式表示)
您最近半年使用:0次
8 . 某化学兴趣小组设计了如图装置制取Cl2进行相关性质实验,并模拟工业生产无水氯化铁的过程。
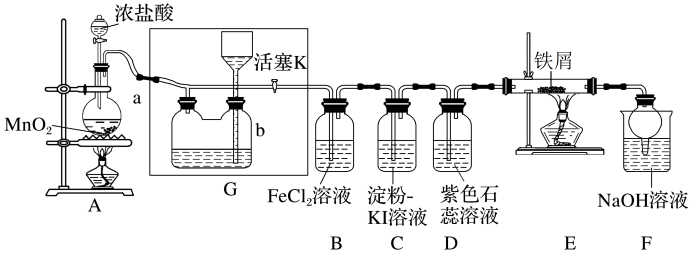
资料:①工业上向500~ -600° C的铁屑中通入氯气生产无水氯化铁。②无水氯化铁有强烈的吸水性,能吸收空气中的水分而潮解变质。根据各小题的要求,填写下列空白:
(1)装置A中装浓盐酸的玻璃仪器名称为_______ ,A中发生反应的化学方程式为_______ 。
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。回答下列问题:
①在装置C中能看到的实验现象是_______ 。
②装置E中发生反应的化学方程式为_______ 。
③装置F中发生反应的化学方程式为_______ 。
(3)利用装置G可储存多余的氯气,储气瓶b内盛放的试剂是_______ ,用0.5mol MnO2与足量的浓盐酸反应,标准状况下所得氯气的体积为_______ 。
(4)若要得到较纯净的无水氯化铁,上述装置的改进措施是:_______ 。

资料:①工业上向500~ -600° C的铁屑中通入氯气生产无水氯化铁。②无水氯化铁有强烈的吸水性,能吸收空气中的水分而潮解变质。根据各小题的要求,填写下列空白:
(1)装置A中装浓盐酸的玻璃仪器名称为
(2)实验开始时,先打开分液漏斗旋塞和活塞K,点燃A处酒精灯,让氯气充满整个装置,再点燃E处酒精灯。回答下列问题:
①在装置C中能看到的实验现象是
②装置E中发生反应的化学方程式为
③装置F中发生反应的化学方程式为
(3)利用装置G可储存多余的氯气,储气瓶b内盛放的试剂是
(4)若要得到较纯净的无水氯化铁,上述装置的改进措施是:
您最近半年使用:0次
2022-03-14更新
|
153次组卷
|
2卷引用:福建省福州高级中学2021–2022学年高一上学期半期考试化学试题
名校
解题方法
9 . 实验小组对氯气的制备和性质进行探究。
Ⅰ.实验室制备和收集氯气的常用装置如下图。
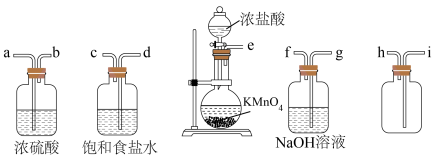
(1)盛放KMnO4固体的仪器名称是___________ 。
(2)实验装置接口的连接顺序为e→____→____→____→____→____→____→g→f,______ 。
(3)在实验过程中饱和食盐水的作用是___________ 。
(4)利用该装置制备氯气的化学方程式为___________ 。
Ⅱ.现利用如下装置进行 的性质探究,并制备家用消毒液(主要成分为
的性质探究,并制备家用消毒液(主要成分为 )。
)。
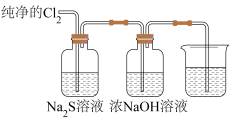
(5)B中出现黄色浑浊现象,产生此现象的离子方程式为________ ,该实验说明了氧化性:
___ S(填“>、<、=”)。
(6)制备家用消毒液的离子方程式为___________ 。
(7)家用消毒液请勿与洁厕灵(主要成分为盐酸)同时使用,否则会产生有毒气体。写出该反应的化学方程式______ 。
Ⅰ.实验室制备和收集氯气的常用装置如下图。

(1)盛放KMnO4固体的仪器名称是
(2)实验装置接口的连接顺序为e→____→____→____→____→____→____→g→f,
(3)在实验过程中饱和食盐水的作用是
(4)利用该装置制备氯气的化学方程式为
Ⅱ.现利用如下装置进行
 的性质探究,并制备家用消毒液(主要成分为
的性质探究,并制备家用消毒液(主要成分为 )。
)。
(5)B中出现黄色浑浊现象,产生此现象的离子方程式为

(6)制备家用消毒液的离子方程式为
(7)家用消毒液请勿与洁厕灵(主要成分为盐酸)同时使用,否则会产生有毒气体。写出该反应的化学方程式
您最近半年使用:0次
名校
解题方法
10 . 下列说法正确的是( )
| A.氯气的性质活泼,它与氢气混合后立即发生爆炸 |
| B.实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收 |
| C.新制氯水的氧化性强于久置氯水 |
| D.检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液 |
您最近半年使用:0次



